一定物质的量浓度溶液的配制实验报告[1]
一定物质的量浓度溶液的配制实验报告
班级: 姓名: 同组人: 实验时间:
实验目的:1、练习配制一定物质的量浓度的溶液;
2、加深对物质的量浓度概念的理解;
3、练习容量瓶的使用方法
实验仪器:托盘天平、小烧杯、药匙、100ml容量瓶、胶头滴管、玻璃棒、量筒
实验药品:NaCl固体、蒸馏水
实验(1):配制100mL0.50 mol/L的NaCl溶液
(一)实验步骤:
1、计算:需要NaCl固体的质量为 g。
2、称量:用托盘天平称量时,称量NaCl固体的质量为 g。
3、溶解:把称好的NaCl固体放入 中,用量筒量取 ml蒸馏水溶解。
4、移液:待溶液 后,将烧杯中的溶液用 引流注入容量瓶中。
5、洗涤:用少量蒸馏水洗涤烧杯内壁 次,洗涤液也都注入容量瓶。
6、旋摇:轻轻摇动容量瓶,使溶液混合均匀。
7、定容:将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下 时,改用 滴加蒸馏水至 。
8、颠倒摇匀:盖好瓶塞,反复上下颠倒, 。
9、装瓶:将配制好的试剂倒入试剂瓶,并贴上标签。
实验(2):用0.50 mol/LNaCl溶液配制100mL0.10 mol/L的NaCl溶液
(二)实验步骤:
1、计算:计算所需0.50 mol/L的NaCl溶液体积为 mL。
2、量取:用量筒量取0.50 mol/L的NaCl溶液 mL。
3、溶解:把量取好的的NaCl溶液倒入 中,用量筒量取 ml蒸馏水溶解。
4、移液:待溶液 后,将烧杯中的溶液用 引流注入容量瓶中。
5、洗涤:用少量蒸馏水洗涤烧杯内壁 次,洗涤液也都注入容量瓶。
6、旋摇:轻轻摇动容量瓶,使溶液混合均匀。
7、定容:将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下 时,改用 滴加蒸馏水至 。
8、颠倒摇匀:盖好瓶塞,反复上下颠倒, 。
9、装瓶:将配制好的试剂倒入试剂瓶,并贴上标签。
(三)误差分析
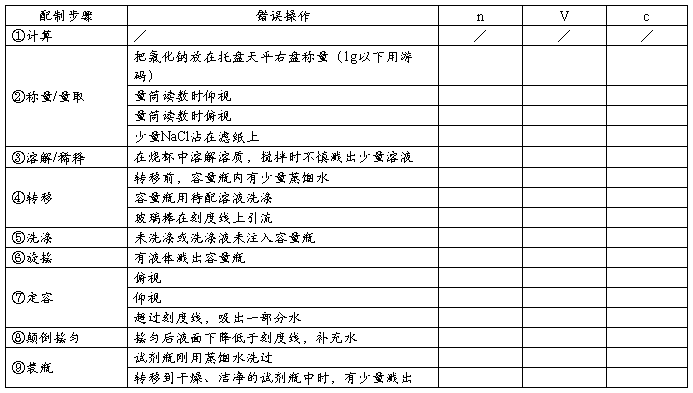
(三)问题讨论及填空
1、 容量瓶常用于配制一定体积的、浓度准确的溶液,容量瓶上标有 、 、
,它有不同规格: mL、 mL、 mL、 mL等。
2、 要进行洗涤这步操作的原因是什么?
3、 为什么要将配好的溶液,从容量瓶里倒入试剂瓶?
4、 定容时不慎滴加液体超过刻度线,则该实验失败,应倒掉重新配制。为什么?
第二篇:配制一定物质的量浓度的溶液实验报告设计
实验报告
【实验一】配制一定物质的量浓度的溶液
一、 实验目的:1、掌握配制一定物质的量浓度的溶液的操作过程和方法。
2、加深对物质的量浓度概念的理解。
3、学会容量瓶、胶头滴管、托盘天平等的使用方法。
4、培养严谨、求实的科学作风。
二、实验准备:1、若某溶液的体积为V,溶质A的物质的量为nA,则该溶液的物质的量浓度CA =
2、在实验室,配制一定物质的量浓度的溶液,可以用固体直接配制,也可以将浓溶液稀释成稀溶液。将浓溶液配制成稀溶液时,常用下面的关系式计算有关的量:
3、用固体直接配制的步骤可简单概括为五步:
用浓溶液配制稀溶液的步骤也可概括为五步:
三、实验用品:烧杯、玻璃棒、药匙、滤纸、托盘天平、 、
氯化钠固体、蒸馏水
四、实验内容:

五、实验注意点:
(1)容量瓶属于精密仪器,主要用于配制一定浓度的溶液,不允许加热。
(2)容量瓶的磨口瓶塞应配套使用,不许互换(可用绳系在瓶颈上)。
(3)使用前应进行气密性检查(方法:向容量瓶里加一定量水,用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察是否漏水。若不漏水,将瓶正立并将瓶塞旋转180度后塞紧,仍把瓶倒立过来,再检查是否漏水,如不漏水则可使用)。
(4)配溶液时应将溶质放在烧杯中溶解后,再倒入(注意:热溶液一定要将其冷却至室温)容量瓶(即容量瓶不能用来溶解物质),稀释时,应用滴管加液,以防过线。
- 配制溶液实验报告
-
一定物质量浓度溶液的配制实验报告
配制一定物质的量浓度的溶液考试内容配制100ml01molLNa2CO3溶液实验名称配制100ml01molLNa2CO3溶液实验…
-
配制一定物质的量浓度的溶液实验报告
配制一定物质的量浓度的溶液实验报告实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练习容量瓶胶头滴管的使用…
-
一定物质的量浓度溶液的配制实验报告
一定物质的量浓度溶液的配制实验报告班级姓名座号评分实验目的123实验仪器实验药品NaCl实验4配制100mL100molL的NaC…
-
无机化学实验第四版实验三:溶液的配制实验报告
实验名称溶液的配制实验日期温度气压一实验目的1学习比重计移液管容量瓶的使用方法2掌握溶液的质量分数质量摩尔浓度物质的量浓度等一般配…
-
氯化钠溶液的配置实验报告
实验4配制100mL100molL的NaCl溶液班级姓名实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
- 配制溶液实验报告
-
配制一定物质的量浓度的溶液实验报告
配制一定物质的量浓度的溶液实验报告实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练习容量瓶胶头滴管的使用…
-
一定物质量浓度溶液的配制实验报告
配制一定物质的量浓度的溶液考试内容配制100ml01molLNa2CO3溶液实验名称配制100ml01molLNa2CO3溶液实验…