实验_NaOH溶液的配制和标定(报告样板)
实验 NaOH溶液的配制和标定
一、实验目的
(略)
二、原理
以邻苯二甲酸氢钾(C6H4·COOH·COOK)作基准物,标定NaOH标准溶液的反应如下:
C6H4·COOH·COOK + NaOH = C6H4·COONa·COOK + H2O
化学计量点时的反应产物是邻苯二甲酸钾钠,在水溶液中显弱碱性,因此可用酚酞作指示剂。
三、实验内容
1.0.1mo1·L-1NaOH溶液的配制
配制方法同上一次实验。
2.0.1mo1·L-1NaOH溶液浓度的标定
实验步骤:
准确称取邻苯二甲酸氢钾0.4~0.6g三份于锥形瓶

 终点(粉红,30s内不褪色)。
终点(粉红,30s内不褪色)。
记录NaOH用量,求出 ,并求出三份测定结果的相对平均偏差,要求小于0.3%。
,并求出三份测定结果的相对平均偏差,要求小于0.3%。
四、数据记录和结果处理

计算式:
 ,
, 
五、讨论和思考题(预习报告中不必写)
用邻苯二甲酸氢钾作基准物,标定0.1mol·L-1NaOH溶液的准确浓度。计算邻苯二甲酸氢钾的称量范围?
答:邻苯二甲酸氢钾即C6H4·COOH·COOK或写为KHC8H4O4或写为 ,
,
邻苯二甲酸氢钾和NaOH的反应:
NaOH + KHC8H4O4 = KNaC8H4O4 + H2O
当滴定到达化学计量点,此反应的化学计量关系:
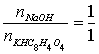 ( 1 )
( 1 )
式中, ——反应消耗NaOH的量(单位:mol),
——反应消耗NaOH的量(单位:mol),
 ——反应消耗KHC8H4O4的量(单位:mol)
——反应消耗KHC8H4O4的量(单位:mol)
因为, ,
,  代入( 1 )得
代入( 1 )得

所以, 
已知滴定管使用体积需是 20~30 ml,故
当 =0.1mol·L-1,
=0.1mol·L-1, =20mL时,
=20mL时,
当 =0.1mol·L-1,
=0.1mol·L-1, =30mL时,
=30mL时,
所以用邻苯二甲酸氢钾标定0.1mol·L-1NaOH溶液的准确浓度,应称取基准物0.4~0.6克。
第二篇:EDTA标准溶液的配制与标定
实验3 EDTA标准溶液的配制与标定
一、实验目的
1.掌握EDTA标准溶液配制和标定的方法;
2.了解金属指示剂变色原理及使用注意事项。
二、实验原理
EDTA标准溶液常用乙二酸四乙酸二钠(EDTA-2Na·2H2O)配制。EDTA-2Na·2H2O为白色结晶粉末,因不易制得纯品,标准溶液常用间接法配制,以ZnO为基准物质标定其浓度。滴定条件:pH=10,以铬黑T为指示剂,终点由酒红色变为纯蓝色。滴定过程中的反应为:
滴定前: 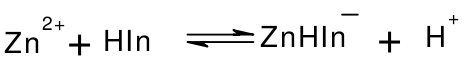
终点时: 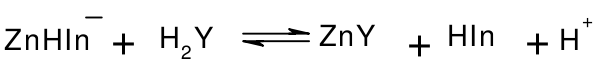
纯蓝色
三、试 剂
EDTA-2Na·2H2O :A.R.
ZnO:基准试剂
铬黑T指示剂:称取铬黑T 0.5g和盐酸羟胺,溶于乙醇,用乙醇稀释至100mL,摇匀。
氨-氯化铵缓冲溶液(pH=10):取20gNH4Cl溶于少量水中,加入100mL浓氨水,用水稀释至1000mL。
氨试液:取浓氨水400mL,加水使成1000mL。
四、实验步骤
(一) 0.05mol/LEDTA溶液的配制 取EDTA-2Na·2H2O9.5g,加100mL蒸馏水温热使溶液,稀释至500mL,摇匀,贮存于聚乙烯瓶中。
(二) 0.05mol/LEDTA溶液的标定 精密称取已在800℃灼烧至恒重的基准ZnO约0.12g,加稀HCl3mL使之溶解,加蒸馏水25mL,滴加氨试液至溶液呈微黄色。再加蒸馏水25mL,氨-氯化铵缓冲溶液10mL,铬黑T指示剂3—4滴,用EDTA溶液滴定至溶液由酒红色变为纯蓝色即为滴定终点。作三次平行测定。
实验流程
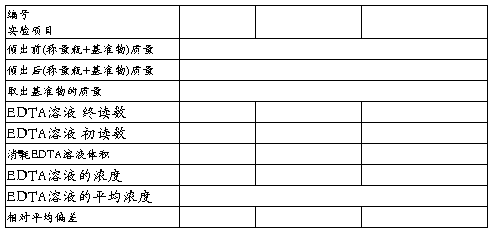
五、数据记录与处理
六、注意事项
1.滴加氨试液至溶液呈微黄色,应边加边摇,若出现Zn(OH)2↓。遇此情况,可用稀HCl调回,使沉淀溶解。
2.配位反应为分子反应,反应速度不如离子反应快,近终点时,滴定速度不宜太快。
七、思考题
1.酸度对配位反应有何影响?为什么要加氨-氯化铵缓冲溶液?
2.选择金属指示剂的原则是什么?
参考文献:张龙、潘亚芬 《化学分析技术》
邢文卫、李炜 《分析化学实验》
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
氯化钠溶液的配置实验报告
实验4配制100mL100molL的NaCl溶液班级姓名实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
- 配制溶液实验报告
-
配制一定物质的量浓度的溶液实验报告
配制一定物质的量浓度的溶液实验报告实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练习容量瓶胶头滴管的使用…
-
一定物质量浓度溶液的配制实验报告
配制一定物质的量浓度的溶液考试内容配制100ml01molLNa2CO3溶液实验名称配制100ml01molLNa2CO3溶液实验…