包装验证方案&报告)
包装验证方案&报告
编制: 日期:
审核: 日期:
批准: 日期:
目 录
1概述-------------------------------------------------------------------------------------3
2 目的-------------------------------------------------------------------------------------3
3 适用范围-------------------------------------------------------------------------------3
4 验证参考资料-------------------------------------------------------------------------4
5 验证小组成员及职责----------------------------------------------------------------4
6 包装材料选择评价-------------------------------------------------------------------4
7 包装成型工艺确认-------------------------------------------------------------------6
7.1 设备及材料-------------------------------------------------------------------------6
7.2 安装确认----------------------------------------------------------------------------6
7.3 运行确认----------------------------------------------------------------------------8
7.4 性能确认----------------------------------------------------------------------------9
8 异常情况处理程序--------------------------------------------------------------------11
9 再确认----------------------------------------------------------------------------------12
1. 概述
一次性输氧面罩/一次性雾化面罩/鼻氧管系列产品是我公司采用mim技术,自主开发的医疗器械,属于二类医疗器械,该产品采用XXX包装有限公司医材有限公司在十万级净化厂房加工制作的医用纸塑包装袋,符合美国FDA食品接触标准。医用纸塑包装袋由PET12/PE40吹塑薄膜和Tyvek(2FSTM4058B)透析纸。 Tyvek(2FSTM4058B)是美国杜邦公司生产,Tyvek作为无菌医疗器械的初包装运用有30年的历史,Tyvek(2FSTM4058B)具有高强度,高阻菌,寿命长,优异的抗微生物渗透能力,灭菌后撕口干净不带纸屑。
2. 目的
建立一次性输氧面罩/一次性雾化面罩/鼻氧管系列产品在预期的使用、贮存寿命、运输和贮存条件中保持产品无菌性和完整性的包装系统。确认包装系统能有效保护产品和便捷/无菌开启工艺。
3. 适用范围
本方案适用本公司生产的XXX产品最终灭菌初包装的验证。
4. 验证参考资料
4.1 ISO 11607-1:2006 Packaging for terminally sterilized medical devices Part 1: Requirements for materials, sterile barrier systems and packaging systems.
4.2 ISO 11607-2:2006 Packaging for terminally sterilized medical devices Part 2: Validation requirements for forming, sealing and assembly processes.
4.3 EN868-1:2007 Packaging materials and systems for medical devices which are to be sterilized Part 1 General requirements and test methods.
4.4 EN868-5: Packaging materials and systems for medical devices which are to be sterilized Part 5: Heat and self-sealable pouches and reels of paper and plastic film construction—Requirement and test methods.
4.5 GB/T 15171-1994软包装件密封性能试验方法。
4.6 ASTM F 1980-02 Standard Guide for Accelerated Aging of Sterile Medical Device Packages.
4.7 GB/T 458—2002 纸和纸板透气度的测定(肖伯尔法)。
4.8 ISO 11737.1-2005《医疗器械灭菌-微生物学方法 第1部分:产品上微生物总数估计》。
4.9 ISO 11737.1-2005《医疗器械灭菌-微生物学方法 第2部分:确认无菌过程中进行的无菌试验》。
4.10 ASTM D 4169《包装运输模拟试验》。
4.11 包装确认程序文件。
5. 验证小组成员及职责

6. 内包装材料特性的选择评价:
6.1 评价项目:(厂家提供药包材的资质报告)
A. 微生物屏障
B. 生物相容性和毒理学特性
C. 物理和化学特性
D. 与成型和密封过程的适应性
E. 与预期灭菌过程的适应性
F. 灭菌前和灭菌后的储存寿命条件
6.2 评价方法:
6.2.1微生物屏障确认:
6.2.2 目的:PET12/PE40易撕膜和Tyvek(2FSTM4058B)阻隔微生物的能力。
6.2.3 内容及方法
Ø 不渗材料
PET12/PE40易撕膜:检查包装材料供应商提供的材质报告,找出符合该项确认的报告或参照 “《GB/T 458—2002 纸和纸板透气度的测定》中的肖伯尔法”测试材料的透气性。
见附1。
Ø 多孔材料
特卫强(2FSTM4058B):检查包装材料供应商提供的材质报告,找出符合该项确认的报告;通过确认最小微生物不能通过材料孔径的方法证明材料具有阻隔所有微生物的能力。
结果评价:有相应的实验报告,并且报告结果显示所选用材料具有阻隔微生物进入的能力。
6.2.2 生物相容性和毒理学确认:
6.2.2.1 目的:确认包装材料不释放出足以损害健康的毒性物质,材料的生物学特性符合医用要求。
6.2.2.2 内容方法:检查包装材料供应商提供的材质报告,找出符合该项确认的报告,如缺失或不符合标准ISO 11607-1:2006要求的,需按相应实验方法补做或更换不符合要求的包装材料。
6.2.2.3 结果评价:有相应的实验报告,并且报告结果数据说明材料不释放出足以损害健康的毒性物质,材料有很好的生物相容性符合医用材料要求。
6.2.3物理和化学确认:
6.2.3.1 目的:确认包装材料的抗拉强度,缺口撕裂强度,透析度,厚薄均匀性。
6.2.3.2 内容及方法:检查包装材料供应商提供的材质报告,找出符合该项确认的报告,如缺失或不符合标准ISO 11607-1:2006要求的,需按相应实验方法补做或更换符合要求的包装材料。
6.2.3.3 结果评价:有相应的实验报告,并且报告数据显示,包装材料的机械强度在日常条件下有效的保护产品,透析材料厚薄均匀,无孔洞缺陷。
6.2.4 与成型和密封过程的适应性:见成型和密封过程确认外观项检查。
6.2.5 与辐照灭菌相适应性确认:
6.2.5.1 目的:确认所用的包装材料在规定限度内适合于已确定的灭菌过程。
6.2.5.2 内容及方法:检查包装材料供应商提供的材质报告,找出符合该项确认的报告,如缺失或不符合标准ISO 11607-1:2006要求的,需按相应实验方法补做或更换符合要求的包装材料。
6.2.5.3 结果评价:有相应的实验报告,并且报告结果数据符合标准要求。
6.2.6灭菌前及灭菌后的贮存寿命条件确认:
6.2.6.1 目的:在规定的贮存、运输条件下,确认包装材料是否能保证其特性。
6.2.6.2 内容及方法:检查包装材料供应商提供的材质报告,找出符合该项确认的报告,如缺失或不符合标准ISO 11607-1:2006要求的,需按相应实验方法补做或更换符合要求的包装材料。
6.2.6.3 结果评价:有相应的实验报告,并且报告结果证明贮存、运输过程对包装系统的完整性无明显影响。(加速老化试验)。
7.包装成形工艺确认
7.1设备及材料
7.1.1 设备
封口机:DBF-900多功能自动塑料薄膜连续封口机
AIGU推拉力计:NK-50
7.1.2材料
特卫强(2FSTM4058B): Tyvek(2FSTM4058B)76克透析纸
PET12/PE40易撕膜: PET12/PE40
7.2 安装确认(IQ)
7.2.1 目的:确认封口设备是否安装完整可靠,仪表是否准确,为进一步包装过程的验证运行提供保障。
7.2.2 内容及方法
a) 确认设备技术资料:检查所安装设备的名称、型号规格、性能参数、制造商、制造日期是否与设备档案、文件相符。
b) 仪表的校准:确认包装设备和封口设备上的所有仪表有标识并能正常运行。
c) 设备安装环境确认:确认设备安装处预留有足够的空间用以生产以及设备的维护、调节和清洁。安装环温度、湿度是否在设备厂家规定的范围内。
d) 设备动力输入确认:确认设备输入电压是否在设备技术参数范围内,输入气压是否高于预设值上限,供气是否稳定。
7.2.3 结果评价
表-1 IQ检查对照表

7.3 运行确认(OQ)
7.3.1 目的:在设备技术参数内,找出对包装和封口的最佳工艺条件,保证包装封口的完整性和便捷/洁净开启性。
7.3.2 内容及方法
7.3.2.1 包装过程参数确认:
² 参数预设:封口时间、温度是热封关键工艺参数,PET12/PE40易撕膜和Tyvek(2FSTM4058B)的涂胶成份对这些参数的选择有重要影响,根据经验,预设定参数范围如下。
A. 封口速度:1米/3秒-1米/8秒
温 度: 180℃
表3-1 包装参数正交试验表

B.
封口速度: 1米/5秒
温 度:160℃-200℃
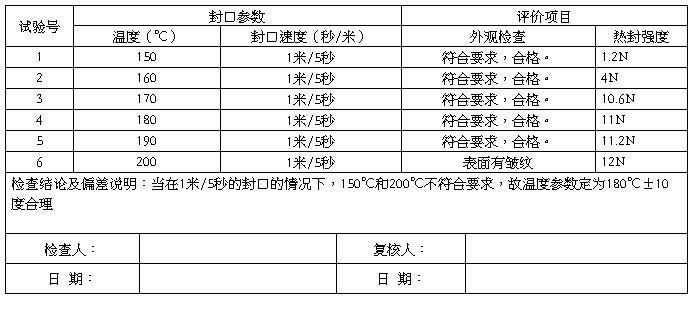
7.3.2.2 结果评价:
a)外观检查:用肉眼或放大镜观察,以产品包装无明显污物、脏点、变色、包装材料不得明显变形和破漏为接受标准。热合线的总宽度应不小于6mm,密封应覆盖各热封线的整个宽度,且热封线边缘上无10mm以上的纸片,参考依据EN 868-5 附录C。成型完整,各部分平滑,不得有明显的褶皱和起筋的现象,起筋不得影响产品放入,产品放入后不得有压头、松动情况出现。
b)热封强度测试:灭菌前和灭菌后包装样品的热封强度值不小于1.5 N/15mm,具体实验测试方法参考EN868-5 附录D,测试角度为180度,样品宽度为15mm。
7.4 性能确认(PQ)
7.4.1 目的:通过性能确认进一步确认包装参数是否符合产品包装的要求,确认包装封口过程的稳定性。
7.4.2 人员培训的要求:封口过程属于特殊过程,需对封口操作人员进行培训,并记录培训过程。
结果确认:有培训记录,正常
7.4.3 按7.3确认的封口参数模拟实际生产过程的批数量(150包),连续封口三批进行性能确认。
结果确认:符合要求
7.4.4 抽样方案:抽样方案依据GB2828.1-2003一般检验水平Ⅱ。
表-4 性能确认检查结果

7.4.5 检验项目:
7.4.5.1 包装完整性测试:
² 目的:确认包装系统的完整性。
² 方法:根据产品包装情况可选择EN 868-1 附五,采用EN868-1时,应保证每个热封面都有罗丹明溶液浸润,在放入60℃烘箱内烘15分钟以确保罗丹明溶液干燥,以没有明显的贯穿整个热封面的溶液通道为通过标准。
² 结果要求:全部符合规定。
7.4.5.2 包装系统便捷/洁净开启确认:
² 目的:确认包装系统材料机械强度合格,各热合处热合强度适中,开启便捷/洁净。
² 方法:检验员用手从包装“V”字形封口或开口处均速撕开。
² 结果要求:封口开启洁净顺畅,包装系统中各材料不被撕破和形成毛边。
7.4.5.3 包装系统保护性确认:
² 目的:确认包装系统各材料具有一定的机械强度,构成包装系统各材料间结合处有一定的强度。
² 方法:检查供应商提供的材料报告,找出材料的拉伸强度,戳穿强度,缺口撕裂强度,耐破强度;将包装系统热合边剪成宽为15mm的样品,测试角度为180度,测试包装系统各材料间强度。
² 结果:依照包装材料供应商提供的实验数据可证明包装材料有足够的机械强度,包装系统各材料间热合强度大于1.5 N/15mm。
7.4.6与标签系统相适应性确认:
² 目的:确认包装材料与标签系统在确定的灭菌条件下是否适应,标签系统在灭菌前后是否均清晰,灭菌是否引起标签墨迹向产品迁移。
内容及方法:由具有正常视力或矫正视力的检验人员按检验操作规程、合适的光照条件下,对灭菌前后的标签系统字迹和图案进行观察。
结果评价:标签系统字迹和图案未出现模糊,墨迹未向包装内渗透。
7.4.7 包装系统贮存、运输确认:
² 目的:在规定的贮存、运输条件下,确认包装材料是否能保证其特性。
² 方法:运输试验应考虑产品的运输方式(陆运)、可能的最长运输距离,模拟实际可能发生的情况。
² 结果:经过运输模拟试验后,包装系统性能满足完整要求,产品保持无菌状态。
8 异常情况处理程序
(1)验证过中应严格按照文件规定执行;
(2)验证中出现部分项目不合格时,可重新取样检测,重新检测必须合格,必要时可分段验证;
(3)验证中出现漏项、偏差、更改设定标准等,必须报告验证小组,批准后方可按新方案执行。
9 再确认
9.1 再确认的条件
当发生以下情况时,应进行再验证:
a) 当产品更换包装型式、包装材料时;
b) 当灭菌工艺发生变化时;
c) 当包装工艺改变时;
d) 当包装设备大修后或连续出现包装质量事故时;
e) 正常情况下,应至少每年进行一次再确认。
9.2 再验证结论的确认
验证小组负责对验证的过程和所取得的数据进行确认、形成验证结论并会签。所有关于再验证的资料、所取得的数据、表单和再验证报告应妥善保管、存档。


-
报案报告
报案报告被控告人吴玉霞女19xx年2月12日出生汉族黑龙江省伊春市人住山东省烟台市福山区商业街永乐公寓2号楼1单元1层东系烟台钰霞…
-
报案材料范本
报案书报案人:医药电子商务有限公司;联系电话:0731-公司地址:市大道号;犯罪嫌疑人:,男,汉族,19年9月12日出生;身份证号…
-
职务侵占罪报案报告
报案报告报案人xx公司地址法定代表人职务总经理联系电话被报案人xx男汉族19xx年月日生原xx公司职工户籍地址上海市x村电话报案事…
-
报案报告
报案报告报案人唐伶俐女19xx年8月14日出生汉族零陵人城市居民住零陵区司马塘路31号电话133xxxxxxxx被报案人周祖明绰号…
-
报 案 报 告
报案报告报案人李彩云女60岁司马塘社区居委会居民住司马塘路2号电话138xxxxxxxx被报案人唐国仁男30多岁石岩头镇三司口庙村…
-
非常好的片剂工艺验证方案及报告
XXXXX工艺验证方案YZSG1XX037类别验证管理工艺验证方案制定人制定日期年月日审核人审核日期年月日批准人批准日期年月日颁发…
-
包装验证报告
包装确认报告1验证目的本公司生产产品为无菌产品需要进行灭菌双管部分初包装使用三边热封袋其由杜邦特卫强Tywek1073B热封纸和透…
-
实验分析用测试方法验证报告
方法验证报告方法名称验证单位通讯地址报告编写人报告日期1原始测试数据11实验室基本情况表11参加验证的人员情况登记表表12使用仪器…
-
方法验证报告模板最终
分析方法验证报告ZBYZ20xx000项目名称磷酸盐的测定分析方法磷钼蓝分光光度法方法编号验证人员乔柱史红艳验证日期20xx102…
-
罗氏性能验证报告模板
电化学发光免疫检验项目性能验证报告一检测系统我院检验科生化室共申请认可的电化学发光检验项目27项各项目的检测系统配对情况如表1故各…
-
产品质量检测报告(样板)
介休市昌盛煤气化有限公司产品粗苯检测报告检验部门化验室报告日期年月日介休市昌盛煤气化有限公司产品粗苯检测报告检验部门化验室报告日期…