ELISA完全总结
ELISA缓冲液配方
书中ELISA封闭液:含5%脱脂奶粉或者5%BSA的PBS,请问5%BSA指的也是质量分数吗?,因为师姐笔记写的是体积分数,网上查了查也没弄清楚,请指教。
样品稀释液可以直接就用PBS稀释吗?文献上提到稀释液中也含脱脂奶粉或BSA,请指教 PBST中吐温-20的体积分数为0.05%,这个含量是固定的吗?1.含5%脱脂奶粉或者5%BSA的PBS,5%BSA用质量分数即可;
2.样品稀释液一般可以用洗液直接稀释,也可加入一些蛋白(如脱脂奶粉或BSA)或牛、兔等血清,要根据你的试验而定;
3.至于PBST中吐温-20的体积分数,可以0.05%—0.2%,可以在你试验过程中摸索。
4.提供一般科研用简单配方,这些你都可以在网上或别人的文章中查到,仅供参考: 洗涤缓冲液(PH7.4 PBS):0.15M
KH2PO4 0.2克
Na2HPO4·12H2O 2.9克
NaCl 8.0克
KCl 0.2克
Tween-20 0.05% 0.5ml
加蒸馏水至1000ml
封闭液:
牛血清白蛋白(BSA) 5克
加洗涤缓冲液至100ml。
稀释液:
牛血清白蛋白(BSA) 1克
加洗涤缓冲液至100ml
或以羊血清、兔血清等血清与洗涤液配成5~10%使用。BSA最好现配,价格又比脱脂奶粉贵,所以宜少量现用现配!
BSA一般是质量体积比,正如楼上所说,1%~3%为宜,如果实在是结果假阳性多,可加到5%!
TBST中吐温的浓度与你的洗涤强度(洗涤次数,洗涤时间,振荡幅度)有关,需要按实验数据来变化!
一、操作步骤
用于检测未知抗体的间接法
1. 包被:用0.05MpH9.6碳酸盐包被缓冲液将抗原稀释至蛋白质含量为
1~10μg/mL。在每个聚苯乙烯板的反应孔中加0.1mL,37℃温育2小时。弃去孔内溶液,用洗涤缓冲液洗3次,每次3分钟。(简称洗涤,下同)
2. 封闭:间接法测定中,封闭一般是不可少的,最常用的封闭剂是0.05%-0.5%
的牛血清白蛋白,每孔中加0.1 mL,37℃温育1-2小时,弃去孔内溶液,用洗涤缓冲液洗3次,每次3分钟。(同时做空白孔、阴性对照孔及阳性对照孔)
3. 加样:加一定稀释的待检样品(未知抗体)0.1 mL于上述已包被之反应孔中,
置37℃孵育1小时。然后用洗涤缓冲液洗3次,每次3分钟。(同时做空白孔、阴性对照孔及阳性对照孔)
4. 加酶标抗体:于各反应孔中,加入新鲜稀释的酶标抗体(经滴定后的稀释度)
0.1 mL。37℃孵育0.5-1小时,洗涤3次,最后一遍用DDW洗涤,DEA(二乙醇氨)缓冲液平衡5min。
5. 加底物液显色:于各反应孔中加入临时配制的100μL 1mg/mL的PNPP,30℃45
分钟显色。
6. 终止反应:于各反应孔中加入1M氢氧化钠0.05mL。
7. 结果判定:可于白色背景上,直接用肉眼观察结果:反应孔内颜色越深,阳
性程度越强,阴性反应为无色或极浅,依据所呈颜色的深浅,以“+”、“-”号表示。也可测定OD值:在ELISA检测仪上,于405nm处,以空白对照孔调零后测各孔OD值,若大于规定的阴性对照OD值的2.1倍,即为阳性。计算公式:(待测样OD-空白OD)/(阴性对照OD-空白OD)。若两者比值大于2.1可判读为阳性。
二、试剂配方:
1. 试剂
(1) 包被缓冲液(pH9.6 0.05M碳酸盐缓冲液):
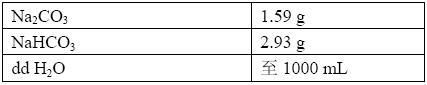
Na2CO3 1.59克 NaHCO3 2.93克 加蒸馏水至1000mL。
(2) 洗涤缓冲液(pH7.4 PBS):0.15M KH2PO4 0.2克
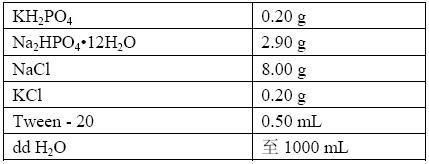
Na2HPO4·12H2O 2.9克 NaCl 8.0克 KCl 0.2克 Tween-20 0.05% 0.5mL 加蒸馏水至1000mL。
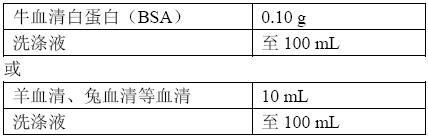
(3) 稀释液:牛血清白蛋白(BSA)0.1克 加洗涤缓冲液至100mL。
(4) 终止液(1M NaOH):4克NaOH溶于80mL DDW中,加DDW
定容至100毫升。
(5) 底物缓冲液(pH9.8二乙醇氨):二乙醇氨97mL,加水至900mL,
HCl调pH至9.8,定容至1L。
(6) PNPP:取5mg底物缓冲液,按1mg/mL加入PNPP。反应前10min
配制此溶液。
(7) 酶联缓冲液(pH7.4):PVP(MW24000)20.0g;Tween-20 0.5mL;
BSA2.0g;MgCl2·6H2O0.2g。上述药品溶于PBS溶液中,定容
至1L。
2. 器材:
(1) 聚苯乙烯塑料板(简称酶标板)40孔或96孔,ELISA检测仪,
50μL加样器,塑料滴头,小毛巾,洗涤瓶。
(2) 小烧杯、玻璃棒、试管、吸管和量筒等。
(3) 4℃冰箱,37℃孵育箱。
1. 包被抗原的选择
包被抗原可分为天然蛋白、重组蛋白和小分子抗原三大类。天然蛋白需经纯化才能用直接吸附法包被,对于含杂质较多的抗原可以采 用间接捕获法包被(先用能够与目的抗原反应的物质如抗体直接吸附在酶标板上,再通过特异性反应使抗原固相化)。经纯化的重组蛋白一般皆可直接包板。小分子 抗原比如多肽以及一些小分子有机化合物,由于分子量太小,往往难于直接吸附在酶标板上,一般都先使其与无关蛋白质如BSA等偶联,偶联物吸附于固相载体 上。
2.包被液的选择
一般常用的是pH9.6的碳酸盐缓冲液,如果包被的抗原在碱性条件下不稳定的话,也可
以使用pH7.2的磷酸 盐缓冲液。
3.包被温度的选择
通常是4-8度条件下过夜或者37度保温2小时,我们强烈建议4-8度条件下包被,有利于蛋白活性的保 持。
4.包被浓度的选择
包被的最适浓度随固相载体和包被物的性质变化,一般蛋白质的包被浓度为1-5ug/ml,要明确针对特定包 被抗原的最适包被浓度需要通过实验来确定。
包板后需要封闭吗?应该选择什么样的封闭体系?
封闭是否必要,取决于ELISA的模式 及具体的实验条件。一般说来,双抗体夹心法,只要酶标记物是高活性的,操作时洗涤彻底,不经封闭也可得到满意的结果。而在间接法测定中,封闭一般是必不可 少的。
常用的封闭剂有0.05%-0.5%的BSA、10%的小牛血清、1%明胶、5%的脱脂奶粉,AbMART推荐使用5%脱脂奶粉,价廉而且 封闭能力强,不过5%脱脂奶粉只适合短期内使用,不宜长期保存,所以试剂盒中较少使用。
ELISA双抗体夹心法原理、特点和实验步骤
1、原理
ELISA 的基础是抗原或抗体的固相化及抗原或抗体的酶标记。结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。受检标本与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与液体中的其他物质分开。加入酶标记的抗原或抗体,通过反应也结合在固相载体上。加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,根据呈色的深浅进行定性或定量分析。酶的催化效率很高,间接地放大了免疫反应的结果,使测定方法达到很高的敏感度。
2、特点
某些分泌型蛋白,用siRNA 干扰后可以用ELISA 进行检测。
3、ELISA 实验流程示图(以双抗体夹心法为例)
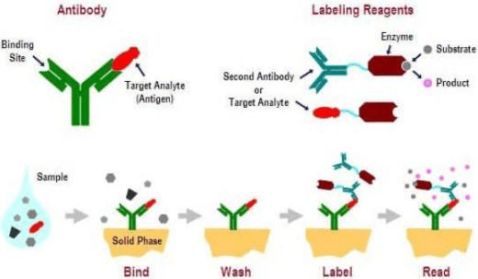
4、试剂与耗材
(1) 包被缓冲液 (pH 9.6 0.05 M 碳酸盐缓冲液):
(2)洗涤缓冲液 (pH 7.4,0.15 M PBS):
(3)稀释液:
(4)终止液(2 M H2SO4):

(5)底物缓冲液 (pH 5.0):
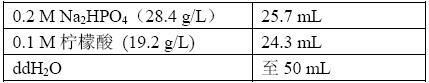
(6)四甲基联苯胺(TMB)使用液:

(7)2,2’-连氮基-双-3-乙基-苯丙噻唑啉磺胺(ABTS)使用液:
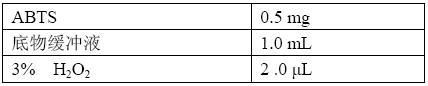
(8)抗原、抗体和酶标记抗体:按说明书处理。
(9)标准品:用稀释液稀释成梯度浓度溶液。
(10)96 孔聚苯乙烯塑料板 (酶标板)。
2、实验步骤(双抗体夹心法):
(1)包被:用包被缓冲液将抗体稀释至蛋白质含量为1-10 μg/mL。在酶标板反应孔中加0.1 mL,4℃过夜。次日,弃去孔内溶液,用洗涤缓冲液洗板3 次,每次3 min。
(2)加样:加一定浓度稀释的待检样品(同时做空白对照,阴性对照孔及阳性对照)0.1 mL 于上述已包被的反应孔中,置湿盒中,37℃, 1 hr。用洗涤缓冲液洗板3 次,每次3 min。
(3)加酶标抗体:于各反应孔中,加入新鲜稀释的酶标抗体 (经滴定后的稀释度) 0.1ml。 37℃,0.5 - 1 hr,用洗涤缓冲液洗板3 次,每次3 min。
(4)加底物液显色:于各反应孔中加入现配的TMB 底物溶液0.1 mL,37 ℃,10 - 30min。
(5)终止反应:于各反应孔中加入终止液0.05 mL。
(6)结果判定:将酶标板在

读数,输出到Excel 中。
(7)以标准品浓度为横坐标,吸光度为纵坐标,生成标准曲线和直线回归方程式,根据公式计算未知样品的浓度,并记录。
酶标仪

上,于450 nm (若ABTS 显色,读410 nm),
第二篇:酶联免疫吸附实验(ELISA)全套解决方案
酶联免疫吸附实验(ELISA)全套解决方案
基本原理
19xx年Engvall和Perlmann发表了酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)用于IgG定量测定的文章,使得19xx年开始用于抗原定位的酶标抗体技术发展成液体标本中微量物质的测定方法。这一方法的基本原理是:①使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。②使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅刊物定性或定量分析。由于酶的催化频率很高,故可极大地地放大反应效果,从而使测定方法达到很高的敏感度。
方法类型和操作步骤
ELISA可用于测定抗原,也可用于测定抗体。在这种测定方法中有3种必要的试剂:①固相的抗原或抗体,②酶标记的抗原或抗体,③酶作用的底物。根据试剂的来源和标本的性状以及检测的具备条件,可设计出各种不同类型的检测方法。
(一)双抗体夹心法
双抗体夹心法是检测抗原最常用的方法,操作步骤如下:
(1)将特异性抗体与固相载体连接,形成固相抗体:洗涤除去未结合的抗体及杂质。
(2)加受检标本:使之与固相抗体接触反应一段时间,让标本中的抗原与固相载体上的抗体结合,形成固相抗原复合物。洗涤除去其他未结合的物质。
(3)加酶标抗体:使固相免疫复合物上的抗原与酶标抗体结合。彻底洗涤未结合的酶标抗体。此时固相载体上带有的酶量与标本中受检物质的量正相关。
(4)加底物:夹心式复合物中的酶催化底物成为有色产物。根据颜色反应的程度进行该抗原的定性或定量。
根据同样原理,将大分子抗原分别制备固相抗原和酶标抗原结合物,即可用双抗原夹心法测定标本中的抗体。
(二)双位点一步法 在双抗体夹心法测定抗原时,如应用针对抗原分子上两个不同抗原决定簇的单克隆抗体分别作为固相抗体和酶标抗体,则在测定时可使标本的加入和酶标抗体的加入两步并作一步(图15-5)。这种双位点一步不但简化了操作,缩短了反应时间,如应用高亲和力的单克隆抗体,测定的敏感性和特异性也显著提高。单克隆抗体的应用使测定抗原的ELISA提高到新水平。
在一步法测定中,应注意钩状效应(hookeffect),类同于沉淀反应中抗原过剩的后带现象。当标本中待测抗原浓度相当高时,过量抗原分别和固相抗体及酶标抗体结合,而不再形成夹心复合物,所得结果将低于实际含量。钩状效应严重时甚至可出现假阴性结果。
(三)间接法测抗体
间接法是检测抗体最常用的方法,其原理为利用酶标记的抗抗体以检测已与固相结合的受检抗体,故称为间接法。操作步骤如下:
(1)将特异性抗原与固相载体连接,形成固相抗原:洗涤除去未结合的抗原及杂质。
(2)加稀释的受检血清:其中的特异抗体与抗原结合,形成固相抗原抗体复合物。经洗涤后,固相载体上只留下特异性抗体。其他免疫球蛋白及血清中的杂质由于不能与固相抗原结合,在洗涤过程中被洗去。
(3)加酶标抗抗体:与固相复合物中的抗体结合,从而使该抗体间接地标记上酶。洗涤后,固相载体上的酶量就代表特异性抗体的量。例如欲测人对某种疾病的抗体,可用酶标羊抗人IgG抗体。
(4)加底物显色:颜色深度代表标本中受检抗体的量。 本法只要更换不同的固相抗原,可以用一种酶标抗抗体检测各种与抗原相应的抗体。
(四)竞争法
竞争法可用于测定抗原,也可用于测定抗体。以测定抗原为例,受检抗原和酶标抗原竞争与固相抗体结合,因此结合于固相的酶标抗原量与受检抗原的量呈反比。操作步骤如下:
(1)将特异抗体与固相载体连接,形成固相抗体。洗涤。
(2)待测管中加受检标本和一定量酶标抗原的混合溶液,使之与固相抗体
反应。如受检标本中无抗原,则酶标抗原能顺利地与固相抗体结合。如受检标本中含有抗原,则与酶标抗原以同样的机会与固相抗体结合,竞争性地占去了酶标抗原与固相载体结合的机会,使酶标抗原与固相载体的结合量减少。参考管中只加酶标抗原,保温后,酶标抗原与固相抗体的结合可达最充分的量。洗涤。 (3)加底物显色:参考管中由于结合的酶标抗原最多,故颜色最深。参考管颜色深度与待测管颜色深度之差,代表受检标本抗原的量。待测管颜色越淡,表示标本中抗原含量越多。
(五)捕获法测IgM抗体
血清中针对某些抗原的特异性IgM常和特异性IgG同时存在,后者会干扰IgM抗体的测定。因此测定IgM抗本多用捕获法,先将所有血清IgM(包括异性IgM和非特异性IgM)固定在固相上,在去除IgG后再测定特异性IgM。操作步骤如下:
(1)将抗人IgM抗体连接在固相载体上,形成固相抗人IgM。洗涤。
(2)加入稀释的血清标本:保温反应后血清中的IgM抗体被固相抗体捕获。洗涤除去其他免疫球蛋白和血清中的杂质成分。
(3)加入特异性抗原试剂:它只与固相上的特异性IgM结合。洗涤。
(4)加入针对特异性的酶标抗体:使之与结合在固相上的抗原反应结合。洗涤。
(5)加底物显色:如有颜色显示,则表示血清标本中的特异性IgM抗体存在,是为阳性反应。
(六)应用亲和素和生物素的ELISA
亲和素是一种糖蛋白,可由蛋清中提取。分子量60kD,每个分子由4个亚基组成,可以和4个生物素分子亲密结合。现在使用更多的是从链霉菌中提取的链霉和素(strepavidin)。生物素(biotin)又称维生素H,分子量244.31,存在于蛋黄中。用化学方法制成的衍生物,生物素-羟基琥珀亚胺酯(biotin-hydroxysuccinimide,BNHS)可与蛋白质、糖类和酶等多种类型的大小分子形成生物素化的产物。亲和素与生物素的结合,虽不属免疫反应,但特异性强,亲和力大,两者一经结合就极为稳定。由于1个亲和素分子有4个生物素分子的结合位置,可以连接更多的生物素化的分子,形成一种类似晶格的复合体。因此把亲和素和生物素与ELIS偶联起来,就可大提高ELISA的敏感度。
亲和素-生物素系统在ELISA中的应用有多种形式,可用于间接包被,亦可用于终反应放大。可以在固相上先预包被亲和素,原用吸附法包被固相的抗体或抗原与生物素结合,通过亲和素-生物素反应而使生物素化的抗体或抗在相化。这种包被法不仅可增加吸附的抗体或抗原量,而且使其结合点充分暴露。另外,在常规ELISA中的酶标抗体也可用生物素化的抗体替代,然后连接亲和素-酶结合物,以放大反应信号。
通过高碘酸盐的方法结合过氧化物酶
Peroxidase Conjugation by Periodate Method
Author: NanciDonacki
Source: Contributed by NanciDonacki
Reagents
Horseradish peroxidase
Sodium periodate(高碘酸盐), 0.1M, freshly made
Ethylene glycol(乙二醇)
Sephadex G-25
Sodium acetate buffer(醋酸钠缓冲液), 0.001M, pH 4.2
IgG
Carbonate:Bicarbonate Buffer, 1.0 M, pH 9.5
Sodium tetraborate (4 mg/ml) freshly made.(四硼酸钠)
PBS
Procedure
Dissolve 16 mg HRP in 4 ml diH2O and 0.8 ml of sodium periodate.
Stir for 20 minutes, RT
Add 6 drops ethylene glycol
Stir for 5 minutes, RT
Filter over a G-25 Sephadex column equilibrated with 1mM acetate
Pool colored fractions and divide into two equal parts.
To the first part, add 14 mg IgG
To the second part, add 10 mg IgG.
To both add 1M carbonate buffer, dropwise, to raise the pH to 9.0-9.5 Stir for 2 hours at room temperature
To both add 0.2 ml sodium tetraborate
Incubate for 2 hours at 2-8oC
Dialyze against PBS.
Separate on ACA-44 column, eluted with PBS
Pool fractions and add 10 mg/ml PBS
-
20xx质量月活动监理工作总结
为贯彻落实根据国家《关于开展20xx年全国质量月活动的通知》精神,结合***************工程实际,我项目组成立了以总监…
-
演讲比赛总结
“我爱我的家乡”手抄报展览及演讲比赛总结为丰富校园文化生活,提升我系同学综合素质,促进我院学生创新能力、实践活动能力广泛深入地开展…
-
一高中法制校长进校园活动总结20xx年9月
辽中一高中法制副校长工作总结学校法制教育是学校德育教育的重要内容,是对学生进行社会主义民主法制教育,增强学生树立社会主义法制意识,…
-
五年级数学教学工作总结
卧伏中心小学童玲本学期,我承担五年级的数学教学工作。一学期来,我自始至终以认真、严谨的治学态度,勤恳、坚持不懈的精神从事教学工作。…
-
小学一年级德育工作总结
一(2)班德育工作总结伴随着新年钟声的临近,这一学期工作已经圆满地画上了一个句号。经过一学期的努力,我针对低年级学生的特点,主要以…