人教版初三化学第五章知识点总结
第五单元 化学方程式
课题1 质量守恒定律
一、质量守恒定律
1、含义:
说明:①质量守恒定律只适用于化学变化,不适用于物理变化; ........
②没有参加反应的物质质量及不是反应生成的物质质量不能计入“总和”中; ..
③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏。
2、微观解释:在化学反应前后,原子的种类、数目、质量均保持不变(原子的“三不变”)。
3、化学反应前后
(1)一定不变宏观:反应物、生成物的总质量不变;元素种类、质量不变
微观:原子的种类、数目、质量不变
(2)一定改变宏观:物质的种类一定变
微观:分子种类一定变
(3)可能改变:分子总数可能变
二、化学方程式
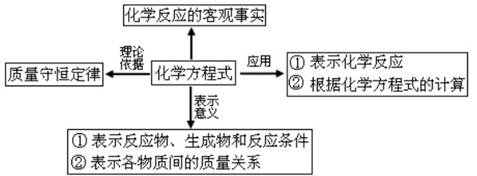
1、含义:用化学式表示化学反应的式子。能直接反映质量守恒定律。
2、表示的意义:⑴表示反应物、生成物和反应条件
⑵表示各物质间的质量比(质量比=各物质的相对分子质量×各化学式前面的系数的积的
比)
⑶表示各物质的微粒个数比(即各化学式前面的系数比)
点燃 例如:以2H2+O22O为例
①表示氢气与氧气在点燃条件下生成水
②表示氢气、氧气与水的质量比为4:32:36
③表示氢分子、氧分子与水分子的个数比为2:1:2
点燃 3、化学方程式的读法 以2H2+O22O为例
①从反应物、生成物和反应条件角度:氢气与氧气在点燃条件下生成水
②从各物质的质量比角度:每4份质量的氢气与32份质量的氧气在点燃条件下生成36份质
量的水
③从各物质的微粒个数比角度:每2个氢分子与1个氧分子在点燃条件下生成2个水分子。
课题2 如何正确书写化学方程式
一、书写原则:
1、以客观事实为基础 2、遵守质量守恒定律(标准:两边原子的种类和数目相等) 二、方程式的配平
1、标准:方程式两边原子种类和数目相等即配平了
2、配平的原则:在化学式前面加上适当的系数来保证方程式两边原子种类和数目相等。
C + O2 点燃
CO2 S + O2
点燃
SO2
4P + 5O2 点燃
2P2O5 4Al + 3O2 Fe3O4 2Mg + O2
点燃
2Al2O3 2MgO
3Fe + 2O2 2H2O2 2KClO3
△
点燃
点燃
2H2O + O2↑ 2KMnO42KCl+3O2↑ 2H2O
△
K2MnO4 + MnO2 + O2↑
MnO
通电
2H2↑+ O2↑
点燃
2H2 + O22O
3 根据化学式的简单计算
把16g KClO3和 MnO2的混合物加热到质量不再继续减少,冷却,称量剩余物质的质量为11.2g,试计算:
(1)生成O2的质量;(2)原混合物中MnO2的质量;(3)剩余物中各物质的质量。 解:(1)生成氧气的质量 = 16g-11.2g = 4.8g (2)设原混合物中KClO3的质量为x 2KClO3
MnO2?
2KCl + 3O2 ↑
245 96 x 4.8g
245X
?
964.8g
, x = 12.25g
∴原混合物中MnO2 的质量为16g-12.25g=3.75g (3)由于MnO2是催化剂,质量不变,反应后仍为3.75g。 反应后生成KCl质量为11.2g-3.75g=7.45g
答:生成氧气质量为4.8g,原混合物中的MnO2质量是3.75g,剩余物中MnO2和KCl质量分别为3.75g和7.45g。
第二篇:九年级化学第五单元-化学方程式知识点归纳(20xx新人教版)
第五单元 化学方程式知识梳理
【知识网络】
【知识归纳】
课题一、质量守恒定律
1、定义:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
2、质量守恒的理解
⑴参加化学反应的,所给予物质不一定都参加反应,若反应物有剩余,剩余的物质没有参加反应。所以必须强调“参加化学反应”,而且质量守恒定律只能用于解释化学变化。⑵质量总和“是参加化学反应的物质的质量总和和反应后生成的物质的质量总和”。如:镁在氧气中燃烧生成氧化镁,参加反应的镁的质量和参加反应的氧气的质量的和等于反应后生成的氧化镁的质量。
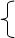 反应物和生成物的总质量不变
反应物和生成物的总质量不变
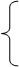 宏观
宏观
元素的种类不变
 (1)五个不变 原子的种类不变
(1)五个不变 原子的种类不变
微观 原子的数目不变
原子的质量不变
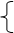 宏观:物质的种类一定改变
宏观:物质的种类一定改变
(2)两个一定改变
微观:分子的种类一定改变
(3)可能改变:分子总数可能改变;元素的化合价。
3、运用质量守恒定律解释实验现象的一般步骤:①说明化学反应的反应物和生成物;②根据质量守恒定律,应该是参加化学反应的各物质质量总和等于各生成物质量总和③与题目中实验现象相联系,说明原因。
4、利用原子、分子知识解释质量守恒原因
解释“质量守恒”要从化学反应的实质去分析,由分子构成的物质在化学反应中的实质是:分子分裂成原子,原子从新组合成分子,分子聚集成新物质。
在化学反应中,不论物质分子经过怎样的变化,但反应前后原子种类和数目都不变,各原子质量也不变。所以,反应前后的质量总和必然相等。
5、适用范围:所有的化学变化。
质量守恒定律的应用:
(1)根据质量守恒定律进行简单的计算:(2)运用质量守恒定律解释化学反应中的一些简单的现象和问题;
(3)判断化学反应中某种物质得的组成;(4)确定化学反应中某种物质的化学式。
6、验证实验:当有气体参加反应或有气体生成时,该反应必须在密闭容器内进行才能验证质量守恒定律。
探究质量守恒定律的重要实验
红磷燃烧前后质量的测定
① 红磷燃烧时,为什么在锥形瓶瓶底铺一层细沙?
答:为了吸收红磷燃燃烧放出的热量,以防止锥形瓶炸裂。
② 红磷燃烧时,为什么要在玻璃管上系一个小气球?
答:因为红磷燃烧时放出热最,系上小气球,可以防止瓶内气体因受热膨胀而冲开瓶塞,发生危险。
③ 红磷燃烧时,玻璃管上的小气球有何变化?
答:红磷燃烧时,瓶内气体因受热膨胀,小气球鼓起;冷却后,因瓶内氧气减少,气压变小,小气球变小。
课题二、正确书写化学方程式
1、概念:用化学式表示化学反应的式子。
2、含义:①表明反应物、生成物和反应条件;②表明反应物和生成物之间的质量关系;③反应物与生成物之间的粒子数量比
★★化学方程式的意义 (以C + O2 点燃===== CO2为例)
(1)质:碳和氧气在点燃的条件下反应生成二氧化碳;
(2)量:每12份质量的碳和32份质量的氧气完全反应,生成44份质量的二氧化碳;
(3)粒子:每1个碳原子和一个氧分子反应,生成一个二氧化碳分子。
3、书写原则:以客观事实为基础;遵守质量守恒定律。
4、书写步骤:写——左写反应物,右写生成物,中间连短线;配——配平为关键;等——短线改等号;注——在等号的上方或下方注明反应条件(点燃、加热、高温、通电、催化剂等); 标——标出气体与沉淀(生成气体“↑”标出,但反应物中有气体,生成的气体不用标;生成沉淀“↓”标出,但反应物中有难容物,生成的难容物不用标。);查——检查化学式是否写错、是否配平、条件和生成物状态是否标了、标的是否恰当。
5、配平方法:
最小公倍数法;观察法;设“1”法。
 课题三、利用化学方程式的简单计算
课题三、利用化学方程式的简单计算
1、根据:化学方程式意义——能表明各物质之间的质量比
2、步骤:
①解:设未知量(设xx的质量为X,不含单位!)
②写出题目涉及的化学方程式(化学方程式必须是题目涉及到,且正确的)
③计算相关物质的相对分子质量的总和(不相关不用计算)
对应标出已知量和未知量(必须对应标出),列出关系式
④ 列比例式求解(比例式要列对)
⑤ 正确计算出结果
⑥ 简明写出答案(答一定不能忘)
3、计算中常用的关系式:
⑴m= ρv
⑵单位换算:1L=1000mL,1mL=1cm3
⑶物质的纯度=纯物质的质量/不纯物质的质量×100%
变形:纯物质的质量=不纯物质的质量×物质的纯度
不纯物质的质量=纯物质的质量÷物质的纯度
⑵ 物质的纯度(纯物质的质量分数)=1-杂质的质量分数
★★★第一章至第五章化学方程式总结
一. 物质与氧气的反应:
(1)单质与氧气的反应: ( 化合 反应)
1. 镁在空气中燃烧: 2Mg+O2 2MgO (剧烈燃烧,发出耀眼的白光,生成白色固体)
2MgO (剧烈燃烧,发出耀眼的白光,生成白色固体)
2. 铁在氧气中燃烧: 3Fe+2O2 Fe3O4 (剧烈燃烧,火星四射,生成黑色固体)
Fe3O4 (剧烈燃烧,火星四射,生成黑色固体)
3. 铝在氧气中燃烧:4Al+3O2 2Al2O3 (剧烈燃烧,发出耀眼的白光,生成白色固体)
2Al2O3 (剧烈燃烧,发出耀眼的白光,生成白色固体)
4. 铜在空气中受热: 2Cu + O2 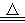 2CuO (固体由紫红色变成黑色)
2CuO (固体由紫红色变成黑色)
5. 氢气燃烧:2H2+O2 2H2O (火焰呈淡蓝色,罩在火焰上方的干燥的冷烧杯内壁出现水珠)
2H2O (火焰呈淡蓝色,罩在火焰上方的干燥的冷烧杯内壁出现水珠)
6. 硫粉燃烧:S+O2 SO2(火焰在空气中呈淡蓝色,在氧气中呈蓝紫色,生成有刺激性气味的气体)
SO2(火焰在空气中呈淡蓝色,在氧气中呈蓝紫色,生成有刺激性气味的气体)
7. 红磷燃烧:4P+5O2 2P2O5 (剧烈燃烧,产生大量白烟)
2P2O5 (剧烈燃烧,产生大量白烟)
8. 碳充分燃烧:C+O2 CO2 (在空气中呈红热状态,在氧气中发出炽热的白光)
CO2 (在空气中呈红热状态,在氧气中发出炽热的白光)
9. 碳不充分燃烧: 2C+O2 2CO
2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2 (火焰呈蓝色)
11. 甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O (火焰呈蓝色)
12. 酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O (火焰呈蓝色)
二.有氧气生成的反应: ( 分解 反应)
13. 过氧化氢分解(二氧化锰作催化剂): 2H2O2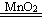 2H2O + O2 ↑
2H2O + O2 ↑
14. 加热氯酸钾和二氧化锰: 2KClO3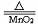 2KCl + 3O2 ↑
2KCl + 3O2 ↑
15. 加热高锰酸钾制氧气: 2KMnO4  K2MnO4 + MnO2 + O2 ↑
K2MnO4 + MnO2 + O2 ↑
16. 水在直流电的作用下分解: 2H2O  2H2 ↑+ O2 ↑
2H2 ↑+ O2 ↑
17.氧化汞受热分解: 2HgO  2Hg + O2 ↑(红色固体变成银白色液体)
2Hg + O2 ↑(红色固体变成银白色液体)
三、生成二氧化碳的反应:
18.石灰石和稀盐酸反应: CaCO3 + 2HCl = CaCl2 + H2O + CO2↑(产生气泡平缓,固体逐渐消失)
19.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ (产生气泡剧烈,固体逐渐消失)
20.高温煅烧石灰石: CaCO3 CaO + CO2↑
CaO + CO2↑
21.碱式碳酸铜受热分解: Cu2(OH)2CO3 2CuO + H2O + CO2↑(蓝色固体逐渐变黑)
2CuO + H2O + CO2↑(蓝色固体逐渐变黑)
五、几个置换反应:
22.铁和硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu (有红色固体生成,溶液由蓝色渐变成淡绿色)
23. 锌和稀盐酸:Zn + 2HCl=== ZnCl2 + H2↑ (产生气泡平缓,固体逐渐消失)
24. 锌和稀硫酸:Zn + H2SO4 = ZnSO4 + H2↑(产生气泡平缓,固体逐渐消失)
25. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O(置换反应)(黑色粉末变红,有水珠产生)
六.其它反应:
26.二氧化碳通入澄清石灰水中: Ca(OH)2+CO2=CaCO3↓+H2O(澄清石灰水变浑浊)
27.氢氧化钠与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO4(生成蓝色沉淀)
28.二氧化硫溶于水形成酸雨:SO2 + H2O == H2SO3 (亚硫酸)
29.硫酸铜晶体受热分解:CuSO4·5H2O  CuSO4 + 5H2O(蓝色固体变白)
CuSO4 + 5H2O(蓝色固体变白)
30.无水硫酸铜作干燥剂:CuSO4 + 5H2O == CuSO4·5H2O(白色固体变成蓝色)
-
初三化学人教版分单元知识点总结
初三化学知识点总结第一单元走进化学世界化学是一门研究物质的组成结构性质及其变化规律的科学一药品的取用原则1使用药品要做到三不不能用…
-
人教版初三化学第五章知识点总结
第五单元化学方程式课题1质量守恒定律一、质量守恒定律1.含义:说明:①质量守恒定律只适用于化学变化,不适用于物理变化;......…
-
初中化学知识点总结(人教版上册)
初中化学知识点总结人教版上册第1单元走进化学世界课题1物质的变化和性质物理变化没有生成其他物质的变化一化学变化和物理变化化学变化生…
-
20xx年人教版初中化学新版上、下册知识点系统归纳
20xx级人教版初中化学知识点绪言化学使世界变得更加绚丽多彩一什么是化学化学是研究物质的组成结构性质以及变化规律的科学化学的研究对…
-
新人教版九年级化学上册知识点总结
20氮气做冷冻剂保护气超导材料虽然不包含化学变化但利用了它们的化学性质稳定性21水分蒸发会变成浓硫酸如果不慎将碱液滴到皮肤上要用较…
-
人教版初中化学知识点总结第一单元
人教版初中化学知识点总结第1单元走进化学世界1、化学是研究物质的组成、结构、性质以及变化规律的基础科学。2、我国劳动人民商代会制造…
-
20xx新人教版初三化学第一单元知识点总结
第一单元走进化学世界课题112、物理变化:没有生成其他物质的变化。3热、变色、放出气体、生成沉淀,但出现上述现象的变化不一定是化学…
-
人教版初三化学第五章知识点总结 2
第五单元化学方程式课题1质量守恒定律一、质量守恒定律1、概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。说…
-
人教版初三化学第五章知识点总结
第五单元化学方程式课题1质量守恒定律一、质量守恒定律1.含义:说明:①质量守恒定律只适用于化学变化,不适用于物理变化;......…
-
初中化学知识点总结(人教版上册)
初中化学知识点总结人教版上册第1单元走进化学世界课题1物质的变化和性质物理变化没有生成其他物质的变化一化学变化和物理变化化学变化生…