20xx-20xx学年高一化学苏教版必修一:2.2 钠、镁及其化合物 知识点总结
专题二 从海水中获得的化学物质
第二单元钠、镁及其化合物
钠的物理性质:
银白色固体、有金属光泽、密度比煤油大比水小、质软、熔点低、能导电导热。
钠的化学性质:
1.钠与水反应
在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块钠放入水中。为了安全应在烧杯上加盖玻璃片。
观察到的现象及由现象得出的结论有:
(1)钠浮在水面上(钠的密度比水小)
(2)钠熔成一个闪亮的小球(钠与水反应放出热量,钠的熔点低)
(3)钠在水面上四处游动(有气体生成)
(4)发出嘶嘶的响声(生成了气体,反应剧烈)
(5)事先滴有酚酞试液的水变红(有碱生成)
反应方程式:
2Na+2H2O=2NaOH+H2↑
2.钠与氧气反应
在常温时:4Na+O2=2Na2O (白色粉末)
在点燃时:2Na+O2=△=Na2O2 (淡黄色粉末)
3.钠与钛、锆、铌等金属氯化物反应
4Na+TiCl4==熔融==4NaCl+Ti(条件为高温且需要氩气做保护气)
补充
4.与酸溶液反应
钠与水反应本质是和水中氢离子的反应,所以钠与盐酸反应,不是先和水反应,钠与酸溶液的反应涉及到钠的量,如果钠少量,只能与酸反应,如钠与盐酸的反应: 2Na+2HCl=2NaCl+H2↑ 如果钠过量,则优先与酸反应,然后再与酸溶液中的水反应。
5.与盐溶液反应
将钠投入盐溶液中,钠先会和溶液中的水反应,生成的氢氧化钠如果能与盐反应则继续反应。 如将钠投入硫酸铜溶液中:
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
钠的制取:
电解熔融氯化钠
2NaCl(熔融)=电解=2Na+Cl2↑
钠的化合物
1.碳酸钠与碳酸氢钠的性质比较
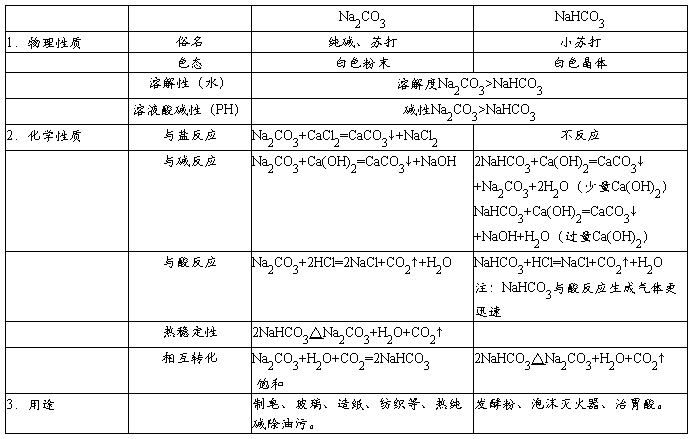
2.区分碳酸钠与碳酸氢钠的方法
⑴ 加热固体。产生能使石灰水变浑浊的无色气体的是碳酸氢钠。
2NaHCO3 = Na2CO3 + H2O + CO2
⑵ 溶解,加入氯化钙溶液,产生沉淀的是碳酸钠。
Na2CO3 + CaCl2 = 2NaCl + CaCO3↓
⑶ 在固体中加入相同浓度的盐酸,反应剧烈的是碳酸氢钠。
侯氏制碱法
反应原理
NaCl+NH3+CO2+H2O==NaHCO3+NH4Cl
2NaHCO3△Na2CO3+H2O+CO2↑
离子反应
强电解质:强酸(硫酸、盐酸、硝酸)、强碱(氢氧化钠、氢氧化钾)、大多数盐在水溶液中完全电离的一类电解质。
弱电解质:弱酸(碳酸、醋酸)、弱碱(一水和铵)在水溶液中不能完全电离的一类电解质。

离子方程式书写
用实际参加反应的离子符号来表示反应的式子。它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。书写方法:
写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式
删:将不参加反应的离子从方程式两端删去
查:查方程式两端原子个数和电荷数是否相等
海水中提取镁的方法

化学反应方程式:
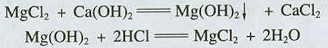
镁的化学性质:
 1、与空气的反应
1、与空气的反应
 2Mg + O
2 === 2MgO
2Mg + O
2 === 2MgO
 3Mg + N
2 ===2Mg
2N
3
3Mg + N
2 ===2Mg
2N
3
2Mg + CO2 === 2MgO + C
2、与水的反应
Mg+2H2O === Mg(OH)2+H2↑
3、与酸的反应
Mg + H2SO4 === MgSO4 + H2↑
镁的用途:
1)镁合金的密度较小,但硬度和强度都较大,因此被用于制造火箭.导弹和飞机的部件
2)镁燃烧发出耀眼的白光,因此常用来制造通信导弹和焰火;
3)氧化镁的熔点很高,是优质的耐高温材料
写出下列物质之间的转化的化学方程式:

第二篇:20xx-20xx学年高一化学苏教版必修一教案:2.2.4 镁的提取及应用 教案2
2.2.4 镁的提取及应用 教案
教学目标
1、知识目标
(1)了解海水的成分;初步认识海水提取镁的原理与过程。
(2)初步掌握镁的化学性质,物理性质。
2、能力目标
(1)初步形成物质的结构决定物质性质的观点。
(2)通过课堂讨论培养分析问题和解决问题的能力。
3、情感目标
(1)认识开发利用海水这一巨大资源的重大意义。
(2)对于如何提高化工生产的经济效益有一个常识性的认识。
教学重点、难点
海水提取镁的原理与过程;镁的化学性质。
教学方法 问题探究法、实验探究法
教 具 课件、镁条、砂纸、坩埚钳、酒精灯、试管、装满二氧化碳的集气瓶、稀硫酸等 教学过程设计
[多媒体展示]镁在高科技领域以及工业生产中的应用;海洋元素含量资料,引出本节课的课题
[板书]一、镁的提取
[讲述]镁主要以化合态的形式存在于地壳和海水(MgCl2)中。海水中镁的总储量约为1.8×
10t
[交流与讨论]
1、如何实现Mg 的富集和分离?
[讲述]可以加入一种试剂使Mg沉淀
2、是不是直接往海水中加沉淀剂?
[讲述]不是,因为海水中的Mg的浓度很小,直接加沉淀剂不利于Mg 的沉淀,而且会增大沉淀剂的用量,我们可以先将海水浓缩,再加沉淀剂
3、从综合角度考虑选用哪种试剂作沉淀剂好?为什么?
[讲述]因为海边有丰富的贝壳,可用来制得Ca(OH)2 ,从原料来源以及经济等综合角度考虑选用Ca(OH)2试剂作沉淀剂好
思考:如何由贝壳制得氢氧化钙?
[讲述]贝壳(CaCO3)→CaO→Ca(OH)2
[交流与讨论]
1、如何制得无水MgCl2 ?
[讲述]先加盐酸反应,再浓缩得MgCl2?6H2O晶体,然后再将MgCl2?6H2O晶体在一定条件下加热脱水即可得无水MgCl2
2、由MgCl2 到Mg究竟用还原法还是电解法好?
[讲述]由于镁本身比较活泼,用还原法比较困难,工业上常使用电解熔融的氯化镁得到镁 2+ 2+2+ 2+15
[投影]教材P55图2-15从海水中提取镁的流程
[思考]电解产生的Cl2怎么处理?
[讲述]可以循环利用,这样既可以节约资源又可以减轻Cl2任意排放对环境造成的污染。
[练习]根据讨论,在下列方框中填入合适的物质的化学式完成工业上用海水提镁的工艺流程,并写出a、b、c三个步骤的化学方程式:
过滤 加盐酸 脱水 电解
海水
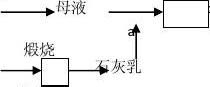


2溶液
浓缩
贝壳
。
[过渡]镁是我们熟悉的金属,在高科技领域以及工业生产中有重要的作用,那么镁具有哪些性质呢?
[学生活动]书写Mg的原子结构
[讲述] Mg原子的最外层只有两个电子,很容易失去,结构决定性质,我们可以预测Mg
是一种活泼的金属。
[板书]二、镁的化学性质
1、[演示实验]
探究一:取一小段除去氧化膜的镁条投入盛有一定量稀盐酸的试管中;
现象:镁条逐渐溶解,有大量气体产生
结论或化学方程式:Mg+2HCl=MgCl2+H2↑
2、[演示实验]
探究二:取一根除去氧化膜的镁条,点燃后插入充满CO2的集气瓶中。
现象:燃着的镁条在CO2中继续燃烧,发出耀眼的白光,生成白色固体,在集气瓶的
内壁有黑色固体附着
结论或化学方程式:2Mg + CO2=2MgO+C
3、[讲述]镁条在氮气中燃烧
点燃
反应的化学方程式:3 Mg +N2= Mg3N2
[学生活动]观察触摸一根擦亮的镁条并结合生活实际及课本知识,总结镁的物理性质。
[板书]三、镁的物理性质
镁银白色金属光泽,密度小,硬度小,镁合金的硬度和强度较大 。
[讲述]镁的用途1、制合金
2、信号弹、焰火
3、制耐火材料(MgO)熔点高
[小结]海水提镁的流程及镁的化学性质。
[拓展视野]
镁的应用:
镁合金可用于汽车发动机、车身、车轮、驾驶盘及盘轴、座椅架、仪表盘、变速箱以及变速凸轮等部件的制造。典型镁合金部件的重量仅为相同体积的铝合金的64%,铁的23%。而每减轻100kg的重量、燃料消耗就可以降低5%,这对于节约能源、降低排放具有重大意义。 镁在航空航天和军事上的应用更加广泛,用它可以设计制造飞行器机身和构件、火箭、导弹、卫星和探测器等。太空飞船和卫星部件使用镁合金后能适应太空运行的特殊环境。 在通读设备调研中,镁合金可以部分取代工程塑料,用于电视机、数字投影仪、播放器、电话机、像机、计算机部件及小型碟片的设计制造等。
[板书设计]
镁的提取及应用
一、镁的提取
1、MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
2、Mg(OH)2+2HCl= MgCl2+2H2O
3、MgCl2== Mg+ Cl2↑
二、镁的化学性质
1、Mg+2HCl=MgCl2+H2↑
2、2Mg + CO2=2MgO+C
3、3 Mg +N2= Mg3N2
三、镁的物理性质
[巩固练习]:
1、海水中含的MgCl2是Mg的重要来源之一,从海水中提镁,可按如下步骤进行:
(1) 将贝壳制成石灰乳
(2) 在引入的海水中加入石灰乳、沉降、过滤、洗涤沉淀物
(3) 将沉淀物与盐酸反应、结晶、过滤、干燥产物
(4) 将产物熔融后电解
关于提取镁,下列说法中不正确的是( )
A、 此法的优点之一是原料来源丰富
B、 进行(1)、(2)、(3)步的目的是从海水中提取MgCl2
C、 第四步会产生氯气
D、 以上过程中涉及到复分解反应、化合反应和置换反应
2.将镁在SO2中燃烧后,生成的物质可能有
方程式为 。
(SO2与CO2性质类似,S与氧气的性质类似)
3.(重点班) 2.4g镁在空气中燃烧,反应转移的电子数为_____________。

-
高一化学必修1,2_苏教版专题知识点重点难点总结
4离子方程式正误判断六看一看反应是否符合事实主要看反应能否进行或反应产物是否正确二看能否写出离子方程式纯固体之间的反应不能写离子方…
-
高一化学必修1_苏教版专题知识点重点难点总结
化学必修1专题知识点物质的分类及转化物质的分类可按组成状态性能等来分类物质的转化反应类型四种基本反应类型化合反应分解反应置换反应复…
-
高一化学_必修1_苏教版_专题_知识点重点难点总结笔记
苏教版化学必修1专题知识点笔记物质的分类及转化物质的分类可按组成状态性能等来分类物质的转化反应类型四种基本反应类型化合反应分解反应…
-
20xx-20xx学年高一化学苏教版必修一教案:2.2 钠、镁及其化合物 知识点总结
专题二从海水中获得的化学物质第二单元钠镁及其化合物钠的物理性质银白色固体有金属光泽密度比煤油大比水小质软熔点低能导电导热钠的化学性…
-
高一化学_必修1_苏教版_专题_知识点重点难点总结笔记
苏教版化学必修1专题知识点笔记物质的分类及转化物质的分类可按组成状态性能等来分类物质的转化反应类型四种基本反应类型化合反应分解反应…
-
江苏省灌南高级中学20xx年高中化学 第二单元《研究物质的实验方法》知识点总结学案 苏教版必修1
江苏省灌南高级中学20xx年高中化学第二单元研究物质的实验方法知识点总结学案苏教版必修1一物质的分离与提纯1物质的分离是把混合物中…
-
高中化学必修一知识点总结 精简版
第一章从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃易爆气体的实验时…
-
高中化学必修一知识点总结
高中化学必修1复习提纲注A了解B理解C综合应用必修1全册基本内容梳理一从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中…
-
苏教版高中化学必修二知识点总结(专题一、二)[1]
高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律一原子结构质子Z个原子核注意中子N个质量数A质子数Z中子数N1原子…
-
高一化学必修一知识点总结
新课标化学必修一1学习方法2研究一种物质的性质的程序3观察法4金属钠的物理性质5金属与水的反应第三章金属及其化合物1金属的化学性质…
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…