人教版化学必修二第一章知识点总结
第三节 化学键
知识点一.离子键
1.离子键:阴阳离子之间强烈的相互作用叫做离子键。 相互作用:静电作用(包含吸引和排斥)
注:(1)成键微粒: 阴阳离子间 (2)成键本质: 阴、阳离子间的静性作用
(3)成键原因:电子得失 (4)形成规律: 活泼金属和活泼非金属化合时形成离子键
离子化合物:像NaCl这种由离子构成的化合物叫做离子化合物。(1)活泼金属与活泼非金属形成的化合物。如NaCl、Na2O、K2S等
(2)强碱:如NaOH、KOH、Ba(OH)2、Ca(OH)2等 (3)大多数盐:如Na2CO3、BaSO4 (4)铵盐:如NH4Cl
小结:一般含金属元素的物质(化合物)+铵盐。(一般规律)
注意:(1)酸不是离子化合物。 (2)离子键只存在离子化合物中,离子化合物中一定含有离子键。
2、电子式
电子式:在元素符号周围用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。
用电子式表示离子化合物形成过程:
(1)离子须标明电荷数;(2)相同的原子可以合并写,相同的离子要单个写;(3)阴离子要用方括号括起;(4)不能把“→”写成“=”;(5)用箭头标明电子转移方向(也可不标)。
知识点二.共价键
1.共价键:原子间通过共用电子对所形成的相互作用叫做共价键。
用电子式表示HCl的形成过程: 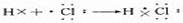
注:(1)成键微粒:原子(2)成键实质:静电作用(3)成键原因:共用电子对(4)形成规律:非金属元素形成的单质或化合物形成共价键
2.共价化合物:以共用电子对形成分子的化合物叫做共价化合物。
化合物 离子化合物
共价化合物 化合物中不是离子化合物就是共价化合物
3.共价键的存在:
⑴非金属单质:H2、X2、N2等(稀有气体除外)⑵共价化合物:H2O、 CO2、SiO2、 H2S等⑶复杂离子化合物:强碱、铵盐、含氧酸盐
4.共价键的分类:
非极性键:在同种元素的原子间形成的共价键为非极性键。共用电子对不发生偏移。
极性键:在不同种元素的原子间形成的共价键为极性键。共用电子对偏向吸引能力强的一方。
知识点三.电子式:
定义:在元素符号周围用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。
原子的电子式: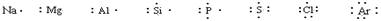
2.阴阳离子的电子式: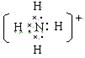
(1)阳离子 简单阳离子:离子符号即为电子式,如Na+、、Mg2+等
复杂阳离子:如NH4+ 电子式:
(2)阴离子 简单阴离子: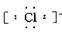 、
、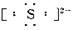
复杂阴离子:
3.物质的电子式:
离子的电子式:阳离子的电子式一般用它的离子符号表示;在阴离子或原子团外加方括弧,并在方括弧的右上角标出离子所带电荷的电性和电量。 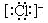
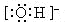
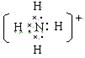
分子或共价化合物电子式,正确标出共用电子对数目。

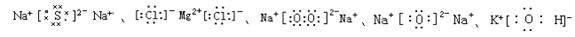 离子化合价电子式,阳离子的外层电子不再标出,只在元素符号右上角标出正电荷,而阴离子则要标出外层电子,并加上方括号,在右上角标出负电荷。阴离子电荷总数与阳离子
离子化合价电子式,阳离子的外层电子不再标出,只在元素符号右上角标出正电荷,而阴离子则要标出外层电子,并加上方括号,在右上角标出负电荷。阴离子电荷总数与阳离子
4.用电子式表示形成过程:
用电子式表示单质分子或共价化合物的形成过程
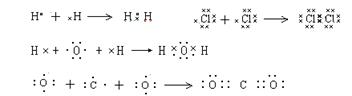
用电子式表示离子化合物的形成过程
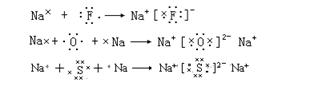
知识点四、分子间作用力和氢键
1、分子间作用力
⑴定义:把分子聚集在一起的作用力,又称范德华力。
⑵特点:①分子间作用力比化学键弱得多;②影响物质的熔点、沸点、溶解性等物理性质;③只存在于由共价键形成的多数共价化合物和绝大多数气态非金属单质分子,及稀有气体分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在分子间作用力。⑶变化规律:一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔沸点也越高。例如,熔沸点:I2>Br2>Cl2>F2。
2、氢键
⑴定义:分子间存在着一种比分子间作用力稍强的相互作用。
⑵形成条件:除H原子外,形成氢键的原子通常是N、O、F。
⑶存在作用:氢键存在广泛,如H2O、NH3、HF等。
分子间氢键会使物质的熔点和沸点升高。
知识点五、化学反应的实质:
一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成过程。
离子键、共价键与离子化合物、共价化合物的关系
总结:一、化学键与物质类别关系规律
1、只含非极性键的物质:同种非金属元素构成的单质,如:I2、N2、P4、金刚石、晶体硅等。
2、只含有极性键的物质:一般是不同非金属元素构成的共价化合物、如:HCl、NH3、SiO2、CS2等。
3、既有极性键又有非极性键的物质:如:H2O2、C2H2、CH3CH3、C6H6等。
4、只含有离子键的物质:活泼非金属与活泼金属元素形成的化合物,如:Na2S、NaH、K2O、CsCl等。
5、既有离子键又有非极性键的物质。如:Na2O2、Na2S2、CaC2等。
6、既有离子键又有极性键的物质,如NaOH等。 7、由离子键、共价键、配位键构成的物质,如:NH4Cl等。
8、由强极性键构成但又不是强电解质的物质。如HF等。 9、无化学键的物质:稀有气体。
10、离子化合物中并不存在单个的分子,例如:NaCl,并不存在NaCl分子。
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
人教版高中化学必修1的每章知识点总结
高中化学必修一知识点总结必修1全册基本内容梳理从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当…
-
人教版高一化学必修一知识点总结
人教版高一化学必修一知识点总结新课标化学必修一第三章金属及其化合物1金属的化学性质1学习方法2研究一种物质的性质的程序观察物理性质…
-
人教版化学必修一第二章知识点总结A4 -终极版
根据分散剂的状态划分液溶胶如AgI胶体FeOH3胶体AlOH3胶体固溶胶如烟水晶有色玻璃合金2FeOH3胶体的制备硅酸胶体的制备碘…
-
高中化学必修二知识点总结ツ寓言
高中化学必修二知识点总结第一章物质结构元素周期律周期同一横行周期序数=电子层数类别周期序数起止元素包括元素种数核外电子层数短周期1…
-
人教版化学必修二第一章 知识点总结提高篇
夯实基础提高能力满分答卷持之以恒嘉祥一中高一化学系列之知识清单第一章物质结构元素周期表提高篇一周期表中特殊的周期和族1没有金属元素…
-
人教版化学必修二第一章知识点总结
第一章物质结构元素周期表第一节元素周期表一、周期表原子序数=核电荷数=质子数=核外电子数1、依据横行:电子层数相同元素按原子序数递…
-
人教版化学必修二第一章知识点总结
第一章物质结构元素周期表第一节元素周期表一、周期表原子序数=核电荷数=质子数=核外电子数1、依据横行:电子层数相同元素按原子序数递…
-
高中化学必修2知识点归纳总结第一章
第一章物质结构元素周期律一原子结构Z个原子核注意N个质量数AZN1原子序数质子数核外电子Z个熟背前20号元素熟悉120号元素原子核…
-
人教版化学必修2有机物知识点总结
一、化石燃料化石燃料:煤、石油、天然气天然气的主要成分:CH4石油的组成元素主要是碳和氢,同时还含有S、O、N等。主要成分各种液态…