新人教版九年级化学上册化学方程式汇总
新人教版九年级化学上册化学方程式汇总(按教材顺序)
1. 第6页实验1-3:硫酸铜中加入氢氧化钠:
2. 第6页实验1-4:向石灰石中加入稀盐酸:
3. 第6页实验1-4:想澄清石灰水中通入二氧化碳:
4. 第12页蜡烛燃烧的文字表达式:
5. 第20页实验1-8:碳酸钠中加入盐酸:
6. 第20页实验1-8:锌粒中加入盐酸:
7. 第22页实验1-10:氢氧化钠中加硫酸铜:
8. 第22页实验1-10:加热氢氧化铜:
9. 第27页实验2-1:红磷燃烧:
10. 第34页实验2-3:硫燃烧:
11. 第34页实验2-2:碳在氧气中燃烧:
12. 第34页实验2-3:硫燃烧:
13. 第35页实验2-4:铁在氧气中燃烧:
14. 第37页实验2-5:过氧化氢制氧气:
15. 第38页实验2-7:加热氯酸钾制氧气:
16. 第38页:使用高锰酸钾制氧气:
17. 第42页第2题选择题第一小题:氧化汞加热:
18. 第46页实验3-1:电解水:
19. 第51页讨论:氢气在氯气中燃烧:
20. 第66页:实验室氢气的制取:
21. 第66页实验3-6:氢气燃烧:
22. 第91页实验方案2:将铁钉浸到硫酸铜溶液中:
23. 第92页实验5-1:碳酸钠与盐酸反应:
24. 第92页实验5-1:镁燃烧:
25. 第94页讨论3氢气通过灼热的氧化铜:
26. 第99页习题5中C2H4 燃烧:
27. 第100页例题2:高温煅烧石灰石:
28. 第101页习题2:氧化铁和氢气在高温下反应:
29. 第101页习题2:氧化铁和一氧化碳在高温下反应:
30. 第102页习题3:甲烷燃烧:
31. 第101页习题4:氢气还原氧化铜:
32. 第107页:碳的不充分燃烧:
33. 第107页实验6-2:木炭和氧化铜高温加热:
34. 第108页:木炭和氧化铁高温加热:
35. 第109页:实验室制取二氧化碳:
36. 第109页:碳酸分解:
37. 第115页:二氧化碳和水反应:
38. 第115页:检验二氧化碳气体:
39. 第117页:一氧化碳燃烧:
40. 第118页:一氧化碳还原氧化铜:
41. 第120页习题8中:氧化钙加入水中:
42. 第136页实验7-5:盐酸中加入镁条:
43. 第140页酸雨形成:
44. 第142页乙醇燃烧:
九年级化学式与化合价习题精选(1)
一、选择题,每小题有1个正确答案,将正确答案填在题后的括号里。
1.下列含硫物质中,硫元素的化合价为+4价的是( )
A.S B.H2S C.H2SO3 D.H2SO4
2.下列有关化合价的说法中,正确的是( )
A.在NaCl和HCl里,氯元素均为–1价 B.在H2中,氢元素显+1价
C.一种元素在同一种化合物里,可能显不同的化合价 D.非金属元素在化合物里,一定显负价
3.下列四种物质①KClO3②Cl2③HCl④HClO,氯元素的化合价按由低到高顺序排列的是( )
A.①②④③ B.②③④① C.③②①④ D.③②④①
4.下列各组物质中,硫元素具有相同化合价的是( )
A.Na2SO4和SO3 B.SO2和SO3 C.SO2和H2SO3 D.S和H2S
5.某金属氧化物的组成为MO,如果在其氯化物中金属的化合价与该氧化物中的化合价相等,则该金属氯化物的组成为( )
A.MCl B.MCl2 C.M2Cl D.M2Cl
6.下列化学式正确的是( )
A.高锰酸钾(K2MnO4) B.氧化镁(MgO2) C.氯化钾(KClO3) D.氯化亚铁(FeCl2)
7.某化合物化学式为HnMO2n已知在该化合物中M的化合价为+6,则n值为( )
A.1 B.2 C.3 D.6
8.下列物质中氮元素的化合价由低到高的顺序排列一组是( )
A.N2O3、NH3、NO、N2 B.NH3 N2 NO N2O3 C.NH3、NO、N2、N2O3 D.NO、N2 、N2O3 、NH3
9.某含氧酸的化学式为HnXO2n-1,该含氧酸受热分解生成的氧化物的化学式可能为( )
A.XO B.XO2 C.X2O D.XO3
10.X、Y、Z三种元素的化合价分别为+1,+4,-2,则这三种元素组成的化合物的化学式可能为( )
A.XYZ B.X4YZ3 C.X2YZ3 D.X3YZ2
二、填空题
11.在NaNO3中N的化合价是___价;在NH4Cl中N的化合价是___价。
12.某化合物的化学式为HnRO2,它的式量为M,则R元素的化合价是____,R元素的原子量是____。
13.某金属元素R的碳酸盐化学式为R2(CO3)3,则R元素的化合价为_____,R元素的氢氧化物的化学式为____。
14.某元素R,它的氧化物的化学式为R2O3,则它的氯化物的化学式是____,它的硫酸盐化学式是_____。
九年级化学式与化合价习题精选(2)
1.某元素R的氧化物分子中,R与O的原子个数比为2︰3,则R的化合价是( )
A.+2价 B.+3价 C.-2价 D.-3价
2.下列物质的化学式,书写错误的是( )
A.氯化亚铁FeCl3 B.氢氧化钠NaOH C.氧化镁MgO D.碳酸钠NaCO3
3.某元素氧化物的化学式为M2O3(M化合价没有变化),则下列化学式中错误的是( )
A.MCl3 B.MSO4 C.M2(SO4)3 D.M(OH)3
4.下列说法正确的是( )
A.元素的化合价数值等于一个原子得失电子的数目 B.铁的化合价为零
C.水中氢气的化合价为零 D.单质铜中铜元素化合价为零,化合物中铜元素化合价为+1或+2价
5.下列化学式中正确的是( )
A.ZnCl3 B.Ca(NO3)2 C.K2OH D.AlCl2
6.某金属元素M的氯化物的化学式为M迅,其氧化物的化学式为( )
A.MO2 B.M2O C.MO D.M2O3
7.某元素的相对原子质量为27,化合价为+3,则其氧化物中含氧的质量分数为( )
A.47.1% B.26.5% C.77.1% D.72%
8.下列各个化学变化前后,同种元素的化合价数值变化最大的是( )
A.C→CO2 B.KClO3→KCl C.KMnO4→K2MnO4 D.NH3→NH4Cl
9.下列各组物质中氮元素的化合价由低到高的排列顺序是( )
A.N2 、NH3、NO2 B.NH3、N2O5、NO2 C.N2、N2O3、NH3 D.NH3、N2、N2O3
10.X、Y 、Z三种元素组成的化合物里,Y为+2价,Z为+5价,X为-2价。X、Z 两元素在化合物里组成的原子团为-3价,且有5个原子。则此化合物的化学式为 。
11.下列化学符号①2CO ②2Ag+ ③Mg ④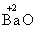 ⑤H2O中的数字“2”表示(填序号)
⑤H2O中的数字“2”表示(填序号)
(1)离子个数的是 ;(2)离子所带电荷数值的是 。
(3)分子个数的是 ;(4)元素化合价数值的是 。
12.某化合物的化学式为HnRO2n,则R的化合价为 ;若R的化合价为奇数1则R的氧化物的化学式为 ;若R的相对原子质量为A,则化合物HnRO2n 。的相对分子质量为 。
13.世界卫生组织把铝元素列为食品污染源之一,成人每日摄入铝元素的量应控制在0.004g以下。油条是我国许多地方的传统早点,每270g中含0.9 g明矾(KAl(SO4)2·12H2O)。试通过计算说明,若每日食用约150 g油条,请问铝元素的摄人量是否超过安全摄入量。
利用化学方程式计算习题精选
一、选择题
1.电解水得到的氢气和氧气的质量比是( ) A.2:1 B.4:8 C.1:8 D.1:16
2.电解54克水,可得到氢气( ) A.6克 B.3克 C.1.5克 D.8克
3.化学反应:A+2B=C+D,5.6克A跟7.3克B恰好完全反应,生成12.7克C。现要制得0.4D,则所需A的质量为( ) A.5.6克 B.11.2克 C.14.6克 D.无法计算
4.铝在氧气中燃烧,生成三氧化二铝,在反应中,铝、氧气、三氧化二铝的质量比( )
A.27:32:102 B.27:16:43 C.4:3:2 D.9:8:17
5.用氢气还原+2价金属氧化物a克,得到金属b克,则该金属的原子量是( )
A.16b/(a—b) B.4(a—b)/ b C.4b/(a—b) D.b/16(a—b)
6.质量相同的下列金属分别与足量盐酸反应时,产生氢气最多的是( )
A.Mg B.Al C.Zn D.Fe
7.铝在氧气中燃烧生成三氧化二铝,在这个反应中,铝、氧气、三氧化二铝的质量比是( )
A.27:32:102 B.27:24:43 C.4:3:2 D.108:96:204
8.4克氧气可跟( )克氢气完全反应。 A.1 B.0.5 C.2 D.4
9.3克镁在足量的氧气中完全燃烧,可得氧化镁( )克 A.10 B.6 C.5 D.12
10.在化学反应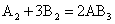 中,6克
中,6克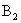 与足量的
与足量的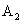 反应后,得34克
反应后,得34克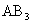 ,则化合物中,A、B两元素质量比( ) A.17:4 B.14:3 C.14:7 D.14:17
,则化合物中,A、B两元素质量比( ) A.17:4 B.14:3 C.14:7 D.14:17
11.用铝和铁分别和足量的稀硫酸反应,都得到2克氢气,则消耗铝和铁的质量比为( )
A.1:1 B.27:28 C.9:28 D.3:2
12.2.3克钠、2.4克镁、2.7克铝分别与足量的盐酸反应,按钠、镁、铝的顺序得到氢气的质量比为( ) A.1:2:3 B.1:1:1 C.2:3:1 D.3:2:1
13.相同质量的钠、镁、铝、铁分别跟足量的稀硫酸反应,生成氢气的质量比是( )
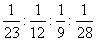 A.1:2:3:2 B.2:3:2:1 C.
A.1:2:3:2 B.2:3:2:1 C.
14.用氢气还原氧化铜的实验中,还原8克氧化铜,应该通入氢气的质量是( )
A.小于0.2克 B.等于0.2克 C.大于0.2克
15.托盘天平调至平衡,在两盘烧杯中各盛98克10%的硫酸,向两边烧杯中同时分别加入足量Mg,Zn欲使天平仍保持平衡,加入Mg和Zn的质量分别是( )
A.3克Mg,3克Zn B.1克Mg,1克锌 C.7克Mg,7克Zn D.5克Mg,5克Zn
16.8克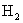 在
在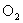 中充分燃烧,需要消耗
中充分燃烧,需要消耗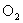 _______克( )
_______克( )
A.56克 B.64克 C.72克 D.60克
17.制取71克五氧化二磷,需要磷_______克,需要烧氧气_______克( )
A.30克30克 B.30克40克 C.31克40克 D.40克31克
二、填空题
1.12.25克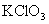 跟3.25克
跟3.25克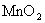 共热,反应完全后剩余物的质量为10.7克。则其中
共热,反应完全后剩余物的质量为10.7克。则其中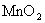 是_______,
是_______,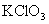 分解的质量为_______克,产生
分解的质量为_______克,产生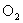 的质量为_______克。
的质量为_______克。
2.相同质量的Mg、Zn、Fe分别跟足量的稀硫酸反应,产生氢气的速度最快的是_______产生氢气的质量比为_______。
3.电解10克水,能得到氢气_______克,氧气_______克。
4.相同质量的锌分别跟足量的稀盐酸、稀硫酸反应,产生的氢气质量比为_______。
5.在高温下用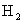 还原m克氧化铁,得到n克铁,氧的原子量为16,铁的原子量是
还原m克氧化铁,得到n克铁,氧的原子量为16,铁的原子量是
_______。
6.某同学用氢气还原氧化铜,实验完毕后,得到6.4克铜,共用去氢气0.6克,则被还原的氧化铜的质量是_______。
三、计算题
1.实验室要制取4.8克氧气,至少需分解多少克高锰酸钾?
2.26克锌跟足量的稀硫酸反应后,将产生的氢气全部用来还原三氧化钨(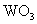 ),求可还原出多少克钨(W)?
),求可还原出多少克钨(W)?
3.将21g铁粉与足量的稀硫酸反应。计算:①生成的氢气和硫酸亚铁各多少克?②生成的氢气在标准状况下的体积是多少升?(氢气的密度是0.09g/L)
4.往10g含有Cu粉的CuO粉末中,通入足量干燥的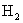 并加热至质量不再减轻为止,冷却后称得残留固体质量为8.4g,求原混合物中CuO的质量分数。
并加热至质量不再减轻为止,冷却后称得残留固体质量为8.4g,求原混合物中CuO的质量分数。
四、实验题
密闭容器内装入某混合气体,用电火花点燃,恰好完全反应,此混合气体可能是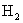 、CO、
、CO、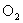 三种中的二种或三种混合而成。
三种中的二种或三种混合而成。
(1)此混合气体组成可能有以下几种情况:
①若由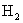 、
、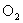 混合而成,则氢分子与氧分子个数之比为_______。
混合而成,则氢分子与氧分子个数之比为_______。
②若由CO、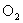 混合而成,则一氧化碳分子与氧分子个数之比为_______。
混合而成,则一氧化碳分子与氧分子个数之比为_______。
(2)若此混合气体肯定有32g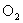 和其它两种气体组成,在混合气体总质量为62g这一特定情况下,
和其它两种气体组成,在混合气体总质量为62g这一特定情况下,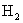 、CO、
、CO、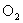 三者质量之比为_______。
三者质量之比为_______。
五、创新题
1.有一不纯的铁5.6g与足量的稀硫酸反应,放出0.21g氢气,则铁片中可能含有的一种金属杂质为( )
A.Mg B.Zn C.Cu D.Al
2.镁在空气中燃烧不仅生成氧化镁,还有部分镁与氮气化合(生成物中N呈-3价),由此可以推知12g镁在空气中燃烧后所得产物的质量为( )
A.等于20g B.小于20g C.大于20g D.以上情况都可能
3.托盘天平调至平衡,在两盘烧杯中各盛98g 10%的硫酸,向两边烧杯中同时分别加入足量Mg、Zn,欲使天平仍保持平衡,加入Mg和Zn的质量分别是( )
A.3g Mg,3g Zn B.1g Mg,1g Zn C.7g Mg,7g Zn D.5g Mg,5g Zn
4.为了制取氧气,取一定质量的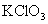 和一定质量的
和一定质量的 共热,开始时
共热,开始时 在混合物中的质量分数为25%,当
在混合物中的质量分数为25%,当 的质量分数提高到30%时,试计算
的质量分数提高到30%时,试计算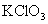 分解的质量分数?
分解的质量分数?
5.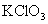 和
和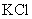 的混合物中,含
的混合物中,含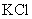 a克,加热分解完全后,
a克,加热分解完全后,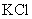 的质量是2a克。则原混合物中
的质量是2a克。则原混合物中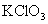 和
和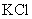 的质量比约为( )
的质量比约为( )
A.1:1 B.2:1 C.1.64:1 D.1.5:1
6.在加热的条件下,用氢气还原a克氧化铜至剩余固体为b克时,参加反应的氢气的质量为( )
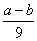

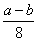
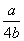
A. 克 B. 克 C. 克 D. 克
第二篇:新人教版九年级化学方程式汇总(整理)
九年级——化学方程式及现象汇总
(上册课本)一、化合反应:
1、镁在空气中燃烧:2Mg + O2点燃 2MgO
现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末
2、铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4
现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体
注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:2Cu + O2△2CuO 现象:铜丝变黑。
4、铝在氧气中燃烧:4Al + 3O2点燃 2Al2O3
现象:发出耀眼的白光,放热,有白色固体生成。
5、氢气中空气中燃烧或爆炸:2H2 + O2点燃 2H2O
现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
6、红(白)磷在空气中燃烧:4P + 5O2点燃 2P2O5
现象:(1)发出白光(2)放出热量(3)生成大量白烟。
7、硫粉在空气中燃烧: S + O2点燃 SO2 现象:(注意两种现象有差异)
A、在纯的氧气中
发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧
(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
8、碳在氧气中充分燃烧:C + O2点燃 CO2
现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊
9、碳在氧气中不充分燃烧:2C + O2点燃 2CO
10、二氧化碳通过灼热碳层:C + CO2高温 2CO(吸热反应)上册111页
11、一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2
现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。
12、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O == H2CO3
现象:石蕊试液由紫色变成红色。
注意: 某些非金属氧化物+水→酸 如:
SO2 + H2O == H2SO3(亚硫酸) SO3 + H2O == H2SO4(硫酸)
13、生石灰溶于水:CaO + H2O == Ca(OH)2(此反应放出热量)
14、用无水硫酸铜鉴定水的存在:(化学方程式不用特别记忆,但要记得这种方法及现象CuSO4 + 5H2O = CuSO4·5H2O(五水硫酸铜,胆矾)
现象:白色粉末变成蓝色
拓展:框内的化学反应只做知识性的了解
1.工业上制盐酸(氢气在氯气中燃烧):H2 + Cl2点燃 2HCl
2.溶洞的形成中碳酸钙的溶解:CaCO3 + H2O + CO2 == Ca(HCO3)2
3.制取四氯化硅:Si + Cl2 =SiCl4 (液态)
二、分解反应:
15、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑
现象:(1)电极上有气泡产生。正氧负氢,氢二氧一(体积比)
正极产生的气体能使带火星的木条复燃。
负极产生的气体能在空气中燃烧,产生淡蓝色火焰
16、实验室用双氧水制氧气:2H2O2MnO2 2H2O+ O2↑
现象:有气泡产生,带火星的木条复燃。
17、高温锻烧石灰石:CaCO3 高温 CaO+CO2↑ (工业制取氧化钙、二氧化碳)
18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑
现象:石蕊试液由红色变成紫色
19、加热高锰酸钾制取氧气:2KMnO4 △K2MnO4 + MnO2 + O2↑
20、加热氯酸钾(有少量的二氧化锰)制氧气:2KClO3MnO2 2KCl + 3O2 ↑
21、加热氧化汞:2HgO △2Hg + O2↑
拓展:框内的化学反应只做知识性的了解
1、加热碱式碳酸铜:Cu2(OH)2CO3△2CuO + H2O + CO2↑
现象:绿色粉末变成黑色,试管内壁有水珠生成,澄清石灰水变浑浊。
2、硫酸铜晶体受热分解:CuSO4·5H2O △ CuSO4 + 5H2O
3、溶洞的形成碳酸氢钙的分解: Ca(HCO3) 2==CaCO3 ↓+ H2O + CO2↑
4、工业电解氧化铝制取金属铝: 2Al2O3通电4Al + 3O2↑
5、氯化镁电解制取金属镁:MgCl2通电Mg + Cl2↑
6、碳酸氢钠加热分解制纯碱:2NaHCO3△ Na2CO3 + H2O + CO2↑
(下册课本)三、置换反应:
(1) 金属单质 + 酸 ------ 盐 + 氢气
22、锌和稀硫酸反应:Zn + H2SO4 === ZnSO4 + H2↑
23、镁和稀硫酸反应:Mg + H2SO4 === MgSO4 + H2↑
24、铝和稀硫酸反应:2Al + 3H2SO4 == Al2(SO4)3 + 3H2↑
25、锌和稀盐酸反应:Zn + 2HCl=== ZnCl2 + H2↑
26、镁和稀盐酸反应:Mg+ 2HCl=== MgCl2 + H2↑
27、铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3H2↑
22-27的现象:都有气泡产生,但是剧烈程度不相同。
28、铁和稀盐酸反应:Fe + 2HCl=== FeCl2 + H2↑
29、铁和稀硫酸反应:Fe + H2SO4 == FeSO4 + H2↑
铁单质参加的置换反应,铁元素由“0”价变为“+2”价,生成“某亚铁”
28-29的现象:有气泡产生,溶液由无色变成浅绿色。
(2)金属单质 + 盐(溶液) --- 另一种金属 + 另一种盐
30、铁与硫酸铜反应:Fe + CuSO4==Cu + FeSO4
现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。
(古代湿法制铜及“曾青得铁则化铜”所指的是此反应)
31、锌片放入硫酸铜溶液中:CuSO4+Zn==ZnSO4+Cu
现象:锌片表面覆盖一层红色的物质,溶液由蓝色变成无色。
32、铜片放入硝酸银溶液中:2AgNO3 + Cu == Cu(NO3)2 + 2Ag
现象:铜片表面覆盖一层银白色的物质,溶液由无色变成蓝色。
33、锌片放入硝酸银溶液中:2AgNO3 + Zn == Zn(NO3)2+ 2Ag
现象:锌片表面覆盖一层银白色的物质
34、铁丝放入硝酸银溶液中:2AgNO3 + Fe == Fe(NO3)2+ 2Ag
现象:铁丝表面覆盖一层银白色的物质,溶液由无色变成浅绿色。
(3)金属氧化物+木炭或氢气→金属+二氧化碳或水(固体间的置换反应)
35、焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑
36、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑
37、氢气还原氧化铜:H2 + CuO △ Cu + H2O
现象:黑色粉末变成红色,试管内壁有水珠生成
38、氢气与四氧化三铁反应:Fe3O4 + 4H2高温 3Fe + 4H2O
39、氢气与氧化铁反应:Fe2O3+3H2 高温2Fe+3H2O
现象:红色(氧化铁)粉末逐渐变成黑色,管内壁有水珠生成。
拓展:框内的化学反应只做知识性的了解
(4)其它情况:
水蒸气通过灼热碳层:H2O + C 高温H2 + CO(制取水煤气)
四、复分解反应:
(1)金属氧化物+酸→盐+H2O
40 .Fe2O3+6HCl==2FeCl3+3H2O 41、Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
现象:红色粉末逐渐溶解,溶液由无色变成黄色(稀酸除锈)
42、CuO+H2SO4==CuSO4+H2O
现象:黑色粉末逐渐溶解,溶液由无色变成蓝色
(2)酸+碱→盐+H2O(又叫中和反应)
43、Cu(OH)2+2HCl==CuCl2+2H2O 44、Cu(OH)2+H2SO4==CuSO4+2H2O
现象:蓝色粉末逐渐溶解,溶液由无色变成蓝色
45、NaOH+HCl==NaCl+H2O 46、2NaOH+H2SO4==Na2SO4+2H2O
47、Mg(OH)2+2HCl==MgCl2+2H2O 48、Ba(OH)2+H2SO4==BaSO4↓+2H2O
(3)酸+盐→新盐+新酸
49、CaCO3+2HCl==CaCl2+H2O+CO2↑(实验室制取二氧化碳的反应原理)
50、Na2CO3+2HCl==2NaCl+H2O+CO2↑ 灭火器的反应原理
现象:两个反应都有大量的气泡生成。
51、HCl+AgNO3==AgCl↓+HNO3 52、H2SO4+BaCl2==BaSO4↓+2HCl
(51、52)现象:生成不溶于稀硝酸的白色凝乳状沉淀。
53、Ba(NO3)2+H2SO4==BaSO4↓+2HNO3
现象:生成不溶于稀硝酸的白色沉淀。
54、NaHCO3+HCl==NaCl+H2O+CO2↑
(4)盐1+盐2→新盐1+新盐2
55、KCl+AgNO3==AgCl↓+KNO3 56、NaCl+AgNO3==AgCl↓+NaNO3
57、Na2SO4+BaCl2==BaSO4↓+2NaCl
58、BaCl2+2AgNO3==2AgCl↓+Ba(NO3)2
(55——58)现象:生成既不溶于水也不溶于稀硝酸的白色沉淀。
59、BaCl2+Na2CO3==BaCO3↓+2NaCl 60、CaCl2+Na2CO3==CaCO3↓+2NaCl
(59、60)现象:生成不溶于水但可溶于稀硝酸的白色沉淀。
(5)盐+碱→新盐+新碱
61、CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
62、Ca(OH)2+CuCl2==Cu(OH)2↓+CaCl2
(61、62)现象:生成蓝色沉淀。
63、FeCl3+3NaOH==Fe(OH)3↓+3NaCl 现象:生成红褐色沉淀。
64、Ca(OH)2+Na2CO3==CaCO3↓+2NaOH (制取烧碱)现象:生成白色沉淀。
65、MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 现象:生成白色沉淀。
66、NaOH+NH4Cl==NaCl+NH3↑+H2O
(铵盐的特性:铵盐与碱反应产生有刺激性气味的气体——氨气)
67、Ca(OH)2+(NH4)2SO4==CaSO4+2NH3↑+2H2O (铵态氮肥不能与碱性物质混合)
68、Ca(OH)2+2NH4NO3==Ca(NO3)2+2NH3↑+2H2O
现象:生成具有刺激性气味且能使湿润的红色石蕊试纸(或pH试纸)变蓝的气体。
(66——68)铵态氮肥、NH4+离子的检验方法:与可溶性碱混合(加热),会放出有刺激性气味的气体。
五、其它反应:
1、二氧化碳通入澄清石灰水:CO2 +Ca(OH)2 ==CaCO3↓+ H2O
现象:澄清石灰水变浑浊。
(用澄清石灰水可以检验CO2,也可以用CO2检验澄清石灰水)
2、氢氧化钙和二氧化硫反应:SO2 +Ca(OH)2 ==CaSO3+ H20
3、氢氧化钠和二氧化碳反应(除去二氧化碳):
2NaOH + CO2 ==== Na2CO3 + H2O
4、氢氧化钠和二氧化硫反应(除去二氧化硫):
2NaOH + SO2 ==== Na2SO3 + H2O
5、氢氧化钠和三氧化硫反应(除去三氧化硫):
2NaOH + SO3 ==== Na2SO4 + H2O
注意:1-6都是:非金属氧化物 + 碱 ------- 盐 + 水
7、一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO2
现象:红色粉未变成黑色,澄清石灰水变浑浊。(冶炼铁的主要反应原理)
8、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
现象:黑色粉未变成红色,澄清石灰水变浑浊
拓展:框内的化学反应只做知识性的了解
1、海水制碱中制取碳酸氢钠:NH3 + NaCl + H2O + CO2== NaHCO3 + NH4Cl
2、一氧化碳还原四氧化三铁:Fe3O4+4CO高温3Fe+4CO2
3、工业制玻璃: CaCO3+SiO2 高温CaSiO3 + CO2↑
Na2CO3+SiO2 高温Na2SiO3 + CO2↑
-
20xx九年级上册化学方程式汇总
化学方程式汇总一化合反应点燃1镁在空气中燃烧2MgO22MgO点燃2铁在氧气中燃烧3Fe2O2Fe3O4剧烈燃烧火星四射生成黑色固…
- 人教版九年级上册化学化学方程式汇总大全
- 人教版九年级上册化学化学方程式汇总
-
九年级上册化学必须记住的化学式和化学方程式
九年级上册化学必须记住的化学式一单质的化学式25个1气态非金属单质氧气O氮气N氢气H氯气Cl2固态非金属单质碳C磷P硫S硅Si3稀…
-
初三化学上册化学方程式总结
初三化学1-9单元化学方程式总结24.CO+CuOCu+CO2一、物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2…
-
初三化学上册化学方程式总结
初三化学1-9单元化学方程式总结24.CO+CuOCu+CO2一、物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2…
-
九年级上册化学化学方程式归纳集锦
一、各物质在氧气中燃烧方程式及现象1、4P+5O2现象:2、C+O2现象:3、S+O2现象:4、3Fe+2O2现象:5、2Mg+O…
-
初三上册化学方程式总结
初三化学上册化学方程式及反应现象德江第六中学(张真老师编)1、2Mg+O22MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量…
-
最新人教版九年级化学上册化学方程式及实验现象总结
九年级上册化学方程式及实验现象总结一、化合反应1、木炭(碳)在空气中燃烧现象:发出红.光.,放出热量,生成能使澄清石灰水变浑浊的气…
-
九年级上学期化学方程式 总结
九年级上学期化学方程式总结一、与氧有关的化学方程式:2Mg+O2点燃====2MgO现象:燃烧、放出大量的热、同时放出耀眼的白光S…