自己总结的物质的量
路舟教育内部讲义
一、微粒数、物质的量、实际质量之间的关系
24 23 微粒数 1.204×10个H原子 6.02×10个O原子
↖ ↗
6.02×1023 个水分子
物质的量 ↓
1mol水分子
↓
18g水
↙ ↘
质量 2gH元素 16gO元素

练习:1、计算4.9g硫酸中含有的氧原子数。与4.9g硫酸所含氧原子数相同的臭氧的质量是多少?
二、摩尔质量与气体摩尔体积
1. 摩尔质量 ①单位物质(1mol)的量的物质所具有的质量; ②单位是g/mol或kg/mol
例1:“摩尔质量在数值上一定等于该物质的相对分子质量或相对原子质量”。这句话对否?为什么?
-1-1-1答:不对。因为摩尔质量的单位有g·mol或kg·mol等,只有以g·mol为单位时,在数值上才与微观
粒子的相对原子质量或相对分子质量相等。
例2:两种原子的质量之比与其相对原子质量之比有何关系?为什么?
答:相等。因为任何一种原子的相对原子质量,都是以12C质量的1/12为标准所得的比值。所以,任何原子的质量之比,就等于它们的相对原子质量之比。
2. 气体摩尔体积 ①单位物质(1mol)的量的气体所占的体积; ②单位是L·mol-1
注意:① 利用22.4 L·mol-1计算或判断时一定要看清气体所处的状况。
② 注意物质在标准状况下的状态是否为气态。
例3 下列说法中正确的是( )
A.摩尔是国际单位制中的七个物理量之一 B.0.5 mol H2O中含有的原子数目为1.5NA
C.64 g氧相当于2 mol氧 D.1 mol任何物质都约含有6.02×1023个原子 例4 下列说法中正确的是( )
A.32 g O2占有的体积约为22.4 L B.22.4 L N2含阿伏加德罗常数个氮分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
例5 标准状况下,1molH2的气体摩尔体积为22.4L ( )
三、阿伏加德罗定律及推论(对于气体):同温同压下相同体积的任何气体都含有相同数目的分子。 “四同定律”-----三同定一同,两同定比例
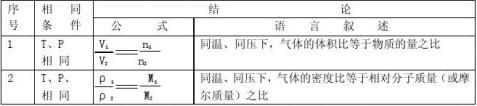
xy 22,求A的分子式。
路舟教育内部讲义
2、同温同压下,xg的甲气体和yg的乙气体占有相同的体积,则x:y的值可以表示( )(双选)
A、甲与乙的相对分子质量之比 B、等质量的甲与乙的分子个数之比
C、同温同下下,甲与乙密度之比 D、同温同体积下,等质量的甲与乙的压强之比
3、同温同压下,同体积的甲烷和二氧化碳的物质量之比为 ,原子总数之比为 ,质量之比
为 ,密度之比为 。
※ 最简式相同的物质混合问题 (且听我娓娓道来)
※ “差量法”解化学计算题
例1、 看黑板
化学计算中的 “差量法”的理论依据是数学上的“等比定理”:

例2:将12.8g铜片放入足量AgNO3溶液中,一段时间后,取出铜片洗净烘干后,称得质量为13.56g,计算有
多少克铜被氧化。
解:Cu+2AgNO3=Cu(NO3)2+2Ag 固体增加质量△m
64g 216g 216g-64g=152g
m(Cu) 13.56g-12.8g =0.76g
例3:天平两端各放一只质量相等的烧杯,内盛等体积等浓度的足量稀盐酸,将物质的量都为a mol的铝和镁分别放入左盘和右盘的烧杯中,反应完毕后,在哪一盘的烧杯中加入多少克同种金属才能平衡。
解:右盘:Mg+2HCl=MgCl2+H2↑ 溶液质量增加△m
1 mol 2g 24g-2g=22g
a mol 22a
左盘:2Al+6HCl=2AlCl3+3H2↑ 溶液质量增加△m
2 mol 6g 54g-6g=48g
a mol 24a
例4:CS2能够在氧气中完全燃烧生成CO2和SO2。今用0.228g CS2在448 mL氧气(标准状况时的体积)中完全燃烧,反应后气体混合物在标准状况下的体积是多少?
解 :(差量法)书写化学反应式并分析气体在反应前后的分子总数之差,利用差量法解题。
CS2(液体) + 3 O2 (气体) === CO2 (气体)+ 2 SO2 (气体) 气体体积差
3 1 2 3
练习:氢气和氧气的混合气体,在120摄氏度和一定压强下体积为aL,点燃后发生化学反应,待气体恢复至原来温度和压强时,测得其体积为bL,则原混合气体中氢气和氧气的体积各为多少升?
第二篇:总结高中化学“反应物的物质的量不同,导致产物的差异”的化学方程式
总结高中化学“反应物的物质的量不同,导致产物的差异”的化学方程式
一,NaOH与AlCl3反应
少量:
化学方程式:3NaOH + AlCl3 == 3NaCl + Al(OH)3↓
离子方程式:3OH- +Al3+ ==Al(OH)3↓
过量:
化学方程式4NaOH+AlCl3 ==NaAlO2 + 3NaCl + 2H2O
离子方程式:4OH- + Al3+ ==AlO2- + 2H2O
二,NaHCO3与Ca(OH)2反应
NaHCO3少量:
化学方程式:NaHCO3 + Ca(OH)2 == CaCO3↓+ NaOH + H2O 离子方程式:HCO3- + Ca2+ +OH- == CaCO3↓+ H2O
NaHCO3过量:
化学方程式:2NaHCO3 + Ca(OH)2 == CaCO3↓+ Na2CO3 + 2H2O 离子方程式:2HCO3- + Ca2+ +2OH- == CaCO3↓+ + CO32- + 2H2O
三,NaOH与CO2反应
足量NaOH与CO2反应:2NaOH+CO2=Na2CO3+H2O NaOH与过量CO2反应:2NaOH+CO2=Na2CO3+H2O Na2CO3+CO2+H2O=2NaHCO3
四,C和O2反应
C+O2=CO2(O2足量)
2C+O2=2CO(O2不足量)
五,Ca(OH)2与CO2反应
Ca(OH)2+CO2=CaCO3↓+H2O(CO2足量)
Ca(OH)2+2CO2=Ca(HCO3)2(CO2过量)
可以按以下思路进行归纳:
①生成的产物可与过量的物质继续反应的离子反应.
这类离子反应,只需注意题给的条件,判断产物是否与过量的物质继续反应,正确确定产物的形式即可.
如:NaOH与AlCl3溶液(足量或不足量);NaAlO2溶液通入CO2(少量或足量)或加盐酸(少量或足量);Ca(OH)2溶液通入CO2(少量或足量);NaAlO2溶液加入盐酸(少量或过量).又如二氧化碳和氢氧化钠反应,二者1:2时生成碳酸钠和水,
1:1时生成碳酸氢钠,若比值介于二者之间则产物是碳酸钠、碳酸氢钠和水。又有H2S、SO2等(相当于二元弱酸的物质)与之类似
②酸式盐与量有关的离子反应.
一般书写时,量不足的物质与参与反应的离子的物质的量之比一定要与它的化学式相符合,而足量的物质与参加反应的离子的物质的量之比不一定与它的化学式相符.如果没有明确的用量,用任一反应物作为足量写出的离子方程式均属正确. 如:NaHSO4溶液与Ba(HCO3)2溶液(少量或足量);Ca(HCO3)2溶液与NaOH溶液(少量或足量);Ca(OH)2与NaHCO3溶液(不限制用量);NaH2PO4溶液与Ba(OH)2溶液(少量或足量)等,均应明确用量的影响.
③较特殊且与量有关的离子反应.
这类反应要求量与其他因素统筹兼顾.
如:Mg(HCO3)2溶液与过量NaOH溶液反应;
明矾与足量Ba(OH)2溶液反应;
NH4HSO4溶液与足量Ba(OH)2溶液反应;
新制氯水与少量FeBr2溶液反应;FeBr2+Cl2——;
FeCl3+Zn——(FeCl3溶液与较活泼的金属如锌的反应,依锌的量不同而产物不同,如少量或适量的锌,将锌氧化生成Zn2+,Fe3+ 被还原成Fe2+。Zn+2Fe3+==Zn2++2Fe2+
如过量的锌,在发生上述反应的基础上,剩余的锌与Fe2+发生置换反应,总的化学方程式为:3Zn(过量)+2Fe3+==3Zn2++2Fe)
还有金属与硝酸反应时铁的量不同,反应产物也不同
-
物质的量知识点总结
物质的量知识点复习1摩尔物质的量是国际规定的七个基本物理量之一用来表示含一定数目粒子的集体符号是n单位是mol摩尔是计量原子分子或…
-
物质的量知识点小结
物质的量知识点小结有关概念1物质的量n物质的量是国际单位制中七个基本物理量之一用物质的量可以衡量组成该物质的基本单元即微观粒子群的…
-
物质的量总结(重要)
物质的量知识点总结一有关概念1物质的量1概念表示物质所含微粒数目多少的物理量2符号n3单位mol2摩尔1概念摩尔是物质的量的单位每…
-
物质的量 公式总结
物质的量的复习指导一理清物质的量摩尔阿伏加德罗常数三者的关系物质的量在国际单位制SI中是七个最基本的物理量之一用于表示微观粒子或这…
-
物质的量知识点总结
一物质的量及其单位1物质的量与质量长度等一样是科学上来研究微粒的物理量它的单位是摩尔即摩尔是表示物质的量的单位mol2摩尔的基准科…
-
工程质量监督员年终总结
建设工程质量监督员年终工作总结20xx年本人在住建局和建设工程质量管理站的正确领导下,立足本职工作,认真完成了领导交待的各项任务,…
-
关 于 质 量 工 作 总 结
关于XXX年质量工作会议总结质量是企业的生命。质量工作是一个非常关键性的工作,质量工作开展的好坏取决于企业对质量工作重视程度。各部…
-
建筑质量员工作总结
20xx年工作总结一年来,本人认真遵守项目部的管理制度,按时出勤,有效利用工作时间;坚守岗位,工作积极,需要加班完成工作按时加班加…
-
质量月活动总结
根据公司《关于开展20xx年质量月活动的通知》,积极响应以“增强质量红线意识,提高质量管控水平”为主题的质量月活动,在公司的领导下…
-
XXXX年产品质量总结
年产品质量总结质量是企业的生命。质量工作是一个非常关键的工作,质量工作开展的好坏取决于企业对质量工作重视程度。各部门、各方面都应高…