无机化学性质实验报告 镉锰锌铜
无机化学性质实验报告
课程名称:无机化学实验实验名称 :铜银锌镉汞
一.实验目的。
1. 了解ds 区元素单质及化合物的结构对性质的影响。
2. 掌握ds区元素单质的氧化物或氢化物的性质。
3. 掌握ds区元素单质的金属离子形成配合物的特征。
4. 掌握Cu(Ⅰ)与Cu(Ⅱ)的相互转化条件。
5. 学习ds区元素离子的鉴定。
二.实验原理。
铜银锌镉汞皆是周期系ds区元素。在化合物中,铜银锌镉汞常见的氧化物通常是+2,其中铜和汞也有+1;银的氧化数通常是+1.
1. 蓝色的Cu(OH)2具有两性。Ag+与适量的NaOH反应只能得到Ag2O沉淀,因AgOH极其不稳定,在室温下即可脱水生成Ag2O 。 Ag++2O H -===Ag2O+H2O
铜二价与过量的氨水作用可生成深蓝色的四氨合铜配离子,银离子与适量的氨水作用可生成氧化银沉淀,过量时生成无色Ag(NH3)2+配离子。
Hg2+ 、Hg22+与过量氨水反应时,首先生成难溶于水的白色氨基化合物,在没有大量NH4+存在的条件下,氨基化合物不宜形成氨配离子。在有大量NH4+存在的条件下,氨基化合物可溶于氨水形成配离子。
Cu2能在中性或弱碱性环境中与K4[Fe(CN)6] 反应生成红棕色的Cu2【Fe(CN)6】沉淀,可以利用这个反应来鉴定Cu2。
2.锌的氧化物和氢氧化物均显两性。
3镉的氧化物和氢氧化物均显碱性。
4汞一价二价的氧化物和氢氧化物均显碱性。
5.Cu2+ 、Ag+、Zn2+、Cd2+、Hg22+ 、Hg2+溶液中通入H2S都可生成相应的硫化物沉淀,其中ZnS的KSPθ较大,通入H2S是必须控制溶液的pH值。HgS沉淀极难溶,但可溶于过量的Na2S。通常,在实验室中用王水溶解HgS。Hg2S沉淀不稳定,见光即分解为HgS和Hg。
6.在水溶液中 具有一定的氧化性,能氧化I-和SCN-等,白色的Cu2I2 能溶于过量的KI或KSCN溶液中生成[CuI2]-或【Cu(SCN)2】配离子,这两种离子在稀释时由沉淀为 Cu2I2 和 Cu(SCN)2。
在加热的碱性溶液中, Cu2+能氧化醛或糖类,并生成砖红色的Cu2O.
7,在水溶液中银离子有一定的氧化性。在盐溶液中加入过量的氨水,在加热时,能将醛类或某些糖类氧化,本身被还原成银单质,应用这个反应来制备银镜。
8.Zn2+在强碱性溶液中与二苯硫腙反应生成粉红色的螯合物,Cd2+与饱和溶液反应能生成黄色的CdS沉淀。

三.思考题集讨论。
1. 氢氧化铜的性质; ①热稳定性较碱金属的氢氧化物差得多,受热易分解,加热至253k 时脱水转变为CuO;②氢氧化铜溶于氨水可形成铜氨配离子;③氢氧化铜略显两性,即可溶于酸又可溶于浓碱溶液中。
铜主要有+1和+2 两种氧化态,气态时,Cu+的化合物较稳定,在水溶液中中,Cu2+较稳定。
3.银的卤化物的溶解性从氯到碘逐渐减小。氯化银很好溶于氨水中,溴化银很好溶于硫代硫酸钠溶液,碘化银可以溶于KCN溶液中。
4.锌与少量氨水反应生成白色沉淀,与过量氨水生成配合物【Zn(NH3)4】+而显无色。镉与氨水只生成氢氧化镉。
6.在水溶液中,由铜的电势图 EAθ/V Cu2+0.153 Cu+ 0.521 Cu 可知,Eθ右> Eθ左,Cu+转化为Cu2+的趋势很大,经行的很彻底。使Cu2+ 转化为Cu+时,除了还原剂的存在外,还必须有Cu+的沉淀剂或配位剂,以降低溶液中Cu2+的浓度,使之成为难溶物或难解离的化合物,易于转化。
7.用氨水,可由上面实验1、2得到。
第二篇:无机化学实验二十一 ds区元素(铜银锌镉汞)的性质
实验11 ds区元素(铜、银、锌、镉、汞)的性质
一、实验目的
1、掌握铜、锌氢氧化物的酸碱性;
2、掌握铜、银、锌、汞的配合物的生成和性质;
6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理
IB IIB
Cu Zn Cu(+2,+1) Zn(+2)
Ag Cd Ag(+1) Cd(+2)
Au Hg Au(+1,+3) Hg(+2,+1)
蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO。AgOH在常温下极易脱水而转化为棕色的Ag2O。Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg2O(I)。
易形成配合物是这两副族的特性,Cu2+、Ag+、Zn2+、Cd2+与过量的氨水反应时分别生成[Cu(NH3)4]2+、[Ag(NH3)2]+、[Zn(NH3)4]2+、[Cd(NH3)4]2+。但是Hg2+和Hg22+与过量氨水反应时,如果没有大量的NH4+存在,并不生成氨配离子。如:
HgCl2 + 2NH3 = Hg(NH2)Cl↓白+ 2 NH4Cl
Hg2Cl2 + 2NH3 = Hg(NH2)Cl↓白+ Hg↓黑+NH4Cl (观察为灰色)
Cu2+具有氧化性,与I-反应,产物不是CuI2,而是白色的CuI:
Cu2+ + I- = 2CuI↓白 + I2
将CuCl2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl2]-的溶液。将溶液稀释,得白色CuCl沉淀:
Cu + Cu2+ + 4Cl- = 2[CuCl2]-
[CuCl2]-←稀释→CuCl↓白 + Cl-
卤化银难溶于水,但可利用形成配合物而使之溶解。例如:
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl-
红色HgI2难溶于水,但易溶于过量KI中,形成四碘合汞(II)配离子:
HgI2 + 2I- = [HgI4]2-
黄绿色Hg2I2与过量KI反应时,发生歧化反应,生成[HgI4]2-和Hg:
Hg2I2+ 2I- = [HgI4]2-+ Hg↓黑
三、实验内容
1、 氧化物的生成和性质
(1) Cu2O的生成和性质
Cu2+ + 2OH- =Cu(OH)2↓ 蓝色
Cu(OH)2 + 2OH- = [Cu(OH)4]-2- 蓝色
2[Cu(OH)4]2-+ C6H12O6 (葡萄糖) =Cu2O↓(红) + 4OH-+C16H12O7+2H2O
或:2Cu2+ + 5OH- +C6H12O6 = Cu2O↓+ C6H11O7- + 3H2O (须加热)
分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。由于制备方法和条件的不同,Cu2O晶粒大小各异,而呈现多种颜色黄、橙黄、鲜红或深棕。
红色沉淀Cu2O离心分离后,分为两份:
一份加酸:Cu2O + H2SO4 = Cu2SO4 + H2O= CuSO4 + Cu + H2O
一份加氨水:Cu2O+4NH3?H2O=2[Cu(NH3)2]+ (无色溶液)+ 3H2O+2OH-
2[Cu(NH3)2]++4NH3?H2O+1/2O2 =2[Cu(NH3)4]2+ (蓝色溶液)+2OH-+3H2O
(2)Ag2O的生成和性质
2Ag+ + 2OH- = Ag2O↓(棕色)+ H2O
Ag2O + 2HNO3 = 2AgNO3 + H2O
Ag2O + 4NH3H2O = 2[Ag(NH3)2]OH + 3H2O
(3)HgO的生成和性质
Hg2+ + 2OH- = HgO↓(黄色) + H2O
HgO + 2HCl = HgCl2 + H2O
HgO + NaOH= 不反应 (HgO碱性)
Hg22++2OH-=Hg↓+HgO↓+H2O (歧化反应)
2、氢氧化物的生成与性质
(1) Cu2+ + 2OH- = Cu(OH)2↓(蓝色絮状)
加热:Cu(OH)2 = CuO↓ (黑色)+ H2O
加酸:Cu(OH)2 + 2H+= Cu2+ + 2 H2O
加浓碱 :Cu(OH)2 + 2OH- (6M) = [Cu(OH)4]2-
Cu(OH)2两性偏碱,所以需强碱使之生成配离子
(2)Zn2+ + 2OH- = Zn(OH)2↓ (白色)
Zn(OH)2 + 2H+ = Zn2+ + 2 H2O
Zn(OH)2 + 2OH- = Zn(OH)42-
Cd2++2OH-=Cd(OH)2↓白色
Cd(OH)2+H2SO4 = CdSO4 + H2O (沉淀溶解)
Cd(OH)2 + NaOH (6M)= 不反应 (Cd(OH)2碱性)
3、硫化物的生成与性质
铜、银、锌、镉、汞的硫化物的生成(与饱和硫化氢溶液反应)和溶解性(ZnS白色能溶于稀盐酸,CdS黄色溶于浓盐酸,CuS黑色和Ag2S灰色溶于浓硝酸。HgS黑色溶于王水。
3HgS+12Cl-+2NO3-+8H+=3[HgCl4]2-+3S+2NO+4H2O
4、配合物的生成与性质
(1)Ag的配合物
Ag+ + Cl- →AgCl ↓(白)
Ag++ Br- →AgBr ↓(淡黄)
Ag+ + I- →AgI ↓(黄)
AgCl + NH3 = [Ag(NH3)2]+ + Cl- AgCl+ S2O32- →[Ag(S2O3)2]3- + Cl-
AgBr + S2O32- = [Ag(S2O3)2]3- + Br-
(2)Hg的配合物
① Hg2+ + 2I- = HgI2 (红色沉淀)
HgI2+ 2I- = HgI42- (无色溶液)
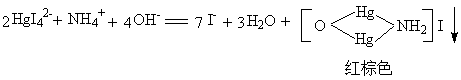 ②
②
③ Hg22++ 2I- = Hg2I2 (黄绿色沉淀)
Hg2I2+ 2I- = HgI42- + Hg(黑色粉末)
5、CuX的生成与性质
(1)CuCl的生成与性质
Cu + Cu2+ + 4Cl- =加热= 2[CuCl2]- 深棕色
[CuCl2]- =稀释=CuCl↓白 + Cl-
注:CuCl2在很浓的溶液中显黄绿色(CuCl4-配离子),浓溶液中显绿色,在稀溶液中显蓝色(Cu(H2O)62+配离子)。
一份:CuCl + 2NH3=2[Cu(NH3)2]+ + Cl-
2[Cu(NH3)2]+ + 4NH3?H2O+1/2O2 = 2[Cu(NH3)4]2++2OH-+3H2O
另一份:CuCl+ Cl-(浓) = [CuCl2]- 深棕色 若稀释又生成沉淀
(2)CuI的生成与性质
Cu2+ + I- = 2CuI↓白 + I2(棕色)
消除I2干扰:I2 + 2 S2O32- = 2I- + S4O62- (注意应严格控制S2O32-的用量)
CuI + I-(饱和) = [CuI2]- 刚好使沉淀溶解,加水稀释时反应逆转又析出CuI。
CuI + KSCN === CuSCN↓(白色或灰白色)+ KI
CuSCN + SCN- === [Cu(SCN)2]- 加水稀释时反应逆转又析出CuSCN。
6、Hg(II)和Hg(I)的转化
Hg2+ + Hg=Hg22+ (注意Hg的取用,回收)
Hg22+ + Cl- = Hg2Cl2↓(白色)
Hg2(NO3)2 + 2 NH3H2O = HgNH2NO3↓(白色) + Hg↓(黑色)+ NH4NO3 + 2H2O
Hg2+和Hg22+与过量氨水反应时,如果没有大量的NH4+存在,并不生成氨配离子
7、离子鉴定
(1)Cu2+离子的鉴定
(弱酸性或中性介质)
2Cu2+ + [Fe(CN)6]4- = Cu2 [Fe(CN)6] ↓ (红棕色沉淀)
Cu2 [Fe(CN)6] +8NH3 = 2[Cu(NH3)4]2++ [Fe(CN)6]4-
(2)Ag+的鉴定
Ag+ + Cl- = AgCl(白色沉淀)
AgCl + 2 NH3H2O = [Ag(NH3)2]Cl + 2H2O
[Ag(NH3)2] Cl + 2HNO3 = AgCl↓+ 2NH4NO3
(3)Zn2+的鉴定
① 中性或弱酸性介质下
Zn2+ + Hg(SCN)42- = Zn[Hg(SCN)4] (白色沉淀)
②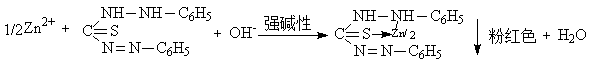 (4)Hg2+的鉴定
(4)Hg2+的鉴定
2HgCl2 + SnCl2 = SnCl4 + Hg2Cl2↓(白色沉淀)
Hg2Cl2 + SnCl2 = SnCl4 +2Hg↓(黑色沉淀)
四、注意事项
1、 本实验涉及的化合物的种类和颜色较多,需仔细观察。
2、 涉及汞的实验毒性较大,做好回收工作。
五、思考题:
1.Cu(I)和Cu(II)稳定存在和转化的条件是什么?
Cu(I)在水溶液中不稳定,Cu2+ 0.158 Cu+ 0.522 Cu,易歧化。在有机溶剂和生成沉淀或某些配合物时可以稳定存在。
Cu2+ + I- = 2CuI↓白 + I2
CuI + I-(饱和) = [CuI2]-
转化:Cu(I)-Cu(II):水中歧化Cu2O+4H+ = Cu2+ + Cu
Cu(II)-Cu(I):加入沉淀剂或配位剂
Cu + Cu2+ + 4Cl- = 2[CuCl2]-
Cu2+ + I- = 2CuI↓白 + I2
2.在AgNO3中加入NaOH为什么得不到AgOH?
AgOH不稳定,易失水变成Ag2O
3.用平衡移动原理说明在Hg2(NO3)2溶液中通入H2S气体会生成什么沉淀?
Hg22+ = Hg2++Hg 歧化反应
加入H2S气体,会发生 Hg2+ + H2S=HgS + 2 H+ Ksp(HgS)=4×10-53 ,会促进歧化反应的进行。
-
无机化学实验报告
湖北工程学院化学与材料科学学院无机化学实验报告20xx实验3p区非金属元素II氮族硅硼何艳仅修改版面格式未修改内容学号012301…
-
无机化学实验报告格式
无机化学实验报告格式无机化学实验一般都被设置成大学一年级的课程对于新入大学的学生要想完成一份满意的实验报告真是有一定的难度另外由于…
- 无机化学实验报告模板新
-
无机化学实验报告
丁明帅丁明帅材料0902班40940400无机化学实验报告实验名称实验十水的总硬度及电导率的测定班级材料0902班日期姓名丁明帅学…
-
无机化学实验报告
实训一化学实验基本操作实验目的1掌握常用量器的洗涤使用及加热溶解等操作2掌握台秤煤气灯酒精喷灯的使用3学会液体剂固体试剂的取用实验…
-
齐齐哈尔大学化工学院化学系专业实验无机化学实验报告三草酸和铁
齐齐哈尔大学实验报告题目:三草酸和铁(Ⅲ)的制备和组成的测定学院:化学与化学工程学院专业班级:化学091学生姓名:张淑贤同组者姓名…
- 无机化学实验报告模板新
- 无机化学实验报告-part1
-
无机化学实验报告格式
无机化学实验报告格式无机化学实验一般都被设置成大学一年级的课程对于新入大学的学生要想完成一份满意的实验报告真是有一定的难度另外由于…
-
无机化学实验报告
湖北工程学院化学与材料科学学院无机化学实验报告20xx实验3p区非金属元素II氮族硅硼何艳仅修改版面格式未修改内容学号012301…
-
19交20xx级化学专业无机化学实验教学大纲
无机化学实验大纲课程编码0411100302课程名称无机化学实验实验总学时数学分752适用专业化学开课教研室无机化学教研室一实验教…