实验七.水硬度的测定(上课)
实验七、水总硬度的测定(配位滴定法)
一、实验目的:
1.了解水的硬度的测定意义和常用表达方法;
2.掌握EDTA法测定水的总硬度的原理和方法;
3.掌握铬黑T的使用及终点颜色变化,了解金属指示剂的特点。
二、实验原理
(一)、水硬度的表示法:
一般所说的水硬度就是指水中钙、镁离子的含量。最常用的表示水硬度的单位有:
1. 以度表示,1o=10 ppm CaO,(mg/L)相当10万份水中含1份CaO。
2. 以水中CaCO3的浓度(ppm)计相当于每升水中含有CaCO3多少毫克。
MCaO—氧化钙的摩尔质量(56.08 g/mol),
MCaCO3—碳酸钙的摩尔质量(100.09 g/mol)。

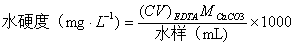
(二)、测定原理:
测定水的总硬度,一般采用配位滴定法即在pH=10的氨性溶液中,以铬黑T作为指示剂,用EDTA标准溶液直接滴定水中的Ca2+、Mg2+,直至溶液由紫红色经紫蓝色转变为蓝色,即为终点。反应如下:
滴定前:EBT + M(Ca2+、Mg2+) = M-EBT
(蓝色) pH=10 (酒红色)
滴定开始至化学计量点前:H2Y2- + Ca2+ = CaY2- + 2H+
H2Y2- + Mg2+ = MgY2- + 2H+
计量点时:H2Y2- + Mg-EBT = MgY2- + EBT +2H+
(酒红色) (蓝色)
滴定时,Fe3+、Al3+等干扰离子用三乙醇胺掩蔽,Cu2+、Pb2+、Zn2+等重金属离子可用KCN、Na2S或巯基乙酸掩蔽。
四、实验内容
 →→
→→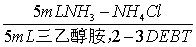 →→
→→ →→溶液由酒红变为蓝色→记下EDTA体积v (平行三次)。注意:接近终点时,要慢滴多摇,以免过终点。
→→溶液由酒红变为蓝色→记下EDTA体积v (平行三次)。注意:接近终点时,要慢滴多摇,以免过终点。
五、实验报告
水硬度的测定:
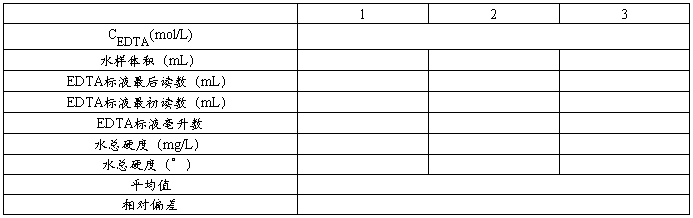
络合滴定的特点:
1、酸度的控制
严格控制溶液的酸度,是成功地进行络合滴定的关键。常用缓冲溶液控制pH值,既有一定的缓冲容量,其浓度又不会超过滴定反应所需的最佳范围。
2、络合滴定干扰大,应掩蔽干扰离子
为了提高络合滴定的选择性,常使用掩蔽剂,其应符合下列条件:a.能与待掩蔽的离子形成址分稳定的络合物。b.该络合物应无色、易溶。c.掩蔽剂的加入对溶液pH不应有明显影响,且其掩蔽能力也不受pH的影响。
3、络合滴定反应速度较慢,滴定速度不宜太快。
思考题:
1.什么叫水的总硬度?怎样计算水的总硬度?
答:水中Ca2+、Mg2+的总量称为水的总硬度。
计算水的总硬度的公式为:
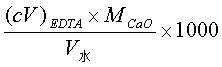 (mg·L-1)
(mg·L-1)
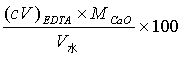 ( o )
( o )
2.为什么滴定Ca2+、Mg2+总量时要控制pH≈10,而滴定Ca2+分量时要控制pH为12~13?若pH>13时测Ca2+对结果有何影响?
答:因为滴定Ca2+、Mg2+总量时要用铬黑T作指示剂,铬黑T在pH为8~11之间为蓝色,与金属离子形成的配合物为紫红色,终点时溶液为蓝色。所以溶液的pH值要控制为10。测定Ca2+时,要将溶液的pH控制至12~13,主要是让Mg2+完全生成Mg(OH)2沉淀。以保证准确测定Ca2+的含量。在pH为12~13时钙指示剂与Ca2+形成酒红色配合物,指示剂本身呈纯蓝色,当滴至终点时溶液为纯蓝色。但pH>13时,指示剂本身为酒红色,而无法确定终点。
3.如果只有铬黑T指示剂,能否测定Ca2+的含量?如何测定?
答:如果只有铬黑T指示剂,首先用NaOH调pH>12,使Mg2+生成沉淀与Ca2+分离,分离Mg2+后的溶液用HCl调pH=10,在加入氨性缓冲溶液。以铬黑T为指示剂,用Mg—EDTA标准溶液滴定Ca2+的含量。
4、加入铬黑T指示剂后,铬黑TIn3-先与Ca2+ 配位,还是与 Mg2+ 配位?EDTA 标准溶液滴定时,EDTA先与Ca2+ 配位,还是与 Mg2+ 配位?
在一份水样中加入 pH=10.0 的氨性缓冲溶液和少许铬黑 T 指示剂,In3-先与Mg2+ 配位,溶液呈红色;用 EDTA 标准溶液滴定时, EDTA 先与游离的 Ca2+ 配位,再与 Mg2+ 配位;在计量点时, EDTA 从 MgIn- 中夺取 Mg2+ ,从而使指示剂游离出来,溶液的颜色由红变为纯蓝,即为终点。
注:当水样中 Mg2+ 极少时,由于 CaIn- 比 MgIn- 的显色灵敏度要差很多,往往得不到敏锐的终点。为了提高终点变色的敏锐性,可在 EDTA 标准溶液中加入适量的 Mg2+ (在 EDTA 标定前加入,这样就不影响 EDTA 与被测离子之间的滴定定量关系),或在缓冲溶液中加入一定量的 Mg—EDTA 盐。 (见实验六思考题)
第二篇:EDTA测定水的硬度
EDTA测定水的硬度
摘要:本文介绍了通过EDTA测定水的硬度的方法。首先选用碳酸钙作为基准物,制成钙标准溶液,选用钙指示剂,以配置好的EDTA标定至溶液由酒红色变为纯蓝色,通过计算得到其准确浓度为0.01044mol?L?1 ,本文分别介绍了测定水的总硬与钙硬的方法,镁硬由总硬减去钙硬即可得到。首先以铬黒T为指示剂,控制溶液的酸度为PH=10,以EDTA滴定水样,实验测得该试样总硬度为11.43。然后选用钙指示剂,以EDTA滴定水样,测得该试样钙硬为9.001,由此,得到镁硬为2.43
关键字:水样 硬度 EDTA 钙硬 镁硬
前言:
乙二胺四乙酸(简称EDTA,常用H4Y表示)难溶于水,常温下其溶解度为0.2g/L(约0.0007mol/L),在分析中通常使用其二钠盐配置标准溶液。乙二胺四乙酸的溶解度为120g·L,可配成 0.3 mol/L以上的溶液,其水溶液的pH≈4.8 ,通常采用间接法配制标准溶液。
标定EDTA溶液常用的基准物有:Zn、ZnO、CaCO3、Bi、Cu、Ni等。通常选用其中与被测组分相同的物质作基准物,这样,滴定条件较一致,可减小误差。本实验EDTA用于测定水样中的钙含量,则宜用CaCO3为基准物。
一般含有钙、镁盐类的水叫硬水,硬度有暂时硬度和永久硬度之分。暂时硬度指水中含有钙、镁的酸式碳酸盐,遇热即成碳酸盐沉淀而失去其硬度。永久硬度指水中含有钙、镁的硫酸盐、氯化物、硝酸盐,在加热时亦不沉淀。
暂硬和永硬的总和称为“总硬”,由镁离子形成的硬度称为“镁硬”,由钙离子形成的硬度称为“钙硬”。
本文采用我国目前最常用的硬度表示方法:以度(°)计,1硬度单位表示十万份水中含一份CaO, -1-1
硬度(?)?cEDTA?VEDTA?
V水MCaO?105
1.实验部分
1.1 仪器及试剂
仪器:50ml酸式滴定管一支、容量瓶(250ml)一只、分析天平、锥形瓶、移液管(25ml)一支、玻塞细口瓶、量筒一支
试剂:乙二胺四乙酸二钠(固体,AR)、CaCO3(固体,AR或GR)、1+1 NH3·H2O、1+1 HCl、
-1钙指示剂、镁溶液、100g·LNaOH 溶液、NH3-NH4Cl 缓冲溶液、铬黒T指示剂
1.2 实验方法
1.2.1 0.01mol/L EDTA溶液的配制
1)计算求得配置500ml 0.01mol/L EDTA溶液所需乙二胺四乙酸二钠的质量,本实验约取2.0g;
2)将量取的乙二胺四乙酸二钠溶解于温水中,倒入玻塞细口瓶中,加入500ml水,充分摇匀,备用。
1.2.2 EDTA溶液的标定
0.01 mol/L标准钙溶液的配制:
1)准确称取已烘干的碳酸钙于小烧杯中(约0.25 g),盖以表面皿,加水润湿从杯嘴边逐滴加入数毫升1+1 HCl至完全溶解,用水把可能溅到表面皿上的溶液淋洗入杯中,加热近沸;
2)待溶液冷却后移入250mL容量瓶内,定容;
标定:
-13)移取25mL标准钙溶液,置于锥形瓶中,加入约25mL水、2mL镁溶液、5mL100g·LNaOH
溶液及约10mg 钙指示剂,摇匀。
4)用正规操作,用EDTA溶液滴定,直至溶液由红色转变为蓝色,且30s内不褪色。记下EDTA溶液耗用量;
5)平行滴定6次,计算EDTA浓度。
1.2.3 样水中硬度的测定
总硬的测定:
1) 取澄清的水样100mL,倒入锥形瓶,加入5mL NH3-NH4Cl 缓冲溶液、0.01g铬黒T固体指示剂;
2) 用正规操作,以EDTA标准溶液滴定,直至溶液由酒红转变为纯蓝,记下EDTA溶液耗用量;
3) 平行滴定至少6次,计算总硬度。
钙硬的测定:
-14) 取澄清的水样100mL,倒入锥形瓶,加入4mL 100g·LNaOH 溶液、0.01g钙指示剂;
5) 用正规操作,以EDTA标准溶液滴定,直至溶液由淡红转变为纯蓝,记下EDTA溶液耗用量;
6) 平行滴定至少6次,计算钙硬度。
2.结果与讨论
2.1 EDTA溶液的标定 表一:EDTA滴定结果表
m(碳酸钙)
/g n(碳酸钙) /mol 初读数/mL 终读数/mL V(EDTA)/mL c(EDTA) /mol·L-1
1 2 3 4 5 6
0.2507
0.03
0.08
0.000250.05
05 0.00
0.08 0.10 24.00 24.10 24.00 24.00 24.10 24.10 23.97 24.02 23.95 24.00 24.02 24.00 0.01045 0.01043 0.01046 0.01044 0.01043 0.01044
2.2.1 EDTA浓度平均值及方差s的计算
??xi
i?1
6
,
?0.01044mol?L?1
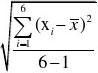
s?
2.1.2 相对标准偏差的计算 计算每组实验的偏差如下:
s?0.00001
表二:EDTA浓度偏差表
平行测定 c(EDTA) 偏差 1 2 3 4 5 6
0.01856 0.01860 0.01858 0.01860 0.01860 0.01862 -0.00003 0.00001 0.00000 0.00000 0.00003
sr?
s
?0.1% 2.1.3 置信区间的计算
通过6组数据,可计算平均值的置信区间。 在置信度为95%时,查表得,
由,
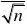
t0.05?,62.45
???t?,f
得,
??(0.01044?0.00001)mol?L?1
即测得的EDTA浓度为??(0.01044?0.00001)mol?L。
?1
2.2 水样的硬度测定
2.2.1 总硬的测定 根据水的硬度计算公式,
硬度(?)?
cEDTA?VEDTA?
V水
MCaO
?105
计算六组水的总硬,
表三:水样总硬度表
1 2 3 4 5
V(水样) 初读数/mL 0.02 0.01 0.00 0.04 0.09
100mL
终读数/mL 19.50 19.55 19.56 19.53 19.60 V(EDTA)水样总硬 /mL /度(°) 19.48 11.40 19.54 11.44 19.56 11.45 19.49 11.41 19.51 11.42
2.2.1.1 水样总硬平均值及方差s的计算
??xi
i?1
5
?
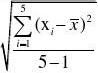
11.43
s?
2.2.1.2 相对标准偏差的计算 计算每组实验的偏差如下:
s?0.02
表四:总硬度偏差表
平行测定
c(EDTA) 偏差 1 11.40 -0.02 2 11.44 0.01 3 11.45 0.03 4 11.41 -0.02 5 11.42 0.00
sr?
s
?0.2% 2.2.1.3 置信区间的计算
通过5组数据,可计算平均值的置信区间。 在置信度为95%时,查表得,
t0.05?,52.57
由,
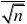
???t?,f
得,
??(11.43?0.02)
即测得的水样总硬度为??(11.43?0.02)。
2.2.2 钙硬的测定 根据水的硬度计算公式,
硬度(?)?
cEDTA?VEDTA?
V水
MCaO
?105
计算六组水的钙硬,
表五:水样钙硬度表
1 2 3 4 5
V(水样) 初读数/mL 0.01 0.02 0.03 0.01 0.02
5
100mL
终读数V(EDTA)水样总硬 /mL /mL /度(°) 15.40 15.39 9.010 15.40 15.38 9.004 15.41 15.38 9.004 15.40 15.39 9.010 15.35 15.33 8.975
2.2.2.1 水样总硬平均值及方差s的计算
??xi
i?1
?
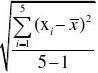
9.001
s?
2.2.2.2 相对标准偏差的计算 计算每组实验的偏差如下:
s?0.015
表六:钙硬偏差表
平行测定 1 2 3 4 5
c(EDTA)
偏差 11.40 -0.02 11.44 0.01 11.45 0.03 11.41 -0.02 11.42 0.00
sr?s?0.16% 2.2.2.3 置信区间的计算
通过5组数据,可计算平均值的置信区间。
在置信度为95%时,查表得,
由,
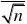
t0.05?,52.57
???t?,f
得,
??(9.001?0.017)
即测得的水样钙硬为??(9.001?0.017)。
2.2.3 镁硬的计算
镁硬=总硬-钙硬
镁硬?2.43
2.3 实验方法的总结与改进
2.3.1 水样中干扰物质的消除
在测定水的总硬实验中,发现某些滴定达到终点时,蓝色会消失,溶液再次变为紫红色,即终点回头。查阅相关资料,发现此现象是由钙、镁盐类的悬浮性颗粒所致,。存在这 种情况,可将水样用盐酸酸化、煮沸,便可除去碱度。冷却后用氢氧化钠溶液中和,再加入缓
[1]冲溶液和指示剂滴定,终点会更加敏锐。
2.3.2 反应时间的影响
在测定水的总硬实验中,有些组为了方便,一次性将缓冲溶液、铬黒T指示剂加入水样中,再逐个滴定,但结果误差颇大。通过查阅资料知,铬黑T易被氧化,在空气中放置后,会使终点不清晰。因此,加入指示剂后反应应尽快进行。但滴定速度也不应过快,以免造成操
[1]作失误。
参考文献
[1] 詹萍 EDTA滴定法测定水中总硬度的几点体会[期刊论文]-中国实用医药2011,06(22)
[2] 四川大学化工学院,浙江大学化学系 《分析化学实验》 高等教育出版社
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
水硬度的测定实验报告
EDTA溶液的配制与标定和水中硬度的测定实验日期年月日处理对象实验内容EDTA溶液的配制与标定和水中硬度的测定实验原理1EDTA标…
-
实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…
-
分析化学实验 水硬度的测定(配位滴定法)
实验二水总硬度的测定配位滴定法实验日期实验目的学习EDTA标准溶液的配制方法及滴定终点的判断掌握钙镁测定的原理方法和计算一水硬度的…
-
浙江远程实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…
-
实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…
-
水硬度的测定实验报告
EDTA溶液的配制与标定和水中硬度的测定实验日期年月日处理对象实验内容EDTA溶液的配制与标定和水中硬度的测定实验原理1EDTA标…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
浙江远程实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…
-
实验五 自来水总硬度的测定 (EDTA的标定)
实验五自来水总硬度的测定EDTA的标定4学时一实验目的1掌握EDTA标准溶液的配制和标定原理了解EDTA的性质和用途2了解水的硬度…
-
分析化学实验 水硬度的测定(配位滴定法)
实验二水总硬度的测定配位滴定法实验日期实验目的学习EDTA标准溶液的配制方法及滴定终点的判断掌握钙镁测定的原理方法和计算一水硬度的…