水硬度测定
水的总硬度的测定
一、实验原理
水的总硬度是指水中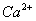 、
、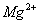 的总量。
的总量。
EDTA和金属指示剂铬黑T 分别与
分别与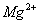 、
、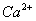 形成络合物,稳定性为
形成络合物,稳定性为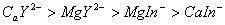 ,当水样中加入少量铬黑T指示剂时,它首先和
,当水样中加入少量铬黑T指示剂时,它首先和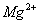 生成红色络合物
生成红色络合物 ,然后与
,然后与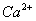 生成红色络合物
生成红色络合物 。
。

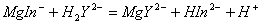
红色 蓝色
二、实验步骤
1.取水样:100mL
2.控制水样的pH值:加入氨性缓冲溶液5mL,控制pH=10
3.加入掩蔽剂:三乙醇胺掩蔽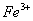 、
、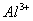 等。
等。
4.滴定:用EDTA标准溶液滴定至溶液由紫红色——蓝色
三、数据记录及数据处理
见实验报告
水的硬度有多种表示方法,常以水中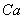 、
、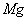 总量换算为
总量换算为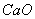 含量的方法表示,以每升水中含10mg
含量的方法表示,以每升水中含10mg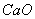 为1度 ( o ),用度来表示水的硬度。即1度=10mg
为1度 ( o ),用度来表示水的硬度。即1度=10mg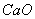 /1L(H2O)。
/1L(H2O)。
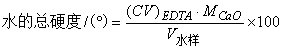
四、钙硬的测定
移取100mL水样于250mL锥形瓶中,加入5mL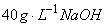 加少许钙指示剂,用EDTA标准溶液滴定至溶液由酒红色变为纯蓝色为终点。
加少许钙指示剂,用EDTA标准溶液滴定至溶液由酒红色变为纯蓝色为终点。
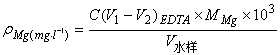
五、注意事项
因水样中的钙、镁含量不高、滴定时,反应速度较慢,故滴定速度要慢。
六、思考题
1.什么叫水的总硬度?怎样计算水的总硬度?
答:水中Ca2+、Mg2+的总量称为水的总硬度。计算水的总硬度的公式为:
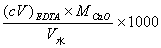 (mg·L-1)
(mg·L-1)
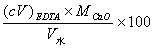 ( o )
( o )
2.为什么滴定Ca2+、Mg2+总量时要控制pH≈10,而滴定Ca2+分量时要控制pH为12~13?若pH>13时测Ca2+对结果有何影响?
答:因为滴定Ca2+、Mg2+总量时要用铬黑T作指示剂,铬黑T在pH为8~11之间为蓝色,与金属离子形成的配合物为紫红色,终点时溶液为蓝色。所以溶液的pH值要控制为10。测定Ca2+时,要将溶液的pH控制至12~13,主要是让Mg2+完全生成Mg(OH)2沉淀。以保证准确测定Ca2+的含量。在pH为12~13间钙指示剂与Ca2+形成酒红色配合物,指示剂本身呈纯蓝色,当滴至终点时溶液为纯蓝色。但pH>13时,指示剂本身为酒红色,而无法确定终点。
3.如果只有铬黑T指示剂,能否测定Ca2+的含量?如何测定?
答:如果只有铬黑T指示剂,首先用NaOH调pH>12,使Mg2+生成沉淀与Ca2+分离,分离Mg2+后的溶液用HCl调pH=10,在加入氨性缓冲溶液。以铬黑T为指示剂,用Mg—EDTA标准溶液滴定Ca2+的含量。
第二篇:水的总硬度的测定


-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
水硬度的测定实验报告
EDTA溶液的配制与标定和水中硬度的测定实验日期年月日处理对象实验内容EDTA溶液的配制与标定和水中硬度的测定实验原理1EDTA标…
-
实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…
-
分析化学实验 水硬度的测定(配位滴定法)
实验二水总硬度的测定配位滴定法实验日期实验目的学习EDTA标准溶液的配制方法及滴定终点的判断掌握钙镁测定的原理方法和计算一水硬度的…
-
浙江远程实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…
-
作风效能建设总结
排水管网管理所加强作风效能建设工作总结根据公司党总支部署和要求,排水管网管理所坚持以邓小平理论和“三个代表”重要思想为指导,以进一…
-
20xx年政策法规工作总结
松桃县农牧科技局20xx年,我局围绕全年工作目标,切实履行政策法规工作职能,深入开展涉农普法宣传、执法监督、政务公开、应急管理和便…
-
火灾隐患排查专项整治工作总结
朱沱镇涨谷初中火灾隐患排查整治工作总结为了进一步改善我校消防安全条件,预防和遏制群死群伤恶性火灾事故发生,根据《重庆市永川区教育委…
-
摄影大赛总结
亚运摄影大赛总结在老师的正确指导下,在学生会及各部门的关心下,通过本部门全体成员的共同努力,由“天空鱼”广告协会与“传播人”新闻协…
-
火灾隐患排查整改工作总结
消防安全整治自查自改工作总结学校安全问题一直是我校最为关注和重视的工作之一,也是各项工作的首要任务。我校在上级教育部门的领导下,在…