实验一 凝固点降低法测定摩尔质量
实验一 凝固点降低法测定摩尔质量
1、 在冷却过程中,凝固点测定管内液体有哪些热交换存在?他们对凝固点的测定有和影响?
答:主要热交换有液相变成固相时放出凝固热;固液与寒剂之间热传导。 对凝固点测定的影响是当凝固热放出速率小于冷却速率,会发出过冷现象,使凝固点测量偏低。
2、 当溶质在溶液中解离、缔合、溶剂化和形成配合物时,测定的结果有何意义?加入溶剂中的溶质的量应如何确定?加入量过多或过少将会有和影响?
答: 当溶质在溶液里有解离、缔合、溶剂化或形成配合物等情况时,缔合和生成配合会使测量值偏大,离解会使测量值偏小,不适用上式计算,一般只适用强电解质稀溶液。
3、加入溶剂中的溶质的量应如何确定?加入量过多或过少将会有和影响?
答:加入的溶质的量约使溶液的凝固点降低0.5℃左右。加入太多,会使溶液太快凝固;加入太少,会使溶液的凝固点降低不明显,测量误差会增大。
4、 估算实验结果的误差,说明影响测量结果的主要因素?
答:溶液过冷程度的控制,冰水浴温度控制在3℃左右,搅拌速度的控制,温度升高快速搅拌,溶剂溶质的精确测量,溶液浓度不能太高都对其有影响。
实验二 纯液体饱和蒸气压的测定
1、压力和温度的测量都有随机误差,试导出H的误差传递表达式.
答:由 H=U+PV 可得, → dH=dU+PdV+VdP
→ dH=(au/aT)v dT+(au/aV)TdV+pdV+Vdp → ΔVHm=(au/aT)VΔT+VΔp
2、 用此装置,可以很方便地研究各种液体,如苯.二氯乙烯.四氯化碳.水.正丙醇.异丙醇.丙酮.和乙醇等,这些液体中很多是易燃的确,在加热时应该注意什么问题?
答:加热时,应该缓慢加热,并且细心控制温度,使溶液的温度不能超过待测液的着火点,同时a,c管的液面上方不宜有空气(或氧气)存在,此外温度变化采用逐渐下降方式。 实验四 燃烧热的测定的测定
1、 固体样品为什么要压成片状?
答:压成片状有利于样品充分燃烧。
2、 在量热测定中,还有哪些情况可能需要用到雷诺温度校正方法?
答:实际上,热量计与周围环境的热交换无法完全避免,它对温差测量值的影响可用雷诺温度校正图校正。
3、 如何用蔗糖的燃烧热数据求其标准生成热。
答:已知蔗糖的燃烧热为△H,设标准生成热为△fHm(C12H22O11)。 C12H22O11 (s)+ 12O2(g)→ 12CO2(g) + 11H2O(l) △H=-Q 故 △fHm(C12H22O11) = 12△fHm(CO2) + 11△fHm(H2O) - △H
实验十 原电池电动势的测定及应用
1、 在用电位差计测量电动势过程中,若检流计的光点总是向一个方向偏转,可能是什么原
因?
答:①工电源电动势偏小
②工作电路出现断路
③待测电路电极反接
2、用Zn(Hg)与Cu组成电池时,有人认为锌表面有汞,因而铜应为负极,汞为正极。请分析此结论是否正确?
答:不正确,因为Zn的电极电势远小于Hg的的电极电势,而Cu的和Hg的电极电势相差不大
3、选择“盐桥”液应注意什么问题? 选择盐桥的原则是什么?
答:①盐桥中的浓度要很高,常用饱和溶液。如饱和KCl溶液、饱和KNO3溶液 ②γ+≈γ-,t+≈t-,且不与电池中的电解质发生反应。
实验十六 旋光法测定蔗糖转化反应的速率常数
1、 本实验中测定旋光仪读数时,旋光仪没有进行零点校正,对反应结果有没有影响? 答:没有影响,因为是旋光度的差值与时间作图。
2、 在混合蔗糖溶液和盐酸溶液时,我们将盐酸加到蔗糖溶液中,可否将蔗糖溶液加到盐酸
溶液中去?为什么?
答:不可以,如果将蔗糖溶液加到HCl溶液中,盐酸会先和蔗糖反应, HCl溶液浓度过大,会加快蔗糖水解,影响测量结果、导致试验结果不准确。
实验二十六 黏度法测定水溶性高聚物相对分子质量
1、 乌氏粘度计中支管C有何作用?除去支管C是否仍可测定粘度?
答:支管C的作用是与大气相通,使得B管中的液体完全是靠重力落下而不受其它因素影响。除去支管C仍可测定粘度,只不过此时标准液体和待测液体体积必须相同,因为此时的液体下流时所受的压力差与A管中液面高度有关。
2、 评价粘度法测定水溶性高聚物相对分子质量的优缺点,适用的相对分子质量范围是多少?
并指出影响准确测定结果的因素。
答:优点,设备简单,操作方便,有较好的实验精度;缺点,实验要求严格,粘度计的干净干燥度、温度等均会带来实验误差;适用的相对分子质量范围为104-107;影响准确测定结果的因素:粘度计的干净干燥度、恒温程度度、溶液的浓度、时间的测定等。
实验二十七 电导法测定水溶性表面活性剂的CMC
1、若要知道所测得的临界胶束是否准确,可用什么实验方法验证之?
答:可以通过其他试验方法测定同温度下的CMC,比较检验该方法测得
的CMC是否准确。如表面张力法或紫外光谱法等。
2、溶解的表面活性剂分子与胶束之间的平衡同温度和浓度有关,其关系式可
表示为:
试问如何测出其热效应值?
答:通过测定不同温度下的临界较束浓度,在绘制dlnCMC~dT曲线即可
求出ΔH。
3. 非离子型表面活性剂能否用本实验方法测定临界胶束浓度?为什么?若不能,则可用何种方法测定?
答:不能,因为本实验时采用电导法测电导与浓度变化关系的转折点来确
定临界胶束浓度,非离子型表面活性剂可导电的离子少,不能用电导法测,可以用表面张力和渗透压法测。
实验七十九 原电池电动势的测定及其应用
(1)在用电位差计测量电动势过程中,若检流计的光点总是向一个方向偏转,可能是什么原因?
答:根据电位差计测量电动势的工作原理图可知检流计的光点总是向一个方向偏转,即电流读数无法回零,可能有以下几个原因:①正负极反接,②工作电源电压不足,③工作回路断路。
(2)用Zn(Hg)与Cu组成电池时,有人认为锌表面有汞,因而铜应为负极,汞为正极。请分析此结论是否正确?
答:不正确。锌汞齐化,能使锌溶解于汞中,或者说锌原子扩散在惰性金属汞中,处于饱和的平衡状态,此时锌的活度仍等于1,因此仍然是锌为负极。
(3)选择“盐桥”液应注意什么问题?
答:选择“盐桥”液应注意以下几个问题:①用作盐桥的电解质正负离子的迁移速率尽可能接近,②用作盐桥的电解质不能与电池中的电解质发生反应,③盐桥中盐的浓度要很高,常用饱和溶液。因此常用饱和KCl溶液作为盐桥,因为K+与Cl-的迁移数相近,当有Ag+时,用KNO3或NH4NO3饱和溶液。
最大泡压法测定溶液的表
1在测量中,如果抽气速率过快,对测量结果有何答:若抽气速度太快,气泡的形成与逸出速度快而不稳定;亦使U型压力计中的酒精所处的位置相对不稳定,来回速度跳动,致使读数不稳定,不易观察出其最高点而
2.如果将毛细管末端插入到溶液内部进行测量行吗?为什么?
答:不行。如果将毛细管末端插入到溶液内部,毛细管内会有一段水柱,产生压力Pˊ,则测定管中的压力Pr会变小,pma会变大,测量结果偏
3. 本实验中为什么要读取最大压力差?
答:如果毛细管半径很小,则形成的气泡基本上是球形的。当气泡开始形成时,表面几乎是平的,这时曲率半径最大;随着气泡的形成,曲率半径逐渐变小,直到形成半球形,这时曲率半径R和毛细管半r相等,曲率半径达最小值,根据拉普拉斯(Laplace)公式,此时能承受的压力差为最大:△pmax = p0 - pr =
2σ/γ。气泡进一步长大,R变大,附加压力则变小,直到气泡逸出。最大压力差可通过数字式微压差测量仪得到。
4. 表面张力仪的清洁与否和温度的不恒定对测量数据在何影响
答:若玻璃器皿不清洁和温度的不恒定,则气泡将会不能连续稳定地流过,而使压差计读数不稳定。温度对σ、G和折射率都有较大的影响。虽然质量百分浓度与温度无关,但由于折射率随温度的波动,若温度不恒定,故难得出未知溶液的准确浓度。
第二篇:实验三 凝固点降低法测定摩尔质量
实验九 凝固点降低法测定摩尔质量
一、目的要求
1、 通过本实验加深对稀溶液依数性质的理解
2、 掌握溶液凝固点的测量技术
3、 用凝固点降低法测定萘的摩尔质量。
二、仪器与试剂
凝固点降低实验装置1套;数字贝克曼温度计、25m1移液管1支;电子天平l台。
分析纯的苯、萘。
三、实验原理
固体溶剂与溶液成平衡的温度称为溶液的凝固点。含非挥发性溶质的双组分稀溶液的凝固点低于纯溶剂的凝固点。凝固点降低是稀溶液依数性质的一种表现。当确定了溶剂的种类和数量后,溶剂凝固点降低值仅取决于所含溶质分子的数目。对于理想溶液,根据相平衡条件,稀溶液的凝固点降低与溶液成分关系由范特霍夫凝固点公式给出
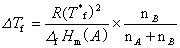
式中: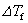 凝固点降低值,Tf* 纯溶剂的凝固点;
凝固点降低值,Tf* 纯溶剂的凝固点;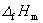 (A)摩尔凝固热,nA和nB分别为溶剂和溶质的物质的量。当溶液浓度很稀时,nB ≤ nA,,则
(A)摩尔凝固热,nA和nB分别为溶剂和溶质的物质的量。当溶液浓度很稀时,nB ≤ nA,,则
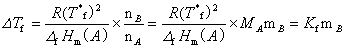
其中MA为溶剂的摩尔质量;mB为溶质的质量摩尔浓度;Kf即称为质量摩尔凝固点降低常数。
若已知某种溶剂的凝固点降低常数 Kf ,并测得溶剂和溶质的质量分别为mA , mB的稀溶液的凝固点降低值DTf,则可通过下式计算溶质的摩尔质量MB。
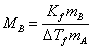
式中Kf的单位为K· kg·mol-1
凝固点降低值的大小,直接反映了溶液中溶质有效质点的数目。如果溶质在溶液中有离解、缔合、溶剂化和配合物生成等情况,这些均影响溶质在溶剂中的表观分子量。因此凝固点降低法也可用来研究溶液的一些性质,例如电解质的电离度、溶质的缔合度、活度和活度系数等。
纯溶剂的凝固点为其液相和固相共存的平衡温度。若将液态的纯溶剂逐步冷却,在未凝固前温度将随时间均匀下降,开始凝固后因放出凝固热而补偿了热损失,体系将保持液一固两相共存的平衡温度而不变,直至全部凝固,温度再继续下降。其冷却曲线如图C6.1中1所示。但实际过程中,当液体温度达到或稍低于其凝固点时,晶体并不析出,这就是所谓的过冷现象。此时若加以搅拌或加入晶种,促使晶核产生,则大量晶体会迅速形成,并放出凝固热,使体系温度迅速回升到稳定的平衡温度;待液体全部凝固后温度再逐渐下降。冷却曲线如图C6.1中。
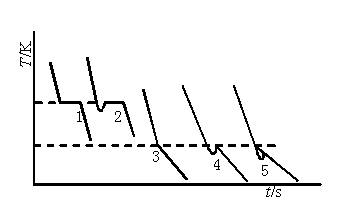
图C6.1 纯溶剂和溶液的冷却曲线
溶液的凝固点是该溶液与溶剂的固相共存的平衡温度,其冷却曲线与纯溶剂不同。当有溶剂凝固析出时,剩余溶液的浓度逐渐增大,因而溶液的凝固点也逐渐下降。因有凝固热放出,冷却曲线的斜率发生变化,即温度的下降速度变慢,如图C6.1中3所示。本实验要测定已知浓度溶液的凝固点。如果溶液过冷程度不大,析出固体溶剂的量很少,对原始溶液浓度影响不大,则以过冷回升的最高温度作为该溶液的凝固点,如图C6.1中4所示。
在测量过程中应该设法控制适当的过冷程度,一般可通过控制寒剂的温度、搅拌速度等方法来达到。
确定凝固点的另一种方法是外推法,如图C6.2所示,首先记录绘制纯溶剂与溶液的冷却曲线,作曲线后面部分(已经有固体析出)的趋势线并延长使其与曲线的前面部分相交,其交点就是凝固点。
四、实验步骤
1、溶剂为苯,测定萘的摩尔质量。
2、先测苯的凝固点,记录在数据记录表格中。
3、苯的凝固点为5.45℃,苯的Kf=5.12 K· kg·mol-1。苯的密度随室温的变化按下式计算:
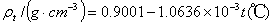
4、称取0.2-0.3克萘。粗称1克,压片,分为四份,每组一份,再用天平精确称量并记录。
5、本实验关键在于搅拌的速度,开始缓慢搅拌,至接近近似凝固点时,改为急速搅拌,温度开始上升时,立即缓慢搅拌,直至温度稳定后读数。
五、数据记录与处理
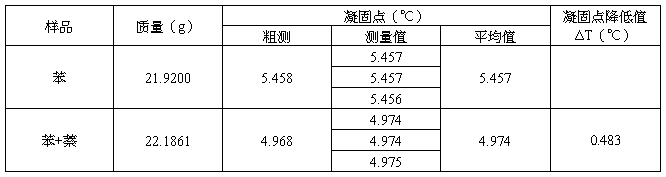
六、实验数据处理:
m苯=21.9200g
m苯+萘=22.1861g
MB=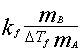 =
=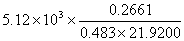 =128.68 g/mol
=128.68 g/mol
七、结论
萘的摩尔质量是128.68g/mol。
-
物化实验报告_凝固点降低法测定摩尔质量
凝固点降低法测定摩尔质量丛乐20xx011007生51实验日期20xx年10月13日星期六提交报告日期20xx年10月27日星期六…
-
实验八 凝固点降低法测定摩尔质量
实验八凝固点降低法测定摩尔质量一实验目的1用凝固点降低法测定萘的摩尔质量2掌握溶液凝固点的测量技术加深对稀溶液依数性质的理解二实验…
-
凝固点降低法测定摩尔质量思考题
凝固点降低法测定摩尔质量预习思考题汇总1为了提高实验的准确度是否可用增加溶质浓度的方法增加值答案不可以溶质加的太多不是稀溶液就不能…
-
凝固点降低法测定摩尔质量。实验报告
凝固点降低法测定摩尔质量一实验目的1用凝固点降低法测定尿素的摩尔质量2掌握固点降低法测摩尔质量的原理3理解绘制冷却曲线并通过冷却曲…
-
凝固点降低法测定摩尔质量
凝固点降低法测定摩尔质量一实验目的1用凝固点降低法测定尿素的摩尔质量2掌握凝固点降低法测摩尔质量的原理3理解绘制冷却曲线并通过冷却…
-
物化实验报告_凝固点降低法测定摩尔质量
凝固点降低法测定摩尔质量丛乐20xx011007生51实验日期20xx年10月13日星期六提交报告日期20xx年10月27日星期六…
-
物化实验报告_凝固点降低法测定摩尔质量[1]
凝固点降低法测定摩尔质量11实验目的12用凝固点降低法测定萘的摩尔质量通过实验掌握溶液凝固点的测量技术并加深对稀溶液艺术性之的理解…
-
实验八 凝固点降低法测定摩尔质量
实验八凝固点降低法测定摩尔质量一实验目的1用凝固点降低法测定萘的摩尔质量2掌握溶液凝固点的测量技术加深对稀溶液依数性质的理解二实验…
-
凝固点降低法测定摩尔质量思考题
凝固点降低法测定摩尔质量预习思考题汇总1为了提高实验的准确度是否可用增加溶质浓度的方法增加值答案不可以溶质加的太多不是稀溶液就不能…
-
凝固点降低法测定摩尔质量。实验报告
凝固点降低法测定摩尔质量一实验目的1用凝固点降低法测定尿素的摩尔质量2掌握固点降低法测摩尔质量的原理3理解绘制冷却曲线并通过冷却曲…