四川理工物化实验--最大泡压法测定溶液表面张力
实验十最大泡压法测定溶液表面张力
报告人: 同组人: 实验时间20##年05月29日
一.实验目的:
1.明确表面张力、表面自由能和吉布斯吸附量的物理意义;
2.掌握最大泡压法测定溶液表面张力的原理和技术;
3.掌握计算表面吸附量和吸附质分子截面积的方法。
二.实验原理:
1.表面张力和表面吸附
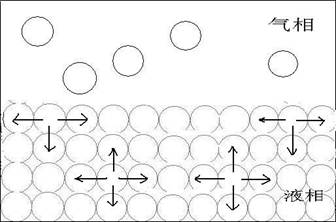 液体表面层的分子一方面受到液体内层的邻近分子的吸引,另一方面受到液面外部气体分子的吸引,由于前者的作用要比后者大,因此在液体表面层中,每个分子都受到垂直于液面并指向液体内部的不平衡力,如图1所示,这种吸引力使表面上的分子自发向内挤促成液体的最小面积,因此,液体表面缩小是一个自发过程。
液体表面层的分子一方面受到液体内层的邻近分子的吸引,另一方面受到液面外部气体分子的吸引,由于前者的作用要比后者大,因此在液体表面层中,每个分子都受到垂直于液面并指向液体内部的不平衡力,如图1所示,这种吸引力使表面上的分子自发向内挤促成液体的最小面积,因此,液体表面缩小是一个自发过程。
在温度、压力、组成恒定时,每增加单位表面积,体系的吉布斯自由能的增值称为表面吉布斯自由能(J·m-2),用γ表示。也可以看作是垂直作用在单位长度相界面上的力,即表面张力(N·m-1)。
欲使液体产生新的表面ΔS,就需对其做表面功,其大小应与ΔS成正比,系数为即为表面张力 γ:
-W =γ×ΔS (1)
图1 液体表面与分子内部受力情况图
在定温下纯液体的表面张力为定值,当加入溶质形成溶液时,分子间的作用力发生变化,表面张力也发生变化,其变化的大小决定于溶质的性质和加入量的多少。水溶液表面张力与其组成的关系大致有以下三种情况:
(1)随溶质浓度增加表面张力略有升高;
(2)随溶质浓度增加表面张力降低,并在开始时降得快些;
(3)溶质浓度低时表面张力就急剧下降,于某一浓度后表面张力几乎不再改变。
以上三种情况溶质在表面层的浓度与体相中的浓度都不相同,这种现象称为溶液表面吸附。根据能量最低原理,溶质能降低溶剂的表面张力时,表面层中溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,它在表面层中的浓度比在内部的浓度低。在指定的温度和压力下,溶质的吸附量与溶液的表面张力及溶液的浓度之间的关系遵守吉布斯(Gibbs)吸附方程:
Γ =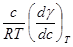 (2)
(2)
式中,Г为溶质在表层的吸附量,单位mol·m2,γ为表面张力,c溶质的浓度。
若 <0,则Γ>0,此时表面层溶质浓度大于本体溶液,称为正吸附。引起溶剂表面张力显著降低的物质叫表面活性剂。
<0,则Γ>0,此时表面层溶质浓度大于本体溶液,称为正吸附。引起溶剂表面张力显著降低的物质叫表面活性剂。
若 >0,则Γ<0,此时表面层溶质浓度小于本体溶液,称为负吸附。
>0,则Γ<0,此时表面层溶质浓度小于本体溶液,称为负吸附。
通过实验测得表面张力与溶质浓度的关系,作出γ-c 曲线,并在此曲线上任取若干点作曲线的切线,这些切线的斜率就是与其相应浓度的 ,将此值代入(2)式便可求出在此浓度时的溶质吸附量Γ。吉布斯吸附等温式应用范围很广,但上述形式仅适用于稀溶液。
,将此值代入(2)式便可求出在此浓度时的溶质吸附量Γ。吉布斯吸附等温式应用范围很广,但上述形式仅适用于稀溶液。
2.最大泡压法测表面张力原理
测定溶液的表面张力有多种方法,较为常用的有最大泡压法其测量方法基本
原理可参见图2。
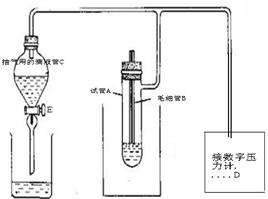
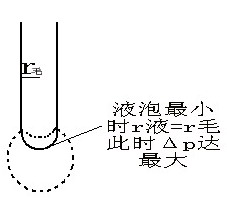
图2 最大抛压法测液体表面张力装置
图中B是管端为毛细管的玻璃管,与液面相切。毛细管中大气压为p0。试管A中气压为p,当打开活塞E时,C中的水流出,体系压力p逐渐减小,逐渐把毛细管液面压至管口,形成气泡。在形成气泡的过程中,液面半径经历:大→小→大,即中间有一极小值rmin=r毛,此时气泡的曲率半径最小,根据拉普拉斯公式,气泡承受的压力差也最大,有公式:

此压力差可由压力计D读出,故待测液的表面张力为
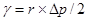 (4)
(4)
若用同一支毛细管测两种不同液体,其表面张力分别为γ1、γ2,压力计测得压力差分别为Δp1、Δp2则:
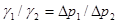 (5)
(5)
若其中一种液体的γ1已知,例如水,则另一种液体的表面张力可由上式求得。即:
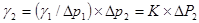
 (6)
(6)
式中 称为仪器常数,可用某种已知表面张力的液体(常用蒸馏水)测得。
称为仪器常数,可用某种已知表面张力的液体(常用蒸馏水)测得。
三.仪器与试剂:
最大泡压法表面张力仪,精密数字压力计,吸耳球,移液管(各种量程),容量瓶 (50mL),正丁醇(分析纯),蒸馏水。
四.实验步骤:
1.仪器准备与检漏
将洁净的表面张力仪各部分连接好。
将自来水注入抽气管C中;在试管A中注入约50mL蒸馏水,使毛细管下端较深地浸入到水中;打开活塞E,这时抽气管C中水流出,使体系内的压力降低(注意:勿降低到使毛细管口冒泡),当压力计指示出若干压力差时,关闭活塞E,停止抽气。若2min~3min内,压力计指示压力差不变,则说明体系不漏气,可以进行实验。
2.仪器常数K的测量
调节毛细管或液面高度,使毛细管口与水面相切。打开活塞E抽气,调节抽气速度,使气泡由毛细管尖端成单泡逸出,且每个气泡形成的时间为为6s~10s。若形成时间太短,则吸附平衡来不及在气泡表面建立起来,测得的表面张力也不能反映该浓度之真正的表面张力值。在形成气泡的过程中,液面半径经历:大→小→大,同时压力差计指示值的绝对值则经历:小→大→小的过程,记录下绝对值最大的压力差,共三次,取其平均值。再由附录中,查出实验温度时水的表面张力γ1,则可以计算仪器常数
3.系列浓度正丁醇水溶液表面张力的测定
配制50mL浓度为0.05、0.10、0.15、0.20、0.25、0.30 mol·L-1的系列正丁醇溶液,与测仪器常数相同的方法,按由稀到浓的顺序测定各溶液最大压力差,求出各溶液的表面张力γ。
测定管每次应用待测液淌洗一次。
五.数据处理:
数据记录参考格式(计算时注意单位换算)
温度: 24℃ 水的表面张力:0.07218N/m 仪器常数K:0.1104
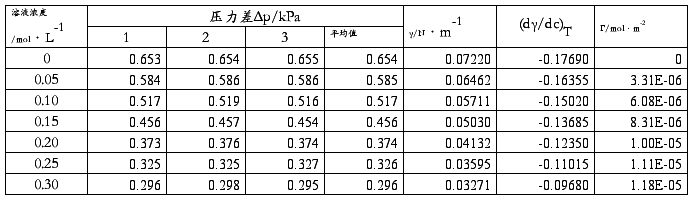
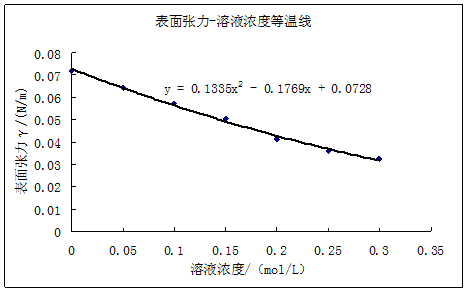
1.查出实验温度下水的表面张力,计算仪器常数K。
2.计算系列正丁醇溶液的表面张力,根据上述计算结果,绘制γ—c等温线。
3.由γ-c等温线作不同浓度的切线,求(dγ/dc)T,并求出Г,绘制Г—c吸附等温线。

六.注意事项:
1.所用毛细管必须干净、干燥,应保持垂直,其管口刚好与液面相切。
2.读取压力计的压差时,应取气泡单个逸出时的最大压力差。
3.手动做切线时,可用镜面法。
七.思考题:
1.毛细管尖端为何必须调节得恰与液面相切? 如果毛细管端口插入液面有一定深度,对实验数据有何影响?
答:如果将毛细管末端插入到溶液内部,毛细管内会有一段水柱,产生压力Pˊ,则测定管中的压力Pr会变小,△pmax会变大,测量结果偏大。
2.最大泡压法测定表面张力时为什么要读最大压力差?如果气泡逸出的很快,或几个气泡一齐出,对实验结果有无影响?
答:如果毛细管半径很小,则形成的气泡基本上是球形的。当气泡开始形成时,表面几乎是平的,这时曲率半径最大;随着气泡的形成,曲率半径逐渐变小,直到形成半球形,这时曲率半径R和毛细管半径r相等,曲率半径达最小值,根据拉普拉斯(Laplace)公式,此时能承受的压力差为最大:△pmax = p0 - pr = 2σ/γ。气泡进一步长大,R变大,附加压力则变小,直到气泡逸出。最大压力差可通过数字式微压差测量仪得到。
如气泡逸出速度速度太快,气泡的形成与逸出速度快而不稳定;致使压力计的读数不稳定,不易观察出其最高点而起到较大的误差。
3.本实验为何要测定仪器常数?仪器常数与温度有关系吗?
答:因为用同一支毛细管测两种不同液体,其表面张力为γ1,γ2,压力计测得压力差分别为 △P1,△P2,则 γ1/γ2=△P1/△P2 , 若其中一液体γ1已知,则γ2=K×△P2其中K=γ1/△P1,试验中测得水的表面张力γ1,就能求出系列正丁醇的表面张力。
温度越高,仪器常数就越小。
第二篇:四川理工物化实验-__液体饱和蒸汽压的测定
实验名称:液体饱和蒸汽压的测定
报告人: 同组人: 实验时间20##年03月25日
一.实验目的:
1.明确液体饱和蒸汽压的意义,熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯-克拉贝农方程。
2.了解静态法测定液体饱和蒸汽压的原理。
3.学习用图解法求解被测液体在试验温度范围内的平均摩尔蒸发焓与正常沸点。
二.实验原理:
饱和蒸气压:在真空容器中,液体与其蒸气建立动态平衡时(蒸气分子向液面凝结和液体分子从表面逃逸的速率相等)液面上的蒸气压力为饱和蒸气压。温度升高,分子运动加剧,单位时间内从液面逸出的分子数增多,所以蒸气压增大。饱和蒸气压与温度的关系服从克劳休斯-克拉贝农方程:

液体蒸发时要吸收热量,温度T下,1 mol液体蒸发所吸收的热量为该物质的摩尔气化焓。沸点:蒸气压等于外压的温度。显然液体沸点随外压而变,101.325kPa下液体的沸点称正常沸点。
式中各量……。
对包括气相的纯物质两相平衡系统,因Vm(g)?Vm(l),故 △Vm≈Vm(g)。若气体视理想气体,则克劳休斯-克拉贝农方程式为:

因温度范围小时,ΔvapH*m可以近似作为常数,将上式积分得:
 作
作 ~1/T图,得一直线,斜率为
~1/T图,得一直线,斜率为 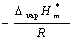
 由斜率可求算液体的ΔvapH*m。
由斜率可求算液体的ΔvapH*m。
本实验采用静态法测量( 装置如图A)。平衡管如图B,待测物质置于球管A内,U型管中夜放置被测物质,将平衡管和抽气系统、压力计连接,在一定温度下,当U形管中的液面在同一水平时,记下此时的温度和压力,则压力计示值就是该液体的饱和蒸汽压。
装置如图A)。平衡管如图B,待测物质置于球管A内,U型管中夜放置被测物质,将平衡管和抽气系统、压力计连接,在一定温度下,当U形管中的液面在同一水平时,记下此时的温度和压力,则压力计示值就是该液体的饱和蒸汽压。
三.实验仪器和试剂:
仪器:恒温水浴;平衡管,温度计,冷凝管,数字式低真空测压仪,真空泵及附件。
试剂:无水乙醇,
四. 实验步骤
1、从气压计读取大气压,并记录。
2、装样:从加样口加无水乙醇,并在U型管内装入一定体积的无水乙醇。
打开数字压力计电源开关,预热5 min。使饱和蒸汽压测定教学试验仪通大气,按下“清零”键。
3、检查系统是否漏气。将进气阀、阀2打开,阀1关闭。抽气减压至压力计显示压差为-80KPa时关闭进气阀和阀2,如压力计示数能在3-5min内维持不变,则系统不漏气。
4、打开阀1,恒温槽温度调至比次大气压下待测液沸点高3-5℃,如此沸腾3-5min,停止加热,关闭阀1
5、当b、c两管的液面到达同一水平面时,立即记录此时的温度和压力,并打开阀2,使测量系统的压力减小5-7kPa,液体将重新沸腾,又有气泡从平衡管冒出,关闭阀2,继续降低水温。当温度降到一定程度时,B,C液面又处于同一水平面,记录此时的温度计压力计读数。
注:每次使系统减压5-7kpa,重复上述操作,测至少5组数据。
实验结束后,先将系统排空,然后关闭真空泵。
五.实验结果与数据处理:
被测液体:无水乙醇 室温 :28℃ 大气压:98.44kPa

△vapHm=6210.3×R×10-3=51.63KJ
-
最大泡压法测定溶液的表面张力实验报告
物理化学实验报告20xx年02月21日总评姓名学校陕西师范大学年级20xx级专业材料化学室温100大气压100kpa一实验名称最大…
-
最大泡压法测定溶液表面张力。实验报告
最大泡压法测定溶液表面张力一实验目的1明确表面张力表面自由能和吉布斯吸附量的物理意义2掌握最大泡压法测定溶液表面张力的原理和技术3…
-
最大泡压法测定溶液表面张力实验报告
最大泡压法测定溶液表面张力实验报告一实验目的1明确表面张力表面自由能和吉布斯吸附量的物理意义2掌握最大泡压法测定溶液表面张力的原理…
-
最大泡压法测定溶液的表面张力
溶液表面张力的测定一实验目的1掌握最大气泡压力法测定溶液表面张力的原理和技术2测定不同浓度乙醇溶液的表面张力计算吸附量3了解气液界…
-
最大泡压法测定溶液的表面张力实验报告.doc1
物理化学实验报告最大泡压法测定溶液的表面张力学院化学化工学院班级应用化学姓名袁玲博学号20xx50520xx一实验目的1了解表面自…
-
物化实验报告6-最大气泡压力法测定溶液的表面张力
一实验目的1掌握最大气泡压力法测定表面张力的原理和技术2通过对不同浓度乙醇溶液表面张力的测定加深对表面张力表面自由能表面张力和吸附…
-
最大气泡法测表面张力实验报告
最大气泡法测定溶液的表面张力实验目的1掌握最大泡压法测定表面张力的原理了解影响表面张力测定的因素2了解弯曲液面下产生附加压力的本质…
-
溶液表面张力测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称溶液表面张力的测定应用化学二班班级03组号实验人姓名xx同组人姓名xxxx…
-
最大泡压法测定溶液的表面张力
华南师范大学实验报告学生姓名学号专业化学师范年级班级10化5课程名称应用物理化学实验实验项目最大泡压法测定溶液的表面张力实验类型验…
-
最大泡压法测定溶液表面张力。实验报告
最大泡压法测定溶液表面张力一实验目的1明确表面张力表面自由能和吉布斯吸附量的物理意义2掌握最大泡压法测定溶液表面张力的原理和技术3…
-
最大泡压法测定溶液的表面张力实验报告
物理化学实验报告20xx年02月21日总评姓名学校陕西师范大学年级20xx级专业材料化学室温100大气压100kpa一实验名称最大…