烃类性质及环己烯的制备
实验五 烃类性质及环己烯的制备
(一) 烃类性质
课时数:4学时
教学目标:
通过本项目学习使学生验证理论课上学到的烷、烯、炔和芳烃的化学性质,并掌握用化学的方法来鉴别烃类。
教学内容:
一、实验目的:
1、通过实验来验证烷、烯、炔和芳烃的化学性质。
2、掌握鉴别烃类的化学方法
二、实验原理及内容:
(一)烷烃的性质
烷烃是饱和的碳氢化合物,含有牢固的σ键,一般情况下化学性质比较稳定。但烷烃和氯或溴在强光的照射或高温的影响下,可以发生卤代反应,与氟则直接起反应,与碘通常不起反应。室温下,烷烃一般不与氧化剂(如高锰酸钾、臭氧等)反应,也不与空气中的氧反应。
1、溴代反应:光照下石蜡与溴起卤代反应,试管口观察到白雾为HBr+H2O。
2、氧化反应:石蜡与高锰酸钾不反应,溶液颜色不变。
(二)烯烃的性质
烯烃分子含有双键,一个σ键,一个π键,由于π键容易被极化和断裂,故能发生加成、氧化反应。
1、 加成反应:环己烯中逐滴加入3%Br2/CCl4 ,不断褪色。可用来检验不饱和脂肪烃。
2、 氧化反应:可用来检验不饱和脂肪烃。烯烃在中性或碱性条件下逐滴加入2%KMnO4,紫 红色褪去,生成黑褐色MnO2沉淀;在酸性条件下,KMnO4还原到Mn2+,紫红色褪去,无沉淀生成。若只开始几滴KMnO4能褪色,可能是样品中少量杂质导致,不能认为是阳性反应。
(三)炔烃的性质
炔烃分子含有叁键,一个σ键,两个π键,易打开π键发生加成、氧化反应。另外,当炔烃中含有炔氢(炔烃分子中与碳碳叁键碳原子直接相连的氢原子)时,由于炔烃具有弱酸性,能被某些金属或金属离子取代生成金属炔化物。
1、 加成反应:乙炔与溴的加成反应比烯烃慢。
2、 氧化反应:乙炔与KMnO4反应,中性或弱碱性条件下,有黑褐色MnO2沉淀生成;酸性条 件下则还原到Mn2+,紫红色褪去,无沉淀生成。
3、 炔氢反应:先作乙炔银实验,再作乙炔亚铜实验,以免通入乙炔时,红色的乙炔亚铜沉淀 污染白色乙炔银,影响颜色观察。若乙炔银稍带黄色,是因为乙炔中含有硫、磷等杂质。可用于检验乙炔和末端炔烃的存在。
(四)芳香烃的性质
芳香烃具有芳香性,由于苯环具有特殊的稳定性,一般情况下难发生加成和氧化反应,但容易发生环上取代反应,例如卤代、硝化、磺化反应,且取代产物仍保持苯环结构。如果含有侧链,且与苯环相连的碳原子上含有α-H,则侧链易被强氧化剂(如高锰酸钾、重铬酸钾等)氧化成羧酸。
1、 溴代反应:试管要干燥。在没有催化剂存在下,苯不发生卤代反应,但甲苯在光照或加热 下,能发生侧链上的卤代反应。苯和甲苯在铁催化下、55-60℃水浴中,发生环上溴代反应,颜色褪去,且甲苯比苯反应更容易发生;在水浴加热过程中可能观察到试管内颜色加深,这可能是因为 11
苯环与溴之间形成σ-络合物,加热一段时间后拿出来加点水,络合物分解,可以看到颜色褪去,且沉到试管底的溴化产物的量是甲苯比苯多,由此可以判断甲苯反应比苯快。
2、 硝化反应:试管要干燥。甲苯反应比苯快。苯(甲苯)硝化反应,放50-60℃水浴中加热 一段时间,产物为黄色油状液体,密度大于水,若苯(甲苯)较多没有反应掉,与硝基苯(对(邻)硝基甲苯)互溶,可能导致黄色油状液体浮与水上。萘具有芳香性,比苯容易发生亲电取代反应。硝化产物为黄色固体,密度也大于水,试管内红棕色气体为硝酸分解产生的二氧化氮。
3、 氧化反应:苯不被氧化。甲苯侧链能被氧化。萘比苯容易被氧化。
(五)未知样品的鉴定:先把现象明显、容易鉴别的先鉴别出来。用表格形式记录鉴别过程和现象。未知物为:环己烯、环己烷、甲苯、苯。
可先加溴的四氯化碳溶液,环己烯马上褪色。再在其余三个样品中加酸化高锰酸钾,甲苯被氧化褪色。然后在剩余两个样品中,加溴后红外光照一段时间,褪色的为环己烷。
三、实验注意点:
1、 苯、甲苯及其取代产物回收于废液瓶,不要倒入水槽。
2、 滴管专用,防止药品污染。
3、 与乙炔钢瓶相连的CaSO4作用是除硫、磷等杂质。
4、 用滴管滴加时,要注意滴管口不能和试管壁碰到。
(二)环己烯的制备
课时数:4学时
教学基本要求:
通过本项目学习使学生学会用浓硫酸催化环已醇脱水制备环已烯的原理和方法,初步掌握分馏、水浴蒸馏、分液等基本操作技能。
教学内容:
一、实验目的:
1、 学习环已醇在浓硫酸催化下脱水制备环已烯的原理和方法。
2、 初步掌握分馏、水浴蒸馏、分液、干燥等基本操作技能。
3、 掌握产率计算方法。
二、实验原理:
OH +H2O 浓磷酸(或浓硫酸)做脱水剂
三、反应装置:
P13 图1-11
四、实验重点:
1、 学习用浓硫酸催化环已醇脱水制备环已烯的原理和方法。
2、 水浴蒸馏(P37):蒸馏是分离和提纯液体有机化合物最常用的方法之一。
①仪器组装:
(a)要规范:组装仪器应按电炉、蒸馏瓶、蒸馏头、温度计、冷凝管、尾接管、接受瓶的次序从下到上、从左到右安装,要端正,横的平行,竖的垂直。电炉和接收瓶只允许垫高其中一端。
(b)温度计高度:为水银球上沿与蒸馏头支管下沿平,太低读数会偏高,太高则水银球不能被蒸气全部浸没,则偏低。
(c)冷凝管:应套好乳胶管、用铁架台夹好后再往蒸馏头上套。冷凝管下端进水,上端出水,这 12
样蒸气和冷凝水逆流能提高冷却效果。
(d)整套装置各仪器间的连接要紧密不漏气,但尾接管一定要通大气,以免发生爆炸。同一实验台上的蒸馏装置应“头对头”或“尾对尾”安装,以免一台装置的尾气放空处距另一台装置的火源太近而发生危险。
②加热蒸馏:加热蒸馏前先加沸石(形成气化中心,防止爆沸)、通冷凝水,如中途停止又继续蒸馏必须补加新的沸石(冷却后,沸石的气孔都被溶剂充满,失去气化作用)。记录第一滴馏出液从接引管滴下的温度。蒸馏速度控制在1-2d/s。收集所需温度范围的馏出液。达到沸点之前,常有低沸点的液体先蒸出,这部分馏出液为前馏分,应弃去,在不断蒸馏的情况下更换接受瓶。
③蒸馏结束:维持原来的加热程度,不再有馏出液蒸出而温度又突然下降,可停止蒸馏,即使杂质量很少,也不能蒸干,以免发生意外。蒸馏完毕,先停止加热,再停止通水,拿下接收瓶,再拆装置,拆卸仪器顺序与安装时相反。
3、 简单分馏(P41):用于分离沸点相近的混合物(蒸馏只能分离沸点相差30℃以上的组分)。 简单分馏装置比简单蒸馏装置在蒸馏瓶和蒸馏头之间多一个刺形分馏柱,操作和简单蒸馏类似。开始用小火加热至沸,以使受热均匀,防止过热。液体沸腾后,调节加热速度,使蒸气慢慢进入分馏柱,约10分钟到达柱顶。记录第一滴馏出液滴落到接受瓶的温度。控制馏出速度在1d/2-3s。
4、分液漏斗的使用和保管:
①使用前应涂凡士林、检漏:在旋塞孔的两侧薄薄地涂上一层凡士林,小心塞进旋塞,来回旋转数次至均匀透明。用水检漏。然后套上橡皮圈或绑上橡皮筋,以防旋塞脱出,放在铁圈上待用。
②掌握振荡操作:振荡动作示范。振荡后注意放气,若该有机溶剂沸点低或是用碳酸钠洗酸性溶液,更要注意及时旋开旋塞放气,否则气体会把活塞顶出去。振荡数次后放铁圈上静置分层。
③分液:分离时,先把顶上盖子打开通大气,下层从旋塞放出,上层从上口倒出。放下层时,先快后慢,当两液面界限接近旋塞时,先关闭旋塞稍加振荡旋转,再静置,使粘附在漏斗壁的液体下沉。下层液体常会增多,再放出。且下端玻璃管要靠住烧杯壁。
④保管:用过后拔出旋塞,洗净,擦干,包上纸片保管。
5、液体有机化合物的干燥:
①干燥剂的选择:
(a)不与待干燥液态有机物发生化学反应。
(b)不溶于该液态有机物
(c)干燥速度快,吸水量大、价格便宜。
②常用干燥剂:
干燥剂主要有两类:一类与水结合生成水合物(如CaCl2);一类与水发生化学反应(如Na)。实
验室常用的有:
(a)无水CaCl2:能形成CaCl2·6H2O,1g可吸水0.97g。不能用于干燥醇、酚、胺、醛、酮 酯等,会形成络合物。CaO可用来干燥醇类。
(b)无水MgSO4:形成MgSO4·nH2O,n=1-7,吸水容量为1.05。可代替氯化钙。可干燥醛、酮、酸、酯、酰胺等。
(c)无水K2CO3:形成K2CO3·2H2O吸水容量0.2,可代替无水硫酸镁。
③干燥剂用量:一般每10ml液体需0.5-1g干燥剂。用量不足则不能达到干燥目的,用量太多则由于干燥剂的吸附造成液体的损失。
④操作:一般在干燥锥瓶中进行,投入干燥剂后塞上塞子,振荡片刻后静置,如出现干燥剂附着
器壁或粘结,需再添加干燥剂,如果出现水相,用吸管吸出水,再添加新干燥剂。干燥后液体变成澄清。干燥结束过滤转移时,可用塞有少量脱脂棉的漏斗进行,以防干燥剂倒出。
13
5、产率计算(P89):产率=(实际产量/理论产量)×100% 。理论产量的计算要列出反应式,如果有两种反应物,还要进行过量判断。
五、实验注意点:
01、加料:①环己醇mp 24C,在较低温度下为针状晶体,熔化时为粘稠液体,用量筒量取时不
易倒净。因此可用称量法。②若用硫酸,环己醇与之应充分混合,以免加热过程局部炭化。
2、分馏:环己烯与水形成共沸物沸点70.8C,与环己醇的共沸物沸点64.9C,环己醇与水的共沸物沸点97.80C,为减少未反应的环己醇蒸出,控制温度不要超过900C,蒸馏速度约为1d/2-3s。在收集和转移环己烯时,要充分冷却,以减少挥发损失。
3、分液、干燥:水层要分离完全,干燥要完全(可除水和环己醇),否则水浴蒸馏时会形成共00沸物,产物纯度不高。
4、 水浴蒸馏:所有仪器需干燥。
14
第二篇:环己烯的制备
环己烯的制备
一、实验目的
1、学习、掌握由环己醇制备环己烯的原理及方法。
2、了解分馏的原理及实验操作。
3、练习并掌握蒸馏、分液、干燥等实验操作方法。
二、实验原理
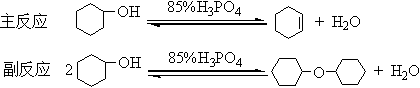
主反应为可逆反应,本实验采用的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物(沸点70.8℃,含水10%)。但是原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过90℃。
反应采用85%的磷酸为催化剂,而不用浓硫酸作催化剂,是因为磷酸氧化能力较硫酸弱得多,减少了氧化副反应。
分馏的原理就是让上升的蒸汽和下降的冷凝液在分馏柱中进行多次热交换,相当于在分馏柱中进行多次蒸馏,从而使低沸点的物质不断上升、被蒸出;高沸点的物质不断地被冷凝、下降、流回加热容器中;结果将沸点不同的物质分离。详细的原理参见P88-89。
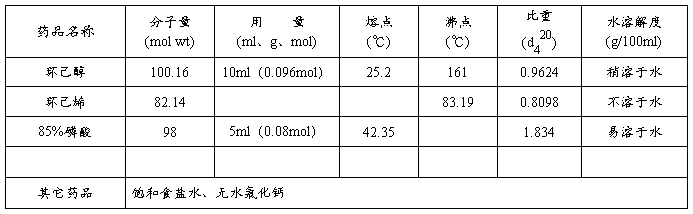
三、实验药品及物理常数
四、实验装置图
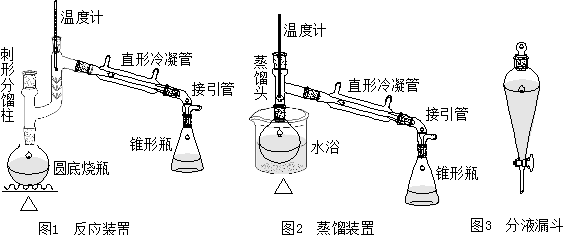
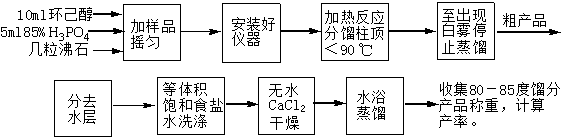
五、实验流程图
六、实验步骤
在50毫升干燥的圆底(或茄形)烧瓶中,放入10ml环己醇(9.6g,0.096mol)、5ml85%磷酸,充分振摇、混合均匀。投入几粒沸石,按图1安装反应装置,用锥形瓶作接受器。
将烧瓶在石棉网上用小火慢慢加热,控制加热速度使分馏柱上端的温度不要超过90℃,馏出液为带水的混合物。当烧瓶中只剩下很少量的残液并出现阵阵白雾时,即可停止蒸馏。全部蒸馏时间约需40min。
将蒸馏液分去水层,加入等体积的饱和食盐水,充分振摇后静止分层,分去水层(洗涤微量的酸,产品在哪一层?)。将下层水溶液自漏斗下端活塞放出、上层的粗产物自漏斗的上口倒入干燥的小锥形瓶中,加入1-2克无水氯化钙干燥。
将干燥后的产物滤入干燥的梨形蒸馏瓶中,加入几粒沸石,用水浴加热蒸馏。收集80-85℃的馏分于一已称重的干燥小锥形瓶中。产量4-5g。
本实验约需4h。
七、注意事项
1、环己醇在常温下是粘碉状液体,因而若用量筒量取时应注意转移中的损失。所以,取样时,最好先取环己醇,后取磷酸。
2、环己醇与磷酸应充分混合,否则在加热过程中可能会局部碳化,使溶液变黑。
3、安装仪器的顺序是从下到上,从左到右。十字头应口向上。
4、由于反应中环己烯与水形成共沸物(沸点70.8℃,含水l0%);环己醇也能与水形成共沸物(沸点97.8℃,含水80%)。因比在加热时温度不可过高,蒸馏速度不宜太快,以减少末作用的环己醇蒸出。文献要求柱顶控制在73℃左右,但反应速度太慢。本实验为了加快蒸出的速度,可控制在90℃以下。
5、反应终点的判断可参考以下几个参数:(1)反应进行40min左右。(2)分馏出的环己烯和水的共沸物达到理论计算量。(3)反应烧瓶中出现白雾。(4)柱顶温度下降后又升到85℃以上。
6、洗涤分水时,水层应尽可能分离完全,否则将增加无水氯化钙的用量,使产物更多地被干燥剂吸附而招致损失。这里用无水氯化钙干燥较适合,因它还可除去少量环己醇。无水氯化钙的用量视粗产品中的含水量而定,一般干燥时间应在半个小时以上,最好干燥过夜。但由于时间关系,实际实验过程中,可能干燥时间不够,这样在最后蒸馏时,可能会有较多的前馏分(环己烯和水的共沸物)蒸出。
7、在蒸馏已干燥的产物时,蒸馏所用仪器都应充分干燥。接收产品的三角瓶应事先称重。
8、一般蒸馏都要加沸石。
9、进实验室前,一定要事先查好原料、产品及副产品的物理常数,做到心中有数。
八、教学法
1、有条件的实验室,在用分馏装置进行实验时,可让学生分成几个小组,分别控制柱顶温度为71℃、85℃、93℃进行操作,然后用色谱法分析粗产物的组成,各组间交流实验结果,总结出严格控制反应条件的重要性。
2、正确理解共沸物概念及其在有机化学实验中的应用。
3、教学过程中,结合反应装置的选择,反应条件的控制,产物分离方法的选择等,强调在实验前查反应物、中间产物、产物、副产物的物理化学常数的重要性。养成实验前查物性常数的习惯,培养查阅手册的能力。
九、思考题
1、 在纯化环己烯时,用等体积的饱和食盐水洗涤,而不用水洗涤,目的何在?
答:在纯化有机物时,常用饱和食盐水洗涤,而不用水直接洗涤是利用其盐析效应,可降低有机物在水中的溶解度,并能加快水、油的分层。
2、 本实验提高产率的措施是什么?
答:本实验主反应为可逆反应,提高反应采取的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物,并控制柱顶温度不超过90℃。
3、 实验中,为什么要控制柱顶温度不超过90℃?
答:由于环己烯和水形成的二元共沸物(含水10%)沸点是70.8℃,而原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过90℃。
4、 本实验用磷酸作催化剂比用硫酸作催化剂好在哪里?
答:采用硫酸作催化剂虽然反应速度较快,但由于硫酸的氧化性比磷酸强,反应时部分原料会被氧化、甚至碳化,使溶液颜色加深,产率有所降低。此外,反应时会有少量SO2气化放出。在纯化时,需要碱洗,增加了纯化步骤。
5、蒸馏时,加入沸石的目的是什么?
答:沸石就是未上釉的瓷片敲碎而成的小粒。它上面有很多毛细孔,当液体加热时,能产生细小的气泡,成为沸腾中心。这样可以防止液体加热时产生过热现象,防止暴沸,使沸腾保持平稳。
一般加热回流、蒸馏、分馏、水蒸汽发生器产生水蒸汽都需要加沸石。但减压蒸馏、水蒸气蒸馏、电动搅拌反应不需要加沸石。
在一次持续蒸馏时,沸石一直有效;一旦中途停止沸腾或蒸馏,原有沸石即失效,再次加热蒸馏时,应补加新沸石。如果事先忘了加沸石,决不能在液体加热到沸腾时补加。因为这样会引起剧烈暴沸,使液体冲出瓶外,还容易发生着火事故。故应该在冷却一段时间后再补加。
6、使用分液漏斗有哪些注意事项?
答:使用分液漏斗洗涤和萃取时,有以下注意事项:
(1)分液漏斗在长期放置时,为防止盖子的旋塞粘接在一起,一般都衬有一层纸。使用前,要先去掉衬纸,检查盖子和旋塞是否漏水。如果漏水,应涂凡士林后,再检验,直到不漏才能用。涂凡士林时,应在旋塞上涂薄薄一层,插上旋转几周;但孔的周围不能涂,以免堵塞孔洞。
(2)萃取时要充分振摇,注意正确的操作姿势和方法。
(3)振摇时,往往会有气体产生,要及时放气。
(4)分液时,下层液体应从旋塞放出,上层液体应从上口倒出。
(5)分液时,先把顶上的盖子打开,或旋转盖子,使盖子上的凹缝或小孔对准漏斗上口颈部的小孔,以便与大气相通。
(6)在萃取和分液时,上下两层液体都应该保留到实验完毕。以防止操作失误时,能够补救。
(7)分液漏斗用毕,要洗净,将盖子和旋塞分别用纸条衬好。
7、用无水氯化钙干燥有哪些注意事项?
答:(1)一般要在干燥的小锥形瓶中进行干燥。
(2)一般用块状的无水氯化钙进行干燥,便于后面的分离。
(3)用无水氯化钙干燥的时间一般要在半个小时以上,并不时摇动。但实际实验中,由于时间关系,只能干燥5-10分钟。因此,水是没有除净的,在最后蒸馏时,会有较多的前馏分(环己烯和水的共沸物)蒸出。
8、查药品物理常数的途径有哪些?
答:在进行或设计一个有机合成实验之前,必须首先弄清楚反应物料和生成物的物理常数,这样在反应、分离纯化时,才能设计出合理的工艺路线,操作时才能做到心中有数。通常查找物理常数有四个途径:
(1)在教材书中,每一章的物理性质都列出了一些常见化合物的物理常数。另外,在多数实验教材书的附表中,也列有一些常见溶剂和物料物理常数。
(2)在图书馆中,查阅相关的手册。主要查阅有机化合物手册、有机合成手册、化学手册、物理化学手册等。
(3)在网上查找,有些网站和化学品电子手册专门提供物理常数。
(4)在实验室的试剂瓶上,一般都列有主要物理性质的常数。
-
环己烯的制备 实验报告
聊城大学化学化工学院元险实验八环己烯的制备一实验目的1学习以浓磷酸催化环己醇脱水制备环己烯的原理和方法2巩固分馏操作3学习洗涤干燥…
-
环己烯的制备实验报告
20xx年5月31日姓名聂虎学院化学与化工学院班级20xx级化工班科目基础化学实验题目环己烯的制备仪器编号22同组者洋洋实验二十六…
-
环己烯的制备实验报告
环己烯的制备实验报告一实验目的利用环己醇以及其他相关的化学试剂来进行化学反应制备环己烯二实验原理化学反应式反应历程可能的副反应主要…
-
环己烯的制备实验报告
20xx年5月31日姓名聂虎学院化学与化工学院班级20xx级化工班科目基础化学实验题目环己烯的制备仪器编号22同组者洋洋实验二十六…
-
环己烯的制备实验预习报告
实验八环己烯的制备一实验目的1学习掌握由环己醇制备环己烯的原理及方法2了解分馏的原理及实验操作3练习并掌握蒸馏分液干燥等实验操作方…
-
过秦论知识点总结
《过秦论》知识点总结整理人:王春光一.生字词:⑴崤函(xiáo).⑵拱手(gǒng).⑶膏腴(yú).⑷逡巡(qūnxún)..⑸…
-
路政工作总结
华池路政大队20xx年上半年工作总结半年来,我大队以“科学发展观”为工作指导,严格按照省厅、局工作会议精神和路政管理工作会议精神…
-
20xx四德教育工作总结
寿塔小学“四德教育”活动总结根据上级的统一部署,寿塔小学“四德”教育活动中,使全体工作人员深刻认识了开展“四德”主题教育活动的重要…
-
逍遥游文言知识总结
《逍遥游》文言知识整理一、重要实词1、齐谐者,志怪者也(记载)2、亦若是则已矣(而已)3、而后乃今将图南(计划向南飞)4、我决起而…
-
初中名著导读归纳与总结(初一上册部分)
初中名著导读归纳与总结关于阅读名著名著是人类文化的精华。阅读名著,如同与大师们携手共游,可以增长见识,启迪智慧,提高语文能力和人文…