实验1 水体中化学耗氧量(COD)的测定
实验1 水体中化学耗氧量(COD)的测定
一、实验的目的与要求
⑴了解化学需氧量的含义。
⑵分别掌握滴定法和比色法(重铬酸钾作氧化剂)测定水样中有机物的原理和方法。
⑶熟悉回流操作技术
二、实验原理
化学耗氧量(COD)是指在一定的条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的量(O)/(mg·L-1)来表示。COD是环境水体质量及污水排放标准的控制项目之一,是量度水体受还原性物质(主要是有机物)污染程度的综合性指标。污水综合排放标准(GB 8978—88)规定,新建和扩建厂 COD允许排放浓度为:一级标准100 mg·L-1,二级标准150 mg·L-1,三级标准500 mg·L-1。对向地面水域排放的污水执行一、二级标准,其中城镇集中式水源地、重点风景名胜区等执行一级标准,一般工业用水区和农业用水区执行二级标准用,排入下水道进污水处理厂的才能执行三级标准。COD测定的方法有很多,对于测定地表水、河水等污染不十分严重的水质,一般情况下多采用酸性高锰酸钾法测定,此法简便快速。对于工业污水及生活污水中含有成分复杂的污染物,宜用重铬酸钾法。
酸性高锰酸钾法:在酸性条件下,向水样中加入一定量过量的KMnO4标准溶液,加热煮沸使水中有机物充分被KMnO4氧化,过量的KMnO4用一定量过量的NaC2O4标准溶液还原,再以 KMnO4标准溶液来返滴定Na2C2O4的过量部分。滴至溶液由无色变成粉红色且在30s内不褪色为终点。
水样处理反应式为 4MnO4-+5C+12H+ ==== 4Mn2++5CO2+6H2O
滴定反应式为 2 MnO4-+5 C2O42-+16H+ ==== 2 Mn2++10 CO2+8H2O
根据 KMnO4和 Na2C2O4的用量来计算水样的耗氧量。
重铬酸钾法:在强酸性溶液中,以 Ag2SO4作催化剂,加入过量的 K2Cr2O7氧化水中的还原性物质,过量的K2Cr2O7以试亚铁灵为指示剂,用硫酸亚铁按标准溶液返滴定。根据消耗相关溶液的体积和浓度,计算水样中还原性物质消耗氧的量。氯离子存在会影响测定,可在回流前向水样中加入HgSO4,使氯离子生成络合物以消除于抗。
滴定反应式为 Cr2O72-+6Fe2+ +14H+ ==== 2Cr3++6Fe3++7H2O
三、仪器和试剂
1.仪器
电子天平、移液管(10m,25mL,50mL)、锥形瓶(250mL)、容量瓶(100mL)。酸式滴定管、磨口锥形瓶(250mL)、冷凝回流装置、电炉(300W)或电热堡。
2.试剂
Na2C2O4(s,AR),KMnO4(s,AR),H2SO4(浓 AR,6mol·L-1),HgSO4(s,CP),K2Cr2O7(S,AR),邻二氮菲(s,AR),Ag2SO4(s,AR),FeSO4·(NH4)2SO4·6H2O(s,AR),FeSO4·7H2O(s,AR),试亚铁灵指示剂(1.4859邻二氮菲-0.695g FeSO4·7H2O溶于100mL蒸馏水中,储存于棕色滴瓶中),H2SO4- Ag2SO4溶液(在500mL浓H2SO4中加入 5g Ag2SO4,放置,不时摇动使之溶解)。
四、实验步骤
1.高锰酸钾法
1)0.002molL-1 KMnO4标准溶液的配制
用天平称取0.17g固体KMnO4,配制成500mL溶液。
2)0.005 000mol·L-1Na2C2O4标准溶液的配制
准确称取0.15~0.18g Na2C2O4于 100mL的烧杯中,加水溶解,定容于250mL容量瓶中,精确计算Na2C2O4标准溶液的浓度。
3)KMnO4标准溶液与Na2C2O4标准溶液体积比的确定
移取 10.00mL Na2C2O4标准溶液于 250mL锥形瓶中,加入 100mL蒸馏水和6 mol·L-1 H2SO4 10mL,加热至70~80℃,用0.002 mol·L-1 KMnO4溶液滴定至粉红色,且在30s内不褪色为终点。记录滴定体积V1。平行测定三次。
4)水中化学耗氧量的测定
(1)取 100.00mL水样于 250mL锥形瓶中,加入 6 mol·L-1 H2SO4 10mL,再由滴定管放入 0.002mol·L-1标准KMnO4溶液10.00mL(V2)。在锥形瓶中加入3~4粒玻璃珠,尽快将其加热至沸腾,并保持沸腾10min(溶液呈红色,否则就补加KMnO4溶液)。
(2)取下锥形瓶,冷却 lmin,准确加入0.005 000mol·L-1Na2C2O4标准溶液10.00 mL(V3),充分摇匀(溶液呈无色,否则就补加 Na2C2O4溶液)。
(3)趁热用 0.002 mol·L-1 KMnO4标准溶液滴定,先加入回滴 KMnO4,摇动溶液,使红色褪去后,再继续滴定。随着反应速度的加快,可逐渐加快滴定速度,快到终点时应逐滴加入,直至加入回滴 KMnO4溶液(最好半滴),溶液呈微红色,30s不褪去为终点。记录滴定体积V4。
(4)另取100.00mL去离子水代替水样,重复上述操作,求出空白值。
样品与空白均平行测定3次。
2.重铬酸钾法
1)0.04000 mol·L-1K2Cr2O7标准溶液的配制
准确称取150~180℃下烘干的K2Cr2O7 1.1767g溶于少量蒸馏水中,完全转移至100mL容量瓶中,稀释至刻度,充分摇匀。
2)0.l mol·L-1 FeSO4·(NH4)2SO4·6H2O溶液的配制
称取 7.90g FeSO4·(NH4)2SO4·6H2O溶于蒸馏水中,边搅拌边慢慢加入 4mL浓H2SO4,冷却后稀释至 200 mL,转移到试剂瓶中。每次使用前用K2Cr2O7标准溶液标定。
3)FeSO4·(NH4)2SO4·6H2O溶液的标定
准确移取10.00mL K2Cr2O7标准溶液于250mL锥形瓶中,加入100mL蒸馏水,缓慢加入浓H2SO4 30mL,摇匀。冷却后,加入 3滴试亚铁灵指示剂,用FeSO4·(NH4)2SO4·6H2O液滴定,溶液由黄色光变为蓝绿色,至红褐色为终点。由所用FeSO4·(NH4)2SO4·6H2O溶液的体积 VFe,计算 FeSO4·(NH4)2SO4·6H2O的浓度cFe。
4)水中化学耗氧量的测定
(1)移取25.00 mL混合均匀的水样于250 mL磨口的回流锥形瓶中,准确加入10.00mL 0.040 00 mol·L-1的K2Cr2O7标准溶液及数粒沸石,连接磨口回流冷凝管,从冷凝管上口慢慢加入30mL H2SO4- Ag2SO4溶液(分3~4次加入),轻轻摇动混合均匀。加热回流2h(沸腾开始计时)。
(2)冷却后,用适量蒸馏水冲洗冷凝管,取下锥形瓶,用蒸馏水稀释至140mL。
(3)在冷却后溶液中加入 3滴试亚铁灵指示剂,以 FeSO4·(NH4)2SO4·6H2O标准溶液滴定,溶液由黄色先变为蓝绿色,至变为红褐色为终点,记下所用FeSO4·(NH4)2SO4·6H2O标准溶液的体积 V1。
(4)测定水样的同时,以 25.00 mL二次重蒸水按以上同样步骤做空白试验。记下空白滴定时所用的FeSO4·(NH4)2SO4·6H2O标准溶液的体积V0。计算水中COD。
五、注意事项
(1)如实验时间所限,回流时间可缩短为0.5~lh,以学习掌握K2Cr2O7测定COD的方法。回流时间缩短后,视样品不同测得的COD偏低10%-40%,因此实际应用时必须回流2h。
(2)取样后应迅速测定,如不能即时进行测定,需用 H2SO4调至 pH<2加以保存。对于COD高的废水,取用量可以减少。若加热后溶液变为绿色,应再适当减少废水取用量重做。
(3)若水样含Cl-超过 30mg·L-1时,应先取 0.4g HgSO4加入回流锥形瓶中,再加 25.00rnL水样,摇匀后再加 K2Cr2O7标准溶液、数粒玻璃珠和H2SO4- Ag2SO4溶液,混合均匀后加热回流。加HgSO4多少视水样中含Cl- 多少而定。二者的质量比一般为HgSO4:Cl- = 10:1。
(4)滴定时溶液的总体积不得少于140mL,否则酸度太高,滴定终点不明显。
六、结果处理
1.高锰酸钾法
(1)草酸钠溶液的浓度

(2)水样中COD的测定

2.重铬酸钾法
(1)FeSO4·(NH4)2SO4·6H2O溶液的标定

(2)水样中COD的测定

式中:V水样为所取水样的体积(mL);8为氧( O)的摩尔质量(g·L-1 )。
O)的摩尔质量(g·L-1 )。
思考题
1.COD表示什么?
2.重铬酸钾法测定COD时的注意事项是什么?
3.本实验中测定COD两种方法的异同点是什么?
第二篇:实验一:水样中化学耗氧量(COD)的测定
实验一:水样中化学耗氧量(COD)的测定
化学耗氧量(COD)是反映水质受有机物污染情况的一个重大指标,大多采用高锰酸钾煮沸消解法和重铬酸钾加热回流法进行测定。本试验通过用酸性高锰酸钾煮沸消解法,对学校池塘内的水样进行化学耗氧量(COD)测定,首先酸性高锰酸钾和还原性物质作用,再用草酸钠还原剩余的高锰酸钾,并以返滴定法用高锰酸滴定钾草酸钠过量部分,用实际消耗高锰酸钾的量测得水样中的化学耗氧量(COD)为4.5377mg/L。
一、实验目的
1. 测定自来水和蒸馏水化学耗氧量(COD)的测定,分析得出自来水的水质。
2.对水中化学耗氧量(COD)与水体污染的关系有所了解。
二、实验原理
化学耗氧量是指天然水中可被高锰酸钾或重铬酸钾氧化的有机物的含量。化学耗氧量测定的常用方法为高锰酸钾法、重铬酸钾和碘酸盐法。本实验为高锰酸钾法,其原理如下:
在酸性(或碱性)条件下,高锰酸钾具有很高的氧化性,
2KMnO4+5 Na2C2O4+8H2SO4= 2MnSO4+8H2O+10CO2↑+5Na2SO4+K2SO4
 水溶液中多数的有机物都可以氧化,但反应过程相当复杂,只能用下式表示其中的部分过程:
水溶液中多数的有机物都可以氧化,但反应过程相当复杂,只能用下式表示其中的部分过程:
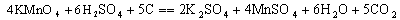
过量的KMnO4用过量的Na2C2O4还原,再用KMnO4溶液滴至微红色为终点,反应如下:

三、实验步骤
1. 准确取水样100.00ml于锥型瓶中。
2. 加入5ml 1:3  溶液。
溶液。
3. 加入0.01mol/l (1/5 )的溶液10.00 ml。
)的溶液10.00 ml。
4. 加几粒沸石,立即加热。(此时溶液仍为紫色,若溶液的红色消失,说明污物多,应补加 溶液),记下
溶液),记下 的总体积V1。从冒第一个大气泡开始计时,煮沸十分钟。
的总体积V1。从冒第一个大气泡开始计时,煮沸十分钟。
5. 冷却1min,准确加入15.00 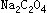 标准溶液,充分摇匀,此时溶液应由红色转为无色。
标准溶液,充分摇匀,此时溶液应由红色转为无色。
6. 用0.01mol/l (1/5 )滴定至淡红色,记下所用的
)滴定至淡红色,记下所用的 的体积V2,平行三次。
的体积V2,平行三次。
7. 另取100蒸馏水代替水样,用上述方法求空白值,加以扣除。
取一份已到终点的溶液加入15.00ml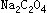 溶液,立即用
溶液,立即用 滴定至浅红色,30s不褪色,计下VK
滴定至浅红色,30s不褪色,计下VK
K=15.00/ VK
四、数据记录与处理

七、实验结果与讨论
自来水中耗氧量为: mg/Ml
查询资料得:清洁地面水中有机物的含量较低,COD小于3~4mg·L-1。轻度污染的水源COD可达4~10mg·L-1,若水中COD大于10mg·L-1,认为水质受到较严重的污染。清洁海水的COD小于0.5mg·L-1。由此得出结论:自来水的水质较好,污染程度较低。
实验二:自来水硬度的测定
一、实验目的:
1. 了解络合滴定法的原理及其应用。
2. 掌握络合滴定法中的直接滴定法,学会用配位滴定法测定水的总硬度。
3. 掌握EDTA标准溶液的配制与标定的原理。
4. 了解标定EDTA所用指示剂的性质和使用的条件。
5. 掌握用CaCO3标定EDTA的方法。
二、实验原理:
1、水的总硬度的测定:
水的硬度主要由于水中含有钙盐和镁盐,其他金属离子如铁、铝、锰、锌等离子也形成硬度,但一般含量甚少,测定工业用水总硬度时可忽略不计。测定水的硬度常采用配位滴定法,用乙二胺四乙酸二钠盐(EDTA)的标准溶液滴定水中Ca、Mg总量,然后换算为相应的硬度单位(我国采用 mmol/L或mg/L(CaCO3)为单位表示水的硬度)。
按国际标准方法测定水的总硬度:在pH=10的NH3—NH4Cl缓冲溶液中,以铬黑T(EBT)为指示剂,用EDTA标准溶液滴定至溶液由紫红色变为纯蓝色即为终点。滴定过程反应如下:
⑴ 指示剂:铬黑T(EBT)
PH <6.3 (紫); PH 6.3~11.5 (蓝); PH >11.5 (橙)
⑵ 滴定过程颜色变化:
滴定前: EBT + Mg2+= Mg-EBT
(蓝色) (紫红色)
滴定时: EDTA + Ca2+= Ca-EDTA
(无色)
EDTA + Mg2+= Mg-EDTA
(无色)
终点时:EDTA + Mg-EBT = Mg-EDTA + EBT
(紫红色) (蓝色)
到达计量点时,呈现游离指示剂的纯蓝色。
⑶ 终点颜色变化:(紫红色) → (蓝色)
⑷ 干扰离子的掩蔽:
若水样中存在Fe3+,Al3+等微量杂质时,可用三乙醇胺进行掩蔽,Cu2+、Pb2+、Zn2+等重金属离子可用Na2S或KCN掩蔽。
⑸ 水硬度的表示:
各国对水硬度表示的方法尚未统一,我国生活饮用水卫生标准中规定硬度(以CaCO3计)不得超过450mg/L。除了生活饮用水,我国目前水硬度表示方法还是用mmol/L(CaCO3)表示。
三、仪器与试剂
1. 分析化学实验常用仪器、烘箱、称量瓶、电子天平、干燥器、电炉、台秤
2. EDTA(s)(A.R.)、CaCO3(s)(A.R.)、HCl(1∶1)、三乙醇胺(1∶1)、NH3—NH4Cl缓冲溶液(pH=10)、Mg2+-EDTA溶液、铬黑T指示剂(0.5%)、水样。
四、实验步骤
1.自来水总硬度的测定
移取水样100.0mL于250mL锥形瓶中,加入1~2滴1:1HCL微沸数分钟以除去CO2,冷却后,加入3mL1∶1三乙醇胺(若水样中含有重金属离子,则加入1mL2%Na2S溶液掩蔽),5mL氨性缓冲溶液,2~3滴铬黑T(EBT)指示剂,EDTA标准溶液滴定至溶液由紫红色变为纯蓝色,即为终点。注意接近终点时应慢滴多摇。平行测定三次,计算水的总硬度,以mg/L(CaCO3)表示分析结果。
问题及答案
1. 铬黑T与Mg2+显色灵敏度高,与Ca2+显色灵敏度低,当水样中Ca2+含量高而Mg2+很低时,得到不敏锐的终点,可采用K-B混合指示剂。
2. 水样中含铁量超过10mg·mL-1时用三乙醇胺掩蔽有困难,需用蒸馏水将水样稀释到Fe3+不超过10mg·mL-1即可。
- 化学需氧量的测定(实验报告)
-
化学需氧量的测定及经验总结
化学需氧量的测定化学需氧量简称COD是利用化学氧化剂将废水中可氧化物质如有机物亚硝酸盐亚铁盐硫化物等氧化分解然后根据消耗的氧化剂算…
-
化学需氧量COD的测定
生活污水中化学需氧量COD的测定教学内容一实验目的1了解化学耗氧量COD的基本含义2学习酸性高锰酸钾法测定水的COD的方法掌握移液…
- 实验报告 化学需氧量(CODcr)(张鸿玉)
-
化学需氧量的测定(重铬酸钾法)实验报告
化学需氧量的测定重铬酸钾法一实验目的和要求1掌握容量法库仑滴定法测定化学需氧量的原理和技术熟悉库仑仪的原理和操作方法2复习第二章有…
-
有机废水的好样生化处理+化学需氧量的测定=实验报告模版
有机废水的好样生化处理一实验目的和要求1掌握污水生化处理实验设计的一般方法2掌握接触氧化池二沉池各处理工序的基本原理3了解对初沉池…
- 化学需氧量的测定(实验报告)
-
水中化学耗氧量的测定 实验报告
水中化学耗氧量COD的测定高锰酸钾法一实验目的1对水样中耗氧量COD与水体污染的关系有所了解2掌握高锰酸钾法测定水中COD的原理及…
-
化学需氧量的测定(重铬酸钾法)实验报告
化学需氧量的测定重铬酸钾法一实验目的和要求1掌握容量法库仑滴定法测定化学需氧量的原理和技术熟悉库仑仪的原理和操作方法2复习第二章有…
-
生化需氧量的测定
一实验目的1了解生化需氧量BOD5的含义2掌握五日培养法测定生化需氧量的基本原理3熟练掌握碘量法测定DO的操作技术4明确化学需氧量…
-
化学需氧量COD的测定
生活污水中化学需氧量COD的测定教学内容一实验目的1了解化学耗氧量COD的基本含义2学习酸性高锰酸钾法测定水的COD的方法掌握移液…