发射光谱定性分析和定量分析
华南师范大学实验报告
学生姓名: 学号:
专业: 化学 年级班级:
课程名称:仪器分析实验
实验项目:发射光谱定性分析和定量分析
实验时间:20##年4月7日
实验指导老师:孙 峰
实验评分:
发射光谱定性分析和定量分析
一实验目的
①掌握光谱定性分析的一般原理和方法。
②掌握光谱定量分析的一般原理和方法。
③了解电感耦合等离子体原子发射光谱仪的使用方法。
二实验原理
当物质被热能或电能激发到不稳定状态时,会辐射能量并产生发射光谱。被激发的分子产生带状光谱,被激发的原子或离子产生线状光谱,线状光谱是发射光谱分析的基础。
现状光谱中的各条谱线是元素的原子或离子的外层电子在两个能级间跃迁时产生的。根据辐射的量子理论
△E=E2-E1=hv
谱线的波长: λ=c/v
由于各种元素的原子结构不同,故其发射光谱的谱线波长也各不相同,根据各元素的特征谱线,可判别相应元素存在与否。
一个元素可以有很多条谱线,其中最容易激发的谱线称为该元素的“灵敏线”或“最后线”。如为确定试样中某元素存在与否,不必检查该元素的所有谱线,只需根据几条灵敏线的出现与否即可作出判断。
光谱分析就是根据元素的特征光谱来鉴别元素的存在(定性分析),而谱线的强度与试样中该元素的含量有关,因此也可以利用谱线的强度来测定元素的含量(定量分析)。当温度一定时,谱线强度与元素浓度之间的关系符合下列经验公式: I=acb
lg I=b lg c+lg a
此式称为赛伯-罗马金公式,是光谱定量分析的基本关系式。
三仪器与试剂
1、仪器
IRIS IntrepidⅡXP高频电感耦合等离子体直读光谱仪
2、试剂
氩气,未知水样,钙标准溶液(100mg/l),镁标准溶液(50mg/l),稀硝酸,去离子水
四实验内容与步骤
1、定性分析
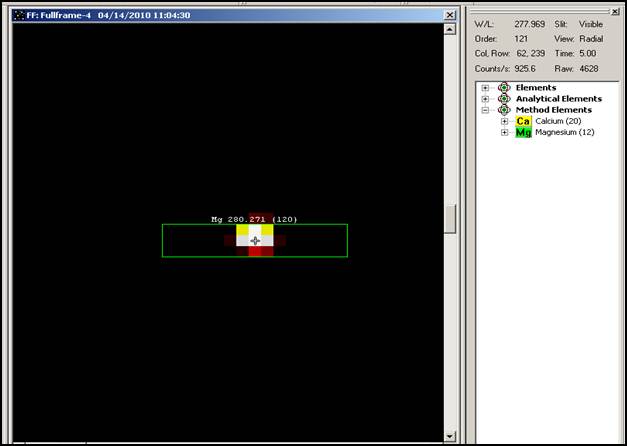
定性分析包括分析元素和分析谱线,通常全谱直读电感耦合等离子体发射光谱仪通过全谱谱图对样品中的元素进行更详细的了解,全谱谱图包含样品中所有元素的所有谱线。样品的所有信息都包括在两张全谱谱图中,(UV和Vis,以345nm为分界线),通过全谱谱图可以对未知样品进行定性分析,或证明某些元素的存在。
对于未知样品,首先点击“Run”选择“FullFrame”命令,获得样品的UV和Vis全谱,然后点击观测到的某条强谱线,用谱线库对其进行鉴别,同时寻找该元素的其他二级谱线进行辅助证明。
如果要证明某元素的存在,全谱直读电感耦合等离子体发射光谱仪可以先建立一个含有待测元素的方法,选择所需元素和相应谱线,然后准备一份含有待测元素的溶液,它可以是典型样品或合成样品,并运行全谱命令,得到的全谱谱图中就会将选定元素和谱线标记出来。如果在标记处有光斑则可以证明该元素存在,反之亦然。
(1)未知样品的定性分析。按照仪器操作规程,设置仪器参数,点燃等离子体,运行全谱命令,并用谱线库对未知样品进行定性。
仪器主要参数:高频功率,1150W;冷却气流量,15L/min;辅助气流量,0.5 L/min;载气压力,24psi(1psi=6894.76Pa);蠕动泵转速,100r/min;溶液提升量,1.85ml/min
(2)证明自来水中Ca,Mg元素的存在。设定含有待测元素的方法,选择Ca,Mg元素和相应的分析线,运行全谱命令,查看Ca,Mg元素特征谱线标记处是否有光斑,如果有证明存在该元素。
2、定量分析
测定自来水中Ca,Mg元素和含量,由于ICP-AES具有较宽的线性范围,通常可通过两点定线,一点是空白溶液,另外一点是高于待测元素含量的高标准溶液。
(1)标准溶液的配制
Mg标准溶液的配制(50mg/L):移取5ml Mg标准贮备液与100mL容量瓶中,用二次蒸馏水稀释至刻度线,摇匀备用。
Ca标准溶液的配制(100mg/L):移取10mLCa标准贮备液与100mL容量瓶中,用二次蒸馏水稀释至刻度线,摇匀备用。
(2)测定
按照仪器操作规程设置测定条件:
A.选择待测元素及分析线,Ca 317.933nm,184.006nm,315.887nm;Mg 279.079nm,279.533nm,280.271nm;
B.进行标准化,绘制标准曲线;
C.直接测定自来水中Ca,Mg元素含量。
五数据处理
定性分析:Ca,Mg元素特征谱线标记处有很亮的光斑,说明待测溶液中含有这两种元素。
定量分析:Ca:317.933nm 浓度为30.93μg/mL;
Mg 279.079nm 浓度为3.888μg/mL

六.思考与讨论
1、试简述标准曲线法的特点和使用范围。
答:标准曲线法也称外标法或直接比较法,是一种简便、快速的定量方法。配制一系列浓度不同的标准溶液,在相同测定条件下,以空白溶液调零吸收,测定标准系列溶液和试样溶液的吸光度,绘制A-c标准曲线,用内插法在标准曲线上求得试样中被测元素的含量。
标准曲线法的优点是:绘制好标准工作曲线后测定工作就变得相当简单,可直接从标准工作曲线上读出含量,因此特别适合于大量样品的分析。 标准曲线法的缺点是:每次样品分析的色谱条件(检测器的响应性能,柱温,流动相流速及组成,进样量,柱效等)很难完全相同,因此容易出现较大误差。此外,标准工作曲线绘制时,一般使用欲测组分的标准样品(或已知准确含量的样品),而实际样品的组成却千差万别,因此必将给测量带来一定的误差。
使用标准曲线法要注意:
(1)标准系列的组成与待测定试样组成尽可能相似,配制标准系列时,应加入与试样相同的基体成分。在测定时应进行背景校正。
(2)所配置的试样浓度应该在A-c标准曲线的直线范围内,吸光度在0.15~0.6之间测量的准确度较高。通常根据被测定元素的灵敏度来估计试样的合适浓度范围。
(3)在整个测量过程中,测定条件要始终保持不变。
适用范围:大量样品且组成明确的样品分析。
2、如果试样成分比较复杂,应该怎样测定?
答:如果试样成分比较复杂,待测元素含量很低时,应该采用标准加入法进行定量分析。取若干份相同体积的试样溶液,依次加入浓度分别为0 ,c0 ,2 c0 ,3 c0 ,4 c0 ·······的标准溶液,用溶剂定容,摇匀后在相同条件下测量其吸光度,以吸光度对加入标准溶液的浓度作图,即A-cs标准曲线,延长曲线与浓度轴相交,交点与原点的距离即为试样中被测定元素的浓度cx
3、实验讨论
(1)在本次实验中选择Ca的分析线为 317.933nm,184.006nm,315.887nm,但由于184.006nm的分析线不在正态分布范围内,故不挑选此谱线下测定的浓度,而考虑信噪比等因素后,决定选用317.933nm的分析线测定的Ca的浓度。Mg的分析线的选取同上。
(2)在实验过程中,废液排出管发生堵塞,导致废液不能正常流出,会是废液在雾化室积聚,从而影响雾化效率。故必须在实验前检查排出管是否能顺畅。
(3)选择分析线时,要注意:要选择元素的具有足够强度和足够灵敏度的灵敏线或者时元素的特征线组。要求选择的分析线是无自吸的共振线,且不与其他干扰谱线重叠。
(4)在实验中使用Ar气体,原因有:
①Ar气体产生的背景干扰少;
②三层同心石英玻璃炬管的内层Ar气体携带试样进入雾化室,中层Ar气体用于点燃等离子体,外层Ar气体可保护石英管不被烧熔。
(5)ICP-AES的特点:
u 温度高,惰性气氛,原子化条件好,有利于难熔化合物的分解和元素激发,有很高的灵敏度和稳定性。
u “趋肤效应”,涡电流在外表面处密度大,使表面温度高,轴心温度低,中心通道进样对等离子的稳定性影响小。有效消除自吸现象,线性范围宽(4-5个数量级)。
u ICP中电子密度高,碱金属电离影响小。
u Ar气体产生的背景干扰小。
u 无电极放电,无电极污染。
u ICP焰炬外型像火焰,但不是化学燃烧火焰。
第二篇:原子发射光谱定性和定量分析
【实验题目】
原子发射光谱定性和定量分析
【实验目的】
1、掌握光谱定性分析的一般原理和方法。
2、掌握光谱定量分析的一般原理和方法。
3、了解电感耦合等离子体原子发射光谱仪的使用方法。
【实验原理】
但当原子受到能量(如热能、电能等)的作用时,原子由于与高速运动的气态粒子和电子相互碰撞而获得了能量,使原子中外层的电子从基态跃迁到激发态,处于激发态的原子是十分不稳定的,在极短的时间内便跃迁至基态或其它较低的能级上。当原子从较高能级跃迁到基态或其它较低的能级的过程中,将释放出多余的能量,这种能量是以一定波长的电磁波的形式辐射出去的,其辐射的能量可用下式表示:
△E=E2-E1=hv
谱线波长:
λ=c/v
每一种元素因其原子结构不同,受激发后都可以产生自己的特征光谱,每一种元素的特征光谱通常包含有很多谱线,谱线的强度各不相同。一个试样如含有若干种元素,谱线上就有这若干种元素的特征光谱,特征光谱的条数多少与各元素含量高低有关。当某元素含量降低时,其光谱中的弱线相继消失,而不被检出。最后消失的几条谱线叫“灵敏线”定性分析一般只需找出某元素的灵敏线即可确定该元素的存在。
光谱分析根据这些元素的特征光谱就可以准确无误的鉴别元素的存在(定性分析),而这些光谱线的强度又与试样中该元素的含量有关,因此又可利用这些谱线的强度来测定元素的含量(定量分析)。当温度一定时,光谱线的强度与试样中该元素的浓度之间的关系符合下列经验公式:
I=aCb
lgI=blgc+lga
【实验仪器与试剂】
(1) 仪器:
IRIS INTREPIDⅡ XSP 高频电感耦合等离子直读仪。
(2) 试剂:
氩气;未知样品;钙、镁保准储备液:100ug/mL;蒸馏水。
【实验内容与步骤】
1、定性分析
按仪器操作规程,设置仪器参数,点燃等离子体,运行全谱命令,对未知样品进行分析。
仪器主要参数:高频功率,1150W;冷却气流量,15L/min;辅助气流量,0.5L/min;载气压力,25psi;蠕动泵转速,120r/min;溶液提升量,1.85mL/min。
证明自来水中钙和镁元素的存在,选择测定方法,选择相应分析线,运行全谱命令,查看钙、镁特征谱线标记处是否有光斑,如果有证明有该元素存在。
2、定量分析
测定自来水中Ca、Mg元素含量,通常可以通过两点定线,一点是空白溶液,一点是高于待测元素含量的高标准溶液。
按照仪器操作规程设定测定条件:
a. 选择待测元素及分析线:Ca 315.933nm,Mg 279.079nm;
b. 进行标准化,绘制标准曲线;
c. 直接测定自来水中Ca、Mg的含量。
【实验数据记录与分析】

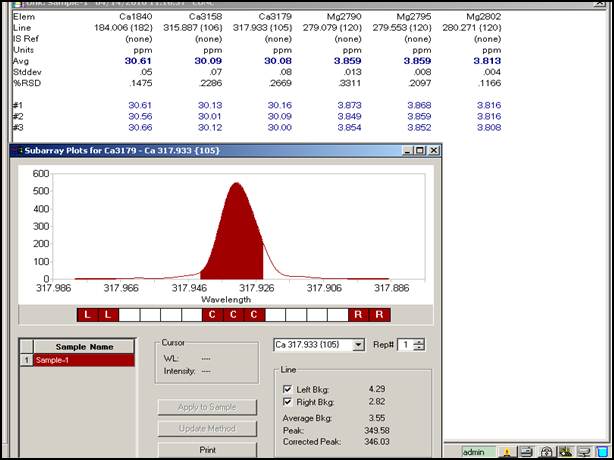
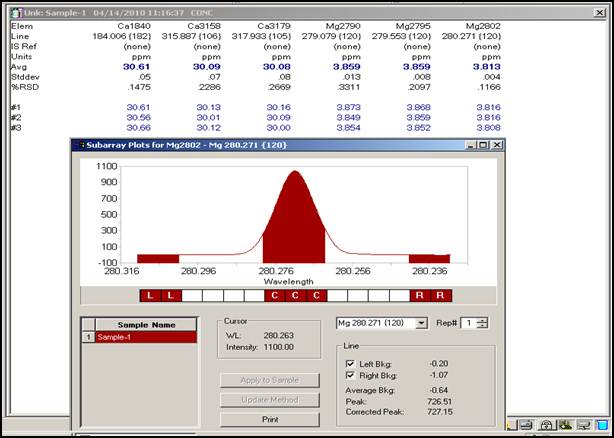
由上数据可知Ca在315.887nm时测定最优,多次测得浓度平均值为30.09ppm。Mg在280.271nm时测定最优,多次测得浓度平均值为3.813ppm。
-
光谱分析实验报告
仪器分析实验光谱分析实验一光谱分析食质检测20xx级02班钟凯成学号20xx5782一实验目的1了解主要光学仪器AASAFSV2S…
-
报告发射光谱定性与定量分析
华南师范大学实验报告学生姓名杨秀琼学号20xx2401129专业化学年级班级08化二课程名称仪器分析实验实验项目发射光谱定性分析实…
-
红外光谱分析实验报告
一实验题目红外光谱分析实验二实验目的1了解傅立叶变换红外光谱仪的基本构造及工作原理2掌握红外光谱分析的基础实验技术3学会用傅立叶变…
-
仪器分析实验一 紫外吸收光谱定性分析的应用
实验一紫外吸收光谱定性分析的应用一实验目的1掌握紫外吸收光谱的测绘方法2学会利用吸收光谱进行未知物鉴定的方法3学会杂质检出的方法二…
-
实验10 碳酸钙、聚乙烯醇、丙三醇、乙醇的红外光谱定性分析(罗娅君)
实验十碳酸钙聚乙烯醇丙三醇乙醇的红外光谱定性分析一实验目的1了解傅立叶变换红外光谱仪的基本构造及工作原理2掌握红外光谱分析的基础实…
-
公务员自我鉴定总结
XX年度在领导的关怀和同事的帮助下,通过自己的不懈努力,较好地完成了各项工作任务。现自我鉴定如下:1、思想政治方面:加强理论学习,…
-
五年级美术教学工作总结
岁月如梭,转眼一个学期过去了。在这一个学期中,根据我校的实际需要,我担任了五年级的美术教师。我对一个学期中的美术课教学工作总结如下…
-
教科研总结
中学校本科研工作总结教科研是学校发展的必要条件之一,一个学校的教育要发展,教科研必须先行,教科研与学校的教改和发展,有着密切的关系…
-
公司年终总结范文6413429479
公司年终总结范文客运公司年终总结范文客运分公司从****年*月*日至**日开展“以人为本,安全第一”为主题的安全生产月活动,在集团…
-
教育教学成绩总结
自任现职以来,我一直辛勤耕耘在教育教学这块园地里,忠心耿耿地为人类最光荣的事业奉献着自己的一腔热血,忠心于本职工作,对工作满腔热忱…