氯化铵的制取
实验:氯化铵的制备
一、目的要求
1. 运用已学过的化学知识,自行制定制备氯化铵的实验方案,并制出产品。 2. 巩固实验室的一些基本操作。如称量、加热、浓缩、过滤(常压、减压等)。 3. 观察和验证盐类的溶解度与温度的关系。
二、基本原理
本实验用氯化钠与硫酸铵作用来制备氯化铵: 2 NaCl + (NH4)2SO4 = Na2SO4 + 2 NH4Cl 根据它们的溶解度及其受温度影响差别的原理,采取加热、蒸发、冷却等措施,使溶解?结晶转化,从而达到分离。
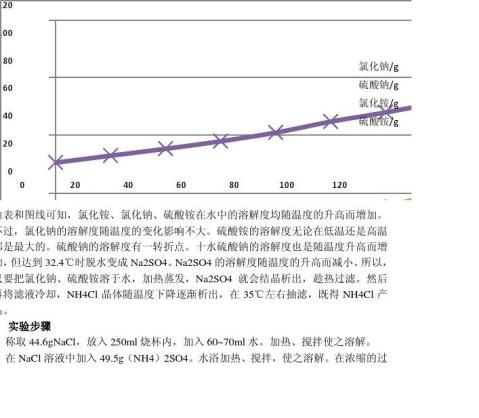
,氯化铵、氯化钠、硫酸铵在水中的溶解度均随温度的升高而增加。不过,氯化钠溶解度受温度的影响不大;硫酸铵的溶解度无论在低温还是高温都是最大的。硫酸钠的溶解度有一转折点。十水硫酸钠的溶解度也是随温度的升高而增加,但达32.4C时脱水变成Na2SO4。Na2SO4的溶解度随温度的升高而减小。所以,只要把氯化钠、硫酸铵溶于水,加热蒸发,Na2SO4就会结晶析出,趁热过滤。然后再将滤液冷却,NH4Cl晶体随温度的下降逐渐析出,在35C左右抽滤,即得NH4Cl产品。
O O
三、实验步骤
方案一:析出Na2SO4法(加热法)
1. 称取23g NaCl,放入250 mL烧杯内,加入60-80 mL水。加热、搅拌使之溶解。若有不溶物,则用普通漏斗过滤分离,滤液用蒸发皿盛。
2. 在NaCl溶液中加入26g (NH4)2SO4。水浴加热、搅拌,促使其溶解。在浓缩过程中,有大量Na2SO4结晶析出。当溶液减少到70 mL(提前作记号)左右时,停止加热,并趁热抽滤。 3. 将滤液迅速倒入一100mL烧杯中,静置冷却,NH4Cl晶体逐渐析出,冷却至35C左右,抽滤。 O4. 把滤液重新置于水浴上加热蒸发,至有较多Na2SO4晶体析出,抽滤。倾出滤液于小烧杯中,静置冷却至35C左右,抽滤。如此重复二次。 O
5. 把三次所得的NH4Cl晶体合并,一起称重,计算收率(将三次所得的副产品Na2SO4合并称重)。 6. 产品的鉴定:
取1g NH4Cl产品,放于一干燥试管的底部,加热。
NH4Cl杂质含量 =(G灼烧后-G空试管)g/1g?100%
方案二:析出Na2SO4?10H2O法(冰冷法)
1. 称取23g NaCl,放入250 mL烧杯内,加入约90 mL水。加热、搅拌使之溶解。若有不溶物,则用普通漏斗过滤分离。
2. 在NaCl溶液中加入26g (NH4)2SO4。水浴加热、搅拌,促使其溶解。
3. 然后用冰冷却到0-10?C左右,加入少量Na2SO4?10H2O作为晶种,并不断搅拌。至有大量Na2SO4?10H2O晶体析出时,立即抽滤。
4. 将滤液转入蒸发皿中,水浴蒸发浓缩至有少量晶体析出,静置冷却,NH4Cl晶体逐渐析出,冷却至35C左右,抽滤。 O
5. 把所得的NH4Cl晶体称重,计算收率。(将所得的副产品Na2SO4?10H2O也称重)。 6. 产品的鉴定:
取1g NH4Cl产品,放于一干燥试管的底部,加热。
NH4Cl杂质含量 =(G灼烧后-G空试管)g/1g?100%
四、实验流程
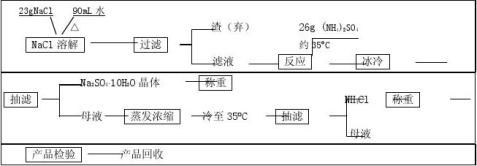
242
五、注意事项
1 用水溶解的溶质量较多时,溶液体积与水的体积不等。
2 加热法:水量60-80mL即可,浓缩时要提前作好记号,浓缩不能过度,以防NaCl、(NH4)2S
O4析出,趁热抽滤时要预热仪器。多次浓缩分离(NH4)2SO4与NH4Cl。
3 冰冷法:水量75-90mL(Na2SO4?10H2O析出耗水)。冷却过程要不断剧烈搅拌(因为结晶过
程放出大量热量),形成过饱和aq时未能结晶的话,可加Na2SO4?10H2O作晶种。为保证分离效果,在温度降至10?C以下时,最好能保持1hr左右。
4 以上2种方法中,“冰冷法”分离效果好,但速度慢。
5 加热浓缩时要注意不断搅拌。
6 NH4Cl与副产品均回收。
第二篇:氯化铵的制备
氯化铵的制备
温度℃
氯化钠/g
硫酸钠/g
氯化铵/g
硫酸铵/g 一、 实验目的 (1) 利用所学知识,自行设计实验,提高设计实验的能力。 (2) 复习称量、加热、浓缩、过滤(常压、减压)等实验操作。 (3) 验证溶液溶解度与温度的关系。 二、 实验原理 本实验用氯化钠和硫酸铵来制备氯化铵:2NaCl+(NH4)2SO4=Na2SO4+2NH4Cl 根据他们的溶解度及其受温度的影响差别的原理,采取加热、蒸发、冷却等措施,使溶解晶体转化,从而达到分离。以上四种盐在不同温度下的溶解度 0 10 20 30 40 50 60 70 80 35.7 35.8 36 36.2 36.5 36.8 37.3 37.6 38.1 4.7 9.1 20.4 41 49.7 48.2 46.7 45.2 44.1 29.7 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6 70.6 73 75.4 78 81 84.8 88 91.6 95.3
100
39.2
42.7
77.3
103.3
三、 12 90 38.6 43.3 71.3 99.2
程中,有大量的Na2SO4结晶析出。当溶液减少到140ml左右时,停止加热,并趁热抽滤。
3、 将滤液迅速倒入一个250ml的烧杯中,静置冷却,NH4Cl晶体逐渐析出,冷却至
35℃左右,抽滤。
4、 把滤液重新置于水浴上加热蒸发,至有较多的Na2SO4晶体析出,抽滤。倾出滤液
于小烧杯中,静置冷却至35℃左右,抽滤。如此重复二次。
5、 把三次所得的NH4Cl晶体合并,一起称重,计算收率(将三次所得的副产品Na2SO4
合并称重)。
6、 产品的鉴定:
取1g产品,放于一干燥的试管中,加热。
NH4Cl杂质含量=(灼烧后w1—空试管w2)g/1g*100%。
四、 注意事项
1、 用水溶解的溶质较多时,溶液体积与水的体积不等。
2、 水量60~80ml即可,浓缩时要提前做记号,浓缩不能过度,以防NaCl、(NH4)2SO4
析出,趁热过滤时要预热仪器;多次浓缩分离NH4CI和(NH4)2SO4。
3、 加热浓缩时要不断地搅拌。
4、 所得的产品要回收。
相对分子质量:氯化钠58.5,硫酸铵130,氯化铵52.5。若要得到20g氯化铵 根据原理中的化学方程式,所需氯化钠质量为(20/52.5)*2*58.5=44.6g
硫酸铵的质量(20/52.5)*130=49.5g
-
20xx年医务科工作总结
张院长、王院长、才院长及全体同仁:大家下午好!下面我代表医务科做20xx年医务科全年工作总结,不妥之处,请批评指正。20xx年医务…
-
20xx年终工作总结
自20xx年x月进入省直机关三爻小区工地,经过将近一年的时间,使自己在工程项目管理及协调方面得到了提高也发现了工作中存在的一些问题…
-
五下品德与社会教学总结
五年级下册《品德与社会》教学总结佛山市顺德区均安镇顺峰小学陆志豪光阴飞逝,一学期的工作又临近尾声,蓦然回首,别有一番滋味在心头。本…
-
学生会卫生部个人工作总结
卫生部个人工作总结自从进入大学以来,我陪着卫生部已经走过了一年半,经历了从干事到副部的蜕变,深谙卫生部各种事项的流程和教室宿舍的安…
-
省直工会半年总结
省直工会上半年工作总结及下半年工作打算(20xx年x月)20xx年上半年,省直工会在省总工会和省委省直工委的正确领导下,围绕中心,…