电导的测定及其应用
物 理 化 学 实 验 报 告
实 验 名 称: 电导的测定及其应用
学 院: 化学工程学院
专 业: 化学工程与工艺
班 级:
姓 名:
学 号:
指 导 教 师:
日 期: 2011年 月日
一、实验目的
1. 测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率;
2. 用电导率测量醋酸在水溶液中的解离平衡常数;
3. 掌握恒温水槽及电导率仪的使用方法。
二、实验原理
1.电解质溶液的电导能力通常用电导G来表示,它的单位是西门子,用符号S表示,若将某电解质溶液放入两平行电极之间,设电极间距离为l ,电极面积为A,则电导为:
G=KA / l (2.5.1)
式 (2.5.1) 中,K为该电解质溶液的电导率,其物理意义:在两平行而相距1m,面积均为1 m2的两电极间,电解质溶液的电导称为该溶液的电导率,其单位以SI制表示为S/m;(l/A)为电导池常数,以Kcell表示,单位为m-1。
由于电极的l和A不易精确测量,因此在实验中是用一种已知电导率值的溶液先求出电导池常数Kcell, 然后把欲测溶液放入该电导池测出其电导值,再根据 (2.5.1) 式求出其电导率。
在讨论电解质溶液的导电能力时常用摩尔电导率(Λm)这个物理量。它是指把含有1mol电解质的溶液置于相距为1m的两平行板电极之间的电导。以Λm表示,其单位以SI单位制表示为S·m2/mol-1。
摩尔电导率与电导率的关系:
Λm = K / C (2.5.2)
式(2.5.2)中,C为该溶液浓度,其单位以SI单位制表示为mol · m-3。
2. Λm 总是随着溶液的浓度的降低而增大的。对强电解质稀溶液而言,其变化规律可用科尔劳施经验公式表示:
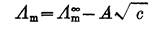 (2.5.3)
(2.5.3)
式(2.5.3)中,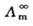 是溶液在无限稀释时的极限摩尔电导率。对特定的电解质和溶剂来说,在一定温度下,A是一个常数。所以,将
是溶液在无限稀释时的极限摩尔电导率。对特定的电解质和溶剂来说,在一定温度下,A是一个常数。所以,将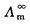 对
对 作图得到的直线外推至C=0处,可求得
作图得到的直线外推至C=0处,可求得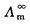 。
。
3. 对于弱电解质溶液来说,其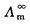 无法利用上式通过实验直接测定。但我们知道,在其无限稀释溶液中,弱电解质的a=1,每种离子对电解质的摩尔电导率都有一定的贡献,是独立移动的,不受其他离子的影响,对电解质MV+AV-来说,即:
无法利用上式通过实验直接测定。但我们知道,在其无限稀释溶液中,弱电解质的a=1,每种离子对电解质的摩尔电导率都有一定的贡献,是独立移动的,不受其他离子的影响,对电解质MV+AV-来说,即:
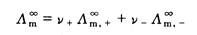 (2.5.4)
(2.5.4)
式(2.5.4)中,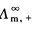 、
、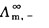 分别表示正、负离子的无限稀释摩尔电导率。它与温度及离子的本性有关。
分别表示正、负离子的无限稀释摩尔电导率。它与温度及离子的本性有关。
在弱电解质的稀薄溶液中,离子的浓度很低,离子间的相互作用可以忽略,可以认为在它浓度C时的解离度a等于它的摩尔电导率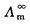 与其无限稀释摩尔电导率之比,即:
与其无限稀释摩尔电导率之比,即:
a=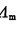 /
/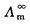 (2.5.5)
(2.5.5)
把(2.5.4)代入(2.5.1)式可得:
 (2.5.6)
(2.5.6)
以C Λm 对 1/Λm 作图,根据其斜率求得K 。
三、实验仪器、试剂
仪器:梅特勒326电导率仪1台;电导电极1只;量杯(50ml)2只;移液管(25ml)9只;洗瓶1只;洗耳球1只
试剂:10.00(mol/m3)KCl溶液; 100.0(mol/m3)HAc溶液;电导水
四、实验步骤
1.打开电导率仪开关,预热5min 。
2.KCl溶液电导率测定;
(1)用移液管准确移入10.00(mol/m3)KCl溶液25.00ml,置于洁净,干燥的量杯中;测定其电导率3次,取平均值。
(2)再用移液管准确移入25.00ml电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(3)用移液管准确移出25.00ml上述量杯中的溶液,弃去;再用移液管准确移入25.00ml电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(4)重复(3)的步骤。
(5)重复(3)的步骤。
(6)倾去电导池中的KCl溶液,用电导水洗净量杯和电极;量杯放回烘箱;电极用滤纸吸干。
3.HAc溶液和电导水的电导率测定;
(1)用移液管准确移入100.0(mol/m3)HAc溶液25.00ml,置于洁净,干燥的量杯中;测定其电导率3次,取平均值。
(2)再用移液管准确移入25.00ml已恒温的电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(3)用移液管准确移出25.00ml上述量杯中的溶液,弃去;再用移液管准确移入25.00ml电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(4)重复(3)的步骤。
(5)倾去电导池中的HAc溶液,用电导水洗净量杯和电极;然后注入电导水,测定其电导率3次,取平均值。
(6)倾去电导池中的电导水;量杯放回烘箱;电极用滤纸吸干。关闭电源。
五、数据记录与处理
1.数据记录:
大气压:100.40KPa; 室温: 27.5℃ ; 实验温度: 21.7℃;
已知数据:25℃下10.00(mol·m-3)KCl溶液电导率 = 0.1413 S·m-1;25℃时无限稀的HAc水溶液的摩尔电导率 = 0.03907(S·m2·mol -1)
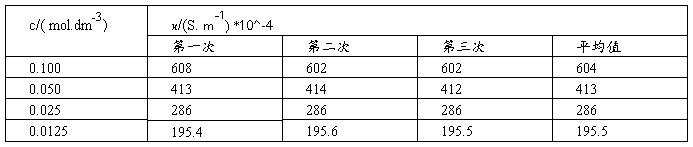
(1)测定KCl溶液的电导率
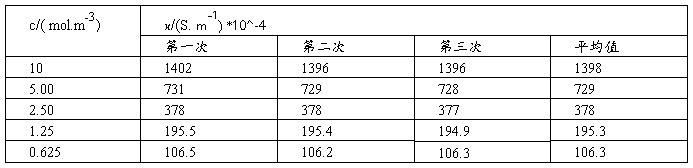
(2)测定HAc溶液的电导率
该条件下电导水的电导率 = 16.7μS/ cm
2. 数据处理
(1)将KCl溶液的各组数据填入下表内:
以KCl溶液的Λm对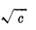 作图,由直线的截距求出KCl的
作图,由直线的截距求出KCl的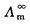
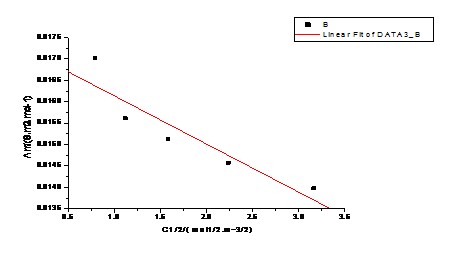
图-1 Λm—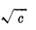 的关系图
的关系图
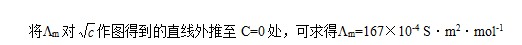
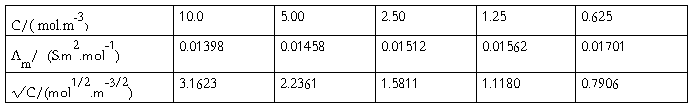
(2)HAc溶液的各组数据

由上表 CΛm对Λm -1作图应得一直线,直线的斜率为(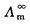 )2 KθCθ
)2 KθCθ
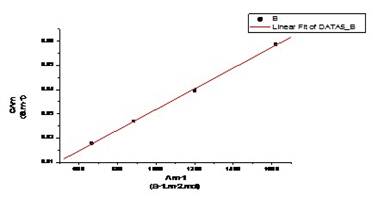
图-2  —
— 的关系图
的关系图
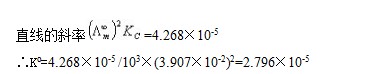
六、结果与讨论
1.电解质溶液导电主要与电解质的性质,溶剂的性质,测量环境的温度有关,所以测电导是要恒温。而电导池常数是一个不随温度变化的物理量,因此可以直接在不同的温度下使用。
2. 电解质的摩尔电导率随浓度增加而降低,原因是:对强电解质而言,溶液浓度降低,摩尔电导率增大,这是因为随着溶液浓度的降低,离子间引力变小,粒子运动速度增加,故摩尔电导率增大。对弱电解质而言,溶液浓度降低时,摩尔电导率也增加。在溶液极稀时,随着溶液浓度的降低,摩尔电导率急剧增加。
第二篇:电导的测定及其应用实验报告wqf
宁 波 工 程 学 院
物理化学实验报告
专业班级 姓名 序号 同组姓名 指导老师 实验日期 3月31号
实验名称 实验五 电导的测定及其应用
一、实验目的
1、测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率。
2、用电导法测量醋酸在水溶液中的解离平衡常数。
3、掌握恒温水槽及电导率仪的使用方法。
二、实验原理
1、电解质溶液的导电能力通常用点到G来表示,它的单位是西门子,用符号S(西)表示,若将某电解质溶液放入两平行电板之间,两电极之间的距离为l,电极面积为A,则电导率可表示为
 (1)
(1)
式中,k为电导率,电极间距离为l,电极面积为A,l/A为电导池常数Kcell,单位为m-1。
本实验是用一种已知电导率值的溶液先求出Kcell,然后把欲测溶液放入该电导池测出其电导值G,根据(1)式求出电导率k。
摩尔电导率与电导率的关系:
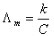 (2)
(2)
式中C为该溶液的浓度,单位为mol·m-3。
2、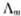 总是随着溶液的浓度降低而增大的。
总是随着溶液的浓度降低而增大的。
对强电解质稀溶液,
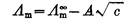 (3)
(3)
式中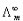 是溶液在无限稀释时的极限摩尔电导率。A为常数,故将
是溶液在无限稀释时的极限摩尔电导率。A为常数,故将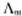 对
对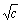 作图得到的直线外推至C=0处,可求得
作图得到的直线外推至C=0处,可求得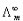 。
。
3、对弱电解质溶液,
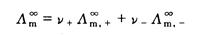 (4)
(4)
式中 、
、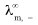 分别表示正、负离子的无限稀释摩尔电导率。
分别表示正、负离子的无限稀释摩尔电导率。
在弱电解质的稀薄溶液中,解离度与摩尔电导率的关系为:
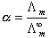 (5)
(5)
4、对于HAc,
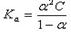 (6)
(6)
HAc的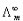 可通过下式求得:
可通过下式求得:
把(4)代入(1)得: 或
或
以C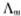 对
对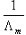 作图,其直线的斜率为
作图,其直线的斜率为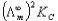 ,如知道
,如知道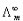 值,就可算出Ko
值,就可算出Ko
三、实验仪器、试剂
仪器:梅特勒326电导率仪1台,电导电极1台,量杯(50ml)2只,移液管(25ml)3只,洗瓶1只,洗耳球1只
试剂:10.00(mol·m-3)KCl溶液,100.0(mol·m-3)HAc溶液,电导水
四、实验步骤
1、打开电导率仪开关,预热5min。
2、KCl溶液电导率测定:
⑴用移液管准确移取10.00(mol·m-3)KCl溶液25.00 ml于洁净、干燥的量杯中,测定其电导率3次,取平均值。
⑵再用移液管准确移取25.00 ml电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
⑶用移液管准确移出25.00 ml上述量杯中的溶液,弃去;再准确移入25.00 ml电导水,只于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
⑷重复⑶的步骤2次。
⑸倾去电导池中的KCl溶液,用电导水洗净量杯和电极,量杯放回烘箱,电极用滤纸吸干
3、HAc溶液和电导水的电导率测定:
⑴用移液管准确移入100.0(mol·m-3)HAc溶液25.00 ml,置于洁净、干燥的量杯中,测定其电导率3次,取平均值。
⑵再用移液管移入25.00 ml已恒温的电导水,置于量杯中,搅拌均匀后,测定其电导率3次,取平均值。
⑶用移液管准确移出25.00 ml上述量杯中的溶液,弃去;再移入25.00 ml电导水,搅拌均匀,测定其电导率3次,取平均值。
⑷再用移液管准确移入25.00 ml电导水,置于量杯中,搅拌均匀,测定其电导率3次,取平均值。
⑸倾去电导池中的HAc溶液,用电导水洗净量杯和电极;然后注入电导水,测定电导水的电导率3次,取平均值。
⑹倾去电导池中的电导水,量杯放回烘箱,电极用滤纸吸干,关闭电源。
五、数据记录与处理
1、大气压:101.76kPa 室温:23.1℃ 实验温度:22.08℃
已知:25℃时10.00(mol·m-3)KCl溶液k=0.1413S·m-1;25℃时无限稀释的HAc水溶液的摩尔电导率=3.907*10-2(S·m2·m-1)
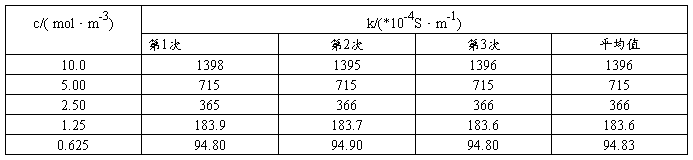
⑴测定KCl溶液的电导率:
⑵测定HAc溶液的电导率:
电导水的电导率k(H2O)/ (S·m-1):3.10*10-4S·m-1

2、数据处理
⑴将KCl溶液的各组数据填入下表内:

以KCl溶液的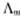 对
对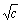 作图
作图
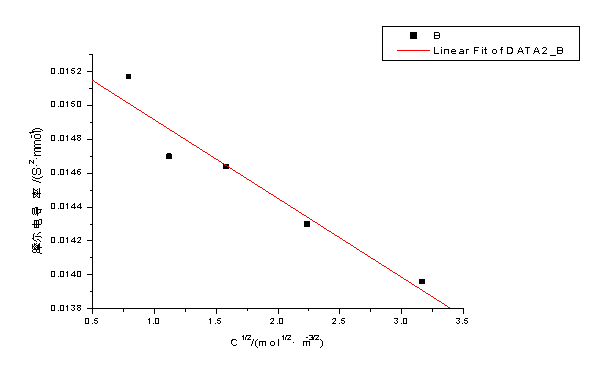
根据 ,截距即为
,截距即为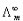 ,得
,得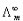 =151.5*10-4 S·m2·mol-1
=151.5*10-4 S·m2·mol-1
⑵HAc溶液的各组数据填入下表内:
HAc原始浓度:95.09 mol·m-3 k = k’- kH2O
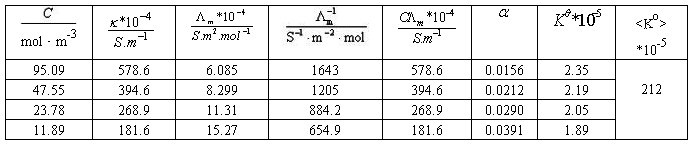
以C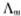 对
对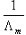 作图应得一直线,直线的斜率为
作图应得一直线,直线的斜率为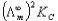 :
:

由图可知,直线的斜率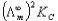 = 3.968*10-5,求的K=2.60*10-5
= 3.968*10-5,求的K=2.60*10-5
计算出来的值与画图做出来的相差:2.60*10-5-2.12*10-5=4.8*10-6
六、结果与讨论
1、溶液配制时是大浓度向小浓度稀释的。一旦某上一浓度出现偏差,则将影响到后面的浓度,因此在稀释时要及时小心,这也是影响实验准确性的一个很重要的因素。
2、对强电解质而言,溶液浓度降低,摩尔电导率增大,这是因为随着溶度浓度的降低,离子间引力变小,粒子运动速度增加,故摩尔电导率增大。
3、电解质溶液导电只要与电解质的性质,溶剂的性质,测量环境的温度有关。因为电解质溶液的电导与温度有关,温度的变化会导致电导的变化。实验中测电导池常数和溶液电导时的温度不需要一致,因为电导池常数是一个不随温度变化的物理量,因此可以直接在不同的温度下使用。
-
电导的测定及其应用实验报告
电导的测定及其应用一、实验目的1、测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率。2、用电导法测量醋酸在水溶液中的解离平衡常…
-
电导的测定及应用实验报告
实验名称一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电…
-
电导的测定及其应用实验报告
电导的测定及其应用一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒…
-
电导的测定及其应用实验报告
001520015000148YAxisTitle00146001440014200140XAxisTitle根据截距即为得154…
-
实验一:电导率的测定及其应用
物理化学实验报告专业班级YINGHUA姓名SANDY实验日期20xx年9月13日同组姓名XIAO指导老师LUO实验名称HAC电导的…
-
物化实验报告7-电动势的测定及应用
一实验目的1通过实验加深对可逆电池可逆电极盐桥等概念的理解2掌握对消法测定电池电动势的原理及电位差计的使用方法3通过电池AgAgN…
-
电导的测定及应用实验报告
实验名称一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电…
-
电导的测定及其应用实验报告wqf
宁波工程学院物理化学实验报告专业班级姓名序号同组姓名指导老师实验日期3月31号实验名称实验五电导的测定及其应用一实验目的1测量KC…
-
电导的测定及其应用实验报告
电导的测定及其应用一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒…
-
物化实验报告5-电导的测定及其应用
一实验目的1测量KCl水溶液的电导率求它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电导率仪的使…