电导的测定及其应用
实验名称:电导的测定及其应用 实验类型:________________同组学生姓名:__________
一、实验目的和要求(必填) 二、实验内容和原理(必填)
三、主要仪器设备(必填) 四、操作方法和实验步骤
五、实验数据记录和处理 六、实验结果与分析(必填)
七、讨论、心得
一、实验目的
1、理解溶液的电导、电导率和摩尔电导率的概念;
2、掌握电导率仪的使用方法;
3、掌握交流电桥测量溶液电导的实验方法及其应用。
二、实验原理
1. 弱电解质电离常数的测定
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数KC与原始浓度C和电离度α有以下关系:
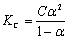 (1)
(1)
在一定温度下KC是常数,因此可以通过测定AB型弱电解质在不同浓度时的α代入(1)式求出KC,醋酸溶液的电离度可用电导法来测定。
将电解质溶液注入电导池内,溶液电导G的大小与两电极之间的距离l成反比,与电极的面积A成正比:
G=κA/l  (2)
(2)
式中,l/A为电导池常数,以Kcell表示;κ为电导率。
由于电极的l和A不易精确测量,因此实验中用一种已知电导率值的溶液,先求出电导池常数Kcell,然后把待测溶液注入该电导池测出其电导值,再根据(2)式求出其电导率。
溶液的摩尔电导率是指把含有1mol电解质的溶液置于相距为1m的两平行板电极之间的电导。以Λm表示,其单位为S·m2·mol-1。摩尔电导率与电导率的关系:
Λm=κ/C (3)
式中,C为该溶液的浓度,其单位为mol·m-3。
对于弱电解质溶液来说,可以认为:
α=Λm /Λm ∞ (4)
式中,Λm ∞是溶液在无限稀释时的摩尔电导率
把(4)代入(1)式可得:
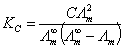 (5)
(5)
或
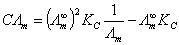 (6)
(6)
以CΛm对 1/Λm作图,其直线的斜率为 (Λm ∞ )2KC,若已知Λm ∞ 值,就可求算KC。
柯尔劳施根据实验得出强电解质稀溶液的摩尔电导率Λm与浓度有如下关系:

Λ∞m为无限稀释摩尔电导率。可见,以Λm对 作图得一直线,其截距即为Λ∞m。
作图得一直线,其截距即为Λ∞m。
2. CaF2(或BaSO4、PbSO4)饱和溶液溶度积(KSP)的测定
CaF2的溶解平衡可表示为:
CaF2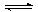 Ca2+ +2F-
Ca2+ +2F-
KSP = C(Ca2+)·[C(F-)]2 = 4C3 (7)
难溶盐的溶解度很小,饱和溶液的浓度则很低,所以(3)式中Λm可以认为就是 Λ ∞m (盐),C为饱和溶液中微溶盐的溶解度。
Λ ∞m (盐)=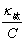 (8)
(8)
式中,κ盐是纯微溶盐的电导率。实验中所测定的饱和溶液的电导率值为盐与水的电导率之和。
κ溶液=κH2 O+κ盐 (9)
这样,可由测得的微溶盐饱和溶液的电导率利用(9)式求出κ盐,再利用(8)式求出溶解度,最后求出KSP。
惠斯登电桥是比较法测定电阻的仪器,它的基本线路如图1。实验中,通过调整电桥上的R3,使得通过其上的电流为零,即表明C点和D点的电势相等,可以等到如下关系:
R1 / Rx = R2 / R3 (10)
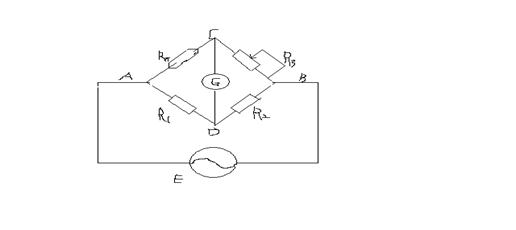
图1 交流电桥测定溶液电阻的简单线路图
三、主要仪器设备
仪器:音频振荡器1台;电导率仪;电导池2只;铂黑电极1支;转盘电阻箱3只;恒温槽装置1套;50mL移液管4支;100mL容量瓶4个;示波器1台;
试剂:KCl(10.0mol·m-3);HAc(100.0mol·m-3);CaF2(或BaSO4、PbSO4)(A.R.)。
四、操作方法和实验步骤
1、溶液的配制
用0.02mol/L的KCl溶液配制不同浓度的KCl溶液,其浓度分别为0.02、0.02/2、0.02/4、0.02/8、0.02/16。并分别做好标记,放入25℃的恒温槽中备用。
2、电路的连接
将恒温槽温度调至(25.0±0.1)℃或(30.0±0.1)℃,按照上图连接好电路图。注意需要按照电路图中ABCD四个点来连线。
3、测定不同浓度的KCl溶液的电阻
用电导水洗涤电导池和铂黑电极2~3次,然后注入电导水,将电极插入溶液中,按照浓度依次升高的顺序分别测定5个溶液的电阻值。恒温后测其电导(率)值,将电桥臂按照1:1、1:2、2:3三种形式进行测量。记录测定出来的数据。
4、用电导率仪来测定自来水和去离子水的电导率
首先对于使用高调还是低调进行估计和判断,如果电导率大于300×10-4S/m,则使用高调,反之则使用低调。在测量之前首先要校准,即在校准档将指针调至最大。测量时同样要注意从大量程向小量程调,最终达到精确。
【注意事项】
? 1、电导池不用时,应把两铂黑电极浸在蒸馏水中,以免干燥致使表面发生改变。
? 2、实验中温度要恒定,测量必须在同一温度下进行。恒温槽的温度要控制在(25.0±0.1)℃或(30.0±0.1)℃。
? 3、测定前,必须将电导电极及电导池洗涤干净,以免影响测定结果
五、实验数据记录和处理
室温:16.1℃;大气压:101.98kPa;25℃电导水的电导率κ(H2O)=1.50 uS·cm-1
表一 交流电桥测量溶液电导的数据记录
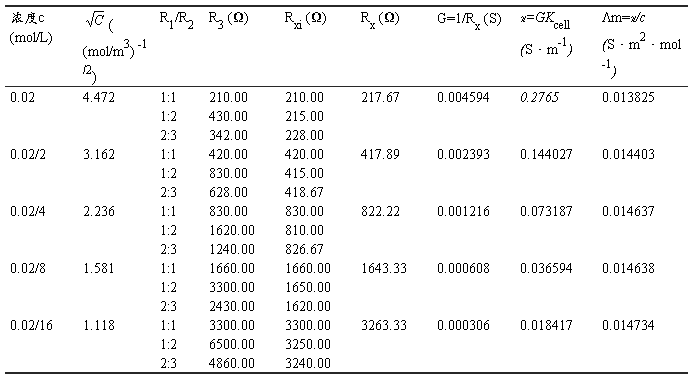
已知25℃时,0.02 mol/L KCl溶液的电导率κ=0.2765 S·m-1;
由表一知,此时G(KCl)= 0.004594 S;
由公式κ= GKcell得Kcell=60.187 m-1;
由公式Rx = (Rx1 + Rx2 + Rx3)/ 3; G = 1 / Rx; κ=GKcell; Λm=κ/c所得数据如表一。
由图2 可得Λ∞m = 0.01511 S·m2·mol-1
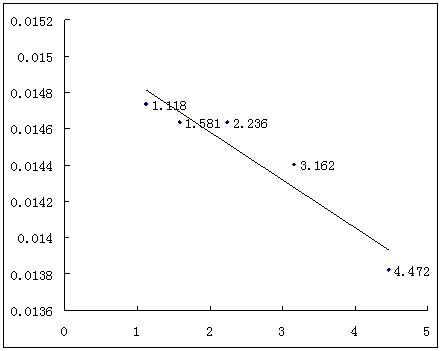
图2. Λm对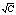 所作的图
所作的图
六、实验结果与分析
文献值:Λ∞m (文献)= 0.014979S·m2·mol-1
误差:E = (Λ∞m -Λ∞m (文献)) / Λ∞m (文献)*100% = 0.9%
误差分析:
1、溶液配制时产生的误差。
2、信号不明显,即某个电阻改变一个大阻值,其示波器的变化不大,导致误差的产生。
七、讨论、心得
实验心得:本实验是电导的测定及其应用,主要是掌握交流电桥测量溶液电导的实验方法,实验步骤较少,但实验操作时要小心谨慎,尤其在溶液配制的时候要极其小心,还有,在测定不同浓度的KCl溶液的电阻时要有耐心,尽量减小误差。
思考题:
1、如何定性地解释电解质的摩尔电导率随浓度增加而降低?
答:对强电解质而言,溶液浓度降低,摩尔电导率增大,这是因为随着溶液浓度的降低,离子间引力变小,粒子运动速度增加,故摩尔电导率增大。
对弱电解质而言,溶液浓度降低时,摩尔电导率也增加。在溶液极稀时,随着溶液浓度的降低,摩尔电导率急剧增加。
2、为什么要用音频交流电源测定电解质溶液的电导?交流电桥平衡的条件是什么?
答:使用音频交流电源可以使得电流处于高频率的波动之中,防止了使用直流电源时可能导致的电极反应,提高测量的精确性。
3、电解质溶液电导与哪些因素有关?
答:电解质溶液导电主要与电解质的性质,溶剂的性质,测量环境的温度有关。
4、为什么要测电导池常数?如何得到该常数?
答:要得到实验结果需用到公式κ= GKcell,而G可由实验得到,κ为待求量,所以必须测得电导池常数Kcell。Kcell = l/A,由于电极的l和A不易精确测量,因此实验中用一种已知电导率值的溶液,先求出电导池常数Kcell,然后把待测溶液注入该电导池测出其电导值,再根据(2)式求出其电导率。
5、测电导时为什么要恒温?实验中测电导池常数和溶液电导,温度是否要一致?
答:因为电解质溶液的电导与温度有关,温度的变化会导致电导的变化。实验中测电导池常数和溶液电导时的温度不需要一致,因为电导池常数是一个不随温度变化的物理量,因此可以直接在不同的温度下使用。
-
电导的测定及其应用实验报告
电导的测定及其应用一、实验目的1、测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率。2、用电导法测量醋酸在水溶液中的解离平衡常…
-
电导的测定及应用实验报告
实验名称一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电…
-
电导的测定及其应用实验报告
电导的测定及其应用一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒…
-
电导的测定及其应用实验报告wqf
宁波工程学院物理化学实验报告专业班级姓名序号同组姓名指导老师实验日期3月31号实验名称实验五电导的测定及其应用一实验目的1测量KC…
-
电导的测定及其应用实验报告
001520015000148YAxisTitle00146001440014200140XAxisTitle根据截距即为得154…
-
物化实验报告7-电动势的测定及应用
一实验目的1通过实验加深对可逆电池可逆电极盐桥等概念的理解2掌握对消法测定电池电动势的原理及电位差计的使用方法3通过电池AgAgN…
-
电导的测定及应用实验报告
实验名称一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电…
-
电导的测定及其应用实验报告wqf
宁波工程学院物理化学实验报告专业班级姓名序号同组姓名指导老师实验日期3月31号实验名称实验五电导的测定及其应用一实验目的1测量KC…
-
电导的测定及其应用实验报告
电导的测定及其应用一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒…
-
物化实验报告5-电导的测定及其应用
一实验目的1测量KCl水溶液的电导率求它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电导率仪的使…