微生物大小的测定-实验四
实验四 微生物大小的测定
一、实验目的
1.熟悉目测微尺和物测微尺的使用方法,掌握测定微生物大小的技能。
3.巩固光学显微镜的使用方法
二、实验要求
1.预习有关微生物大小测定等方面的知识;
2.遵守实验室安全制度,听从指导教师安排;
3.认真听讲,不懂就问;
4.完成实验报告
三、实验仪器和材料
目测微尺、物测微尺、光学显微镜、微生物标本片
四、实验原理及方法
1. 目测微尺:
目镜测微尺是一块圆形玻片,在玻片中央把5mm长度刻成50等分,或把10 mm长度刻成100等分。测量时,将其放在接目镜中的隔板上(此处正好与物镜放大的中间像重叠)来测量经显微镜放大后的细胞物象。由于不同目镜、物镜组合的放大倍数不相同,目镜测微尺每格实际表示的长度也不一样,因此目镜测微尺测量微生物大小时须先用置于镜台上的镜台测微尺校正,以求出在一定放大倍数下,目镜测微尺每小格所代表的相对长度。

2. 物测微尺
中央部分刻有精确等分线的载玻片,一般将1mm等分成100格,每格长0.01mm(即10µm)。它并不直接测细胞的大小,而是用于校正目镜测微尺每格的相对长度。
五、实验步骤及内容
1.目测微尺的标定
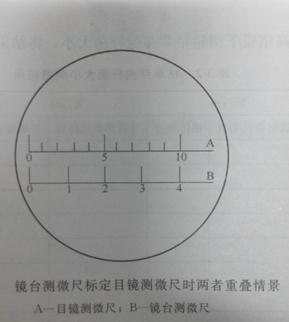
把物测微尺放在载物台上使刻度朝上。用低倍镜找到物测微尺的刻度,移动物测微尺和目测微尺使两者的第一条线重合,顺着刻度找出另一条重合线。再分别求出高倍镜和油镜下目测微尺每格的长度。
2.菌体大小的测量
将物测微尺取下,换上标本片,选择适当的物镜测量目的物的大小,分别找出菌体的长和宽占目测微尺的格数,再按目测微尺1格的长度算出菌体的长度和宽度。
六、实验结果
1.将目镜测微尺校正结果填入表1
表1 目镜测微尺校正结果

2. 在高倍镜下测量枯草芽孢杆菌大小 ,将结果填入表2
表2 枯草芽孢杆菌大小测量结果

七、思考题
1、不改变目镜和目镜测微尺,而改用不同倍数的物镜来测定同一细菌的大小,目镜测微尺上所量的物镜上物体的实际长度是否相同?为什么?
相似。因为会有误差
2、为什么更换不同放大倍数的目镜或物镜时,必须用镜台测微尺重新对目镜测微尺进行校正?
但是由于不同显微镜及附件的放大倍数不同,因此校正目镜测微尺必须针对特定的显微镜和附件(特定的物镜、目镜、镜筒长度)进行,而且只能在特定的情况下重复使用,故当更换不同放大倍数的目镜或物镜时,必须重新校正目镜测微尺每一格所代表的长度。
第二篇:实验九 微生物的大小及数量测定
实验九 微生物的大小及数量测定
摘要
通过显微测微尺测量酿酒酵母的长和宽,对其细胞体的大小有一个具体的了解;使用血球计数板对稀释n倍的酵母菌悬液进行细胞数量的测定,从而达到定量了解微生物的生长繁殖情况。
关键词
目镜测微尺 物镜测微尺 血球计数板
前言
微生物细胞的大小,是微生物重要的形态特征之一,也是分类鉴定的依据之一,也让我们对微生物的实际大小有了一个感性的认识。微生物数量的测定在微生物生长曲线中运用非常重要,我们从微生物的数量上了解其生长状况,这也能指导我们的工业生产。
一、实验目的
1、掌握测微尺、血球计数板的使用方法;
2、掌握微生物数量大小及数量测定方法。
二、实验原理
(一)微生物大小的测定
微生物细胞大小,是微生物的形态特征之一,也是分类鉴定的依据之一。由于菌体很小,只能在显微镜下测量。用来测量微生物细胞大小的工具有目镜测微尺和镜台测微尺。
镜台测微尺(图1a)是中央部分刻有精确等分线的载玻片。一般将1mm等分为100格,每格长度等于0.01mm(即106μm)。镜台测微尺并不直接用来测量细胞的大小,而是专用于校正目镜测微尺每格的相对长度。
目镜测微尺(图1b)是一块可放在接目镜内的隔板上的圆形小玻片,其中央刻有精确的刻度,有等分50小格或100小格两种,每5小格间有一长线相隔。由于所用目镜放大倍数和物镜放大倍数的不同,目镜测微尺每小格所代表的实际长度也就不同。因此,目镜测微尺不能直接用来测量微生物的大小。在使用前必须用镜台测微尺进行校正,以求得在一定放大倍数的接目镜和接物镜下该目镜测微尺每小格的相对值,然后才可用来测量微生物的大小。
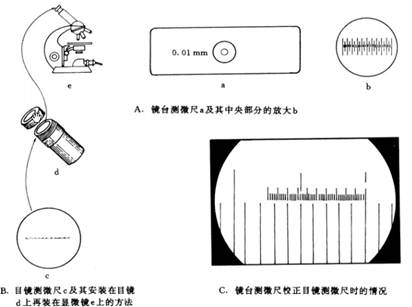
图1 测微尺及其安装和校正
(二)微生物数量的测定
显微镜直接计数法是将少量待测样品的悬浮液置于一种特别的具有确定面积和容积的载玻片上(又称计菌器)-显微镜下直接计数的一种简便、快速、直观的方法。目前国内外常用的计菌器有:血球计数板、Peteroff-Hauser计菌器以及Hawksley计菌器等,它们都可用于酵母、细菌、霉菌孢子等悬液的计数,基本原理相同。后两种计菌器由于盖上盖玻片后,总容积为0.02mm3,而且盖玻片和载波片之间的距离只有0.02mm,因此可用油浸物镜对细菌等较小的细胞进行观察和计数。除了用这些计菌器外,还有在显微镜下直接观察涂片面积与视野面积之比的估算法,此法一般用于牛乳的细菌学检查。显微镜直接计数法的优点是直观、快速、操作简单。但此法的缺点是所测得的结果通常是死菌体和活菌体的总和。目前已有一些方法可以克服这一缺点,如结合活菌染色微室培养(短时间)以及加细胞分裂抑制剂等方法来达到只计数活菌体的目的。本实验用血球计数板进行显微镜直接计数。
用血细胞计数板在显微镜下直接计数是一种常用的微生物计数方法。该计数板是一块特制的载玻片,其上由四条槽,构成三个平台;中间较宽的平台又被一短横槽隔成两半,每一边的平台上各列有一个方格网,每个方格网共分为九个大方格,中间的大方格即为计数室。血细胞计数板构造如图2。计数室的刻度一般有两种规格,一种是一个大方格分成25个中方格,而每个中方格又分成16个小方格;另一种是一个大方格分成16个中方格,而每个中方格又分成25个小方格(图2),但无论是哪一种规格的计数板,每一个大方格中的小方格都是400个。每一个大方格边长为1mm,则每一个大方格的面积为1mm2,盖上盖玻片后,盖玻片与载玻片之间的高度为0.1mm,所以计数室的容积为0.1mm3(万分之一毫升)。
计数时,通常数五个中方格的总菌数,然后求得每个中方格的平均值,再乘上25或16,就得出一个大方格中的总菌数,然后再换算成1ml菌液中的总菌数。
25个中方格的计数板,设5个中方格中的总菌数为A,菌液稀释倍数为B,则:1mL菌液中的总菌数=A/5×25×104×B=50000A·B(个)同理,16个中方格的计数板,1mL菌液中的总菌数=A/5×16×104×B=32000A·B(个)。


图2 血球计数板构造示意图
三、实验材料
1、菌种
酿酒酵母(Saccharomycescerevisiae)
2、仪器
显微镜,目镜测微尺,镜台测微尺,血球计数板,盖玻片,吸水纸,计数器、滴管,擦镜纸,酒精灯,接种环,试管等。
3.试剂
5%孔雀绿水溶液,香柏油,二甲苯,蒸馏水等。
四、实验步骤
1、目镜测微尺的校正及酵母大小的测定
A目镜测微尺的校正
目镜的上透镜旋下,将目镜测微尺的刻度朝下轻轻地装入目镜的隔板上,把镜台测微尺置于载物台上,刻度朝上。先用低倍镜观察,对准焦距,视野中看清镜台测微尺的刻度后,转动目镜,使目镜测微尺与镜台测微尺的刻度平行,移动推动器,使两尺重叠,再使两尺的“0”刻度完全重合,定位后,仔细寻找两尺第二个完全重合的刻度,计数两重合刻度之间目镜测微尺的格数和镜台测微尺的格数。因为镜台测微尺的刻度每小格长l0μm,所以由下列公式可以算出目镜测微尺每小格所代表的长度。
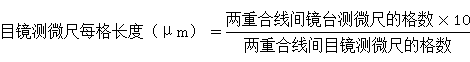
用此法分别校正在物镜倍数为10×,40×,100×下目镜测微尺每小格所代表的长度。
注意事项
由于不同显微镜及附件的放大倍数不同,因此校正目镜测微尺必须针对特定的显微镜和附件(特定的物镜、目镜、镜筒长度)进行,而且只能在特定的情况下重复使用,当更换不同放大倍数的目镜或物镜时,必须重新校正目镜测微尺每一格所代表的长度。
B酵母大小的测定
1) 制片:在载玻片中央滴一滴蒸馏水,用接种针在酵母菌悬液中蘸一下,涂
到蒸馏水中,干燥固定(自然干燥或在酒精灯上方来回移动载玻片),用孔雀绿染液覆盖涂菌部位1.5min—2min,自来水冲洗掉孔雀绿染液,对载玻片进行干燥。
2)酵母大小测定:移去镜台测微尺,换上酵母菌装片,先在低倍镜下找到目的物,然后在高倍镜下用目镜测微尺来测量酵母菌菌体的长,宽各占几格(不足一格的部分估计到小数点后一位数)。测出的格数乘上目镜测微尺每格的校正值,即等于该菌的长和宽。
3)由于不同细胞之间存在个体差异,在测定菌体细胞大小时随机选取三个细胞进行测量,然后计算平均值。
4)同样的方法,分别在40倍物镜和油镜下测定酵母菌的大小。
注意事项
测量菌体大小时要在同一个标本片上测定3个大小相近的菌体,求出平均值,才能代表该菌的大小。而且一般是用对数生长期的菌体进行测定。
测量完毕后取出目镜测微尺,将接目镜放回镜筒,再将目镜测微尺和镜台测微尺分别用擦镜纸擦拭干净,放回盒内保存。
2、酵母菌数量测定
(1)取洁净的血球计数板一块,在计数室上盖上一块盖玻片。
(2)将酵母菌菌悬液充分摇匀,用滴管吸取少许,从计数板中间平台两侧的沟槽内沿盖玻片的右上角滴入一小滴(不宜过多),使菌液沿两玻片之间自行渗入计数室,勿使产生气泡,并用吸水纸吸去沟槽中流出的多余菌液。
(3)先在低倍镜下找到计数室后,再转换高倍镜观察计数。
(4)计数时用25中格的计数板,要取上、下、左、右、中的5个中格(即80小格)的酵母菌数。由于菌体在计数室中处于不同的空间位置,要在不同的焦距下才能看到,因而观察时必须不断调节微调螺旋,方能数到全部菌体,防止遗漏。如菌体位于中格的双线上,计数时则数上线不数下线,数左线不数右线,以减少误差。
(5)样品最好重复计数2-3次(每次数值不应差过大,否则应重新操作),取其平均值,按下述公式计算出每毫升菌液所含酵母菌细胞数(25中格)。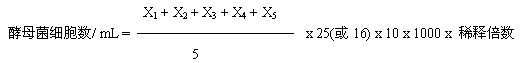
(6)血球计数板用后,在水龙头上用水柱冲洗干净,切勿用硬物洗刷或抹擦,以免损坏网格刻度。洗净后自行晾干或吹风机吹干。
五、实验报告
1、实验结果
(1)校正目镜测微尺
目镜测微尺校正结果

注:目镜放大倍数为10倍。
(2)酿酒酵母大小测定

(3)酿酒酵母计数结果

2.思考题
(1)为什么更换不同放大倍数的目镜或物镜,必须用镜台测微尺重新对目镜测微尺进行调节?
答:由于不同显微镜及附件的放大倍数不同,因此校正目镜测微尺必须针对特定的显微镜和附件(特定的物镜、目镜、镜筒长度)进行,而且只能在特定的情况下重复使用,当更换不同放大倍数的目镜或物镜时,必须重新校正目镜测微尺每一格所代表的长度。
(2)在不改变目镜和目镜测微尺,而改用不同放大倍数的物镜来测定同一细菌的大小时,其测定结果是否相同?为什么?
答:在不改变目镜和目镜测微尺,而改用不同放大倍数的物镜来测定同一细菌的大小时其结果不相同,因为物镜放大倍数不同,使得目镜测微尺每格代表的数值不同,精确度不一样,因此数值不同。
(3)结合实验体会,总结哪些因素会造成血细胞计数板的计数误差,应如何避免?
答:血细胞计数板计数时的误差来源: 计数室内有气泡将影响菌悬液随机分布而使计数产生误差,并且改变了菌悬液的总浓度(因为气泡占有一定的体积,使计算结果偏低);重复计数或遗漏。遇到有出芽的酵母菌计为两个。吸取菌液前,将酵母菌菌悬液充分摇匀,用滴管吸取少许,从计数板中间平台两侧的沟槽内沿盖玻片的右上角滴入一小滴(不宜过多),使菌液沿两玻片之间自行渗入计数室,勿使产生气泡;菌体在计数室中处于不同的空间位置,要在不同的焦距下才能看到,观察时必须不断调节微调螺旋,方能数到全部菌体,防止遗漏。
六、实验分析
在测量细菌大小的实验中,菌体的大小随菌龄和环境条件而异,或读数不准确均会造成误差。在显微镜计数的实验中,对菌液稀释时稀释倍数的不准确把握和实验的重复次数较少都会影响实验结果。
在对酵母菌菌悬液进行计数前,应该要静置一会儿,以免测定时菌体还在移动。并且,应该要用镊子轻轻的压盖玻片,以免每个小格里的微生物过饱和,给计数带来误差。计数时,第一次每格中的菌数过多,我们将菌悬液稀释后再用血球计数板进行计数,所得每小格中的菌数在正好在做要求的范围内,这样对于计数,既准确又方便。
七、实验小结
在对目镜测微尺进校正的时候,不同的倍数需要分别校正。但是也正是由于放大的倍数不一样,是使在校正的时候镜台测微尺的刻度线不断放大,也为最终的读数带来了一定的误差。因为放大的倍数越高,测量的越精确。所以用油镜测得的应该是最准确的。其中酵母菌大小的参考值为:1-5微米×5-30微米。
血细胞计数板计量酵母菌数量时,应注意位于格线上的菌体一般只数上方和左边线上的。如遇酵母出芽,都算或者都不算,计数规则要统一。为避免重复或遗漏计数,如菌体位于中格的双线上,计数时则数上线不数下线,数左线不数右线,以减少误差。
参考文献:
1.沈萍 陈向东.微生物实验[M].4版.高等教育出版社,2007.47-56页
-
微生物的大小及数量的测定
微生物试验报告山东大学生命科学学院09级生科四班张行润20xx00140177摘要通过显微测微尺测量酿酒酵母和枯草芽孢杆菌的直径或…
-
微生物大小及数量的测定
微生物大小及数量的测定微生物大小及数量的测定摘要本实验主要学习并掌握显微测微尺测定微生物大小的方法和如何使用血细胞计数板计量微生物…
-
实验五微生物大小的测定
实验五微生物大小的测定实验五微生物大小的测定一实验目的1学会测微尺的使用和计算方法2学习用测微尺对细菌和酵母菌的测量方法二实验内容…
-
微生物大小的测定 实验报告
实验四微生物大小的测定一目的学习并掌握测定微生物大小的原理和方法二材料1仪器显微镜测微尺挑针装有蒸馏水的滴瓶2菌种青霉镰刀菌三步骤…
-
微生物大小及数量的测定
20xx年11月30日姓名班级13级生命基地班学号同组者科目微生物学实验题目微生物大小及数量的测定组别3实验题目微生物大小及数量的…
-
微生物大小的测定 实验报告
实验四微生物大小的测定一目的学习并掌握测定微生物大小的原理和方法二材料1仪器显微镜测微尺挑针装有蒸馏水的滴瓶2菌种青霉镰刀菌三步骤…
-
第四组微生物大实验实验报告
微生物大实验土壤中芽孢杆菌的分离及鉴定实验报告学院生命科学学院专业生物技术班级组数学号姓名前言芽孢杆菌是能形成芽孢内生孢子的杆菌芽…
-
微生物大实验实验报告 (自动保存的)
中央民族大学生命与环境科学学院微生物综合性设计实验报告化学抑杀菌剂的效果评价Evaluationofbactericideeffe…
-
微生物大小和数量的测定
微生物大小和数量的测定一实验目的1了解显微镜测定微生物大小与血球计数板测定微生物数量的原理2学习并掌握显微镜下测定微生物细胞大小的…
-
微生物的大小及数量的测定
微生物试验报告山东大学生命科学学院09级生科四班张行润20xx00140177摘要通过显微测微尺测量酿酒酵母和枯草芽孢杆菌的直径或…