邻二氮菲分光光度法测定铁
邻二氮菲分光光度法测定微量铁
郭梦雨 20114049
四川农业大学 雅安 625014
摘要:本实验主要研究了Fe2+和邻二氮菲的最佳显色条件,包括显色时间、显色剂用量、溶液的酸度,并通过标准曲线法测定未知液中铁的含量。本测定方法不仅灵敏度高、稳定性好,而且选择性高。
关键词: 邻二氮菲;铁;分光光度计
Adjacent dinitrogen spectrophotometric method of determination of trace iron
Guo Mengyu 20114049
Sichuan agricultural university Yaan 625014
Abstract:This experiment mainly studied the Fe2 + and adjacent two nitrogen fe best chromogenic condition,including chromogenic time, dosage of chromogenic agent, acidity of solution.And through the standard curve method for determining the content of the unknown liquid iron. This method not only high sensitivity, good stability, and high selectivity.
Key Words: Adjacent two nitrogen fe . Iron. spectrophotometer
前言
邻二氮菲(又称邻菲罗啉)是测定微量铁的较好试剂,在pH=2~9的条件下,二价铁离子与试剂生成极稳定的橙红色配合物。该配合物的最大吸收峰在510nm处,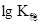 =21.3,摩尔吸光系数
=21.3,摩尔吸光系数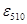 =11000 L·mol-1·cm-1。
=11000 L·mol-1·cm-1。
在显色前,用盐酸羟胺把三价铁离子还原为二价铁离子。
4Fe3++2NH2OH→4Fe2+ + N2O + 4H++ H2O
测定时,控制溶液的酸度在pH=5左右较为适宜,酸度高时,反应进行较慢,酸度太低,则Fe2+水解,影响显色。
本测定方法不仅灵敏度高,稳定性好,而且选择性高。
分光光度法测定物质含量时,通常要经过取样、显色及测量等步骤。为了使测定有较高的灵敏度和准确度,必须选择适宜的显色反应的条件和测量吸光度的条件,通常包括溶液的酸度、显色剂用量、显色时间、温度、溶剂以及共存离子干扰及其消除方法。测量吸光度的条件主要是测量波长、吸光度范围和参比溶液的选择。
1 实验部分
1.1仪器与试剂
1.1.1仪器:
721型723型分光光度计
500ml容量瓶1个,50 ml 容量瓶7个,10 ml 移液管1支,5ml移液管1支,1 ml 移液管1支,滴定管1 支,玻璃棒1 支,烧杯2 个,吸尔球1个, 天平一台。
1.1.2试剂:
(1)铁标准溶液100ug·ml-1,准确称取0.43107g铁盐NH4Fe(SO4)2·12H2O置于烧杯中,加入0.5ml盐酸羟胺溶液,定量转依入500ml容量瓶中,加蒸馏水稀释至刻度充分摇匀。
(2)铁标准溶液10ug·ml-1.用移液管移取上述铁标准溶液10ml,置于100ml容量瓶中,并用蒸馏水稀释至刻度,充分摇匀。
(3)盐酸羟胺溶液100g·L-1(用时配制)
(4)邻二氮菲溶液 1.5g·L-1 先用少量乙醇溶液,再加蒸馏水稀释至所需浓度。
(5)醋酸钠溶液1.0mol·L-1μ
1.2实验步骤
1.1.1 吸收曲线的绘制
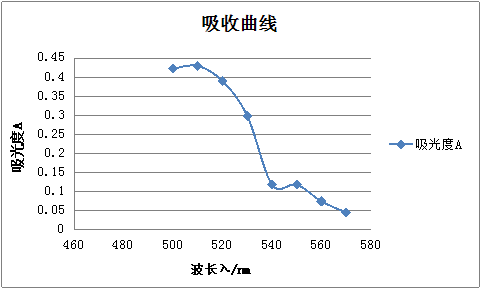
用吸量管准确吸取10 μg·mL-1铁标准溶液5mL,置于25 mL容量瓶中,加人100g/L盐酸羟胺溶液0.5 mL,摇匀后加人1mol·L-l醋酸钠溶液2.5 mL和1g/L邻二氮菲溶液1.5mL,以水稀释至刻度,摇匀。放置10min,在分光光度计上,用l cm比色皿,以水为参比溶液,用不同的波长,从570~430 nm,每隔20 nm测定一次吸光度,以波长为横坐标,吸光度为纵坐标绘制出吸收曲线,从吸收曲线上确定进行测定铁的适宜波长(即最大吸收波长)。
1.1.2 测定条件的选择
(1)邻二氮菲与铁的配合物的稳定性
用上面溶液继续进行测定,其方法是,在最大吸收波长510 nm处,每隔一定时间测定其吸光度,即在加人显色剂后立即测定一次吸光度,经30 min,60 min,90min,120min后,再各测一次吸光度,以时间(t)为横坐标,吸光度(A)为纵坐标,绘制A-t曲线,从曲线上判断配合物稳定的情况。
(2)显色剂浓度的影响
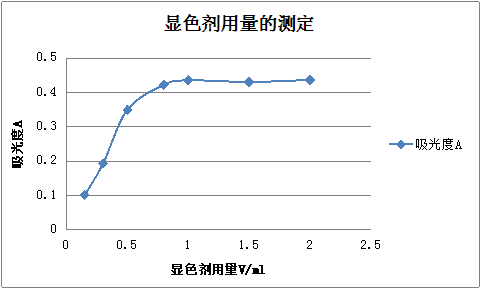
取25 mL容量瓶7个,用吸量管准确吸取10 μg·mL-1铁标准溶液5 mL于各容量瓶中,加人100g/L盐酸羟胺溶液0.5mL摇匀,经2min后再加入l mol·L-1醋酸钠2.5 mL,1g/L邻二氮菲溶液0.15,0.30,0.50,0.80,1.00,l.50和2.0mL,用水稀释至刻度,摇匀。放置10min,在分光光度计上,用最大吸收波长(510 nm),1 cm比色皿,以水为参比,测定上述各溶液的吸光度。然后以邻二氮菲试剂加人体积为横坐标,吸光度为纵坐标,绘制A一V曲线,由曲线上确定显色剂最佳加人量。
(3)溶液酸度对配合物的影响
准确吸取100μg·mL-1铁标准溶液5mL置于100 mL容量瓶中,加人2 mol·L-1盐酸5 mL和100g/L盐酸羟胺溶液10 mL,摇匀经2 min后,再加人1g/L邻二氮菲溶液30 mL,以水稀释至刻度,摇匀,备用。
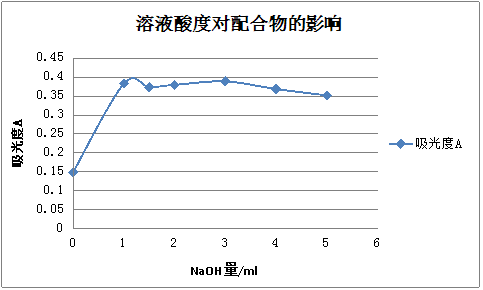
取25 mL容量瓶7个,编号,用吸量管分别准确吸取上述溶液10 mL于各容量瓶中,在滴定管中0.4 mol·L-1氢氧化钠溶液,在7只容量瓶中依次加人0.0mL,l.0mL,1.5mL,2.0mL,3.0mL,4.0mL及5.0mL,以水稀释至刻度,摇匀,使各溶液的pH≤2开始逐步增加至l2以上。放置10min,在分光光度计上,用最大吸收波长(510 nm),l cm比色皿,水为参比测定各溶液的吸光度。最后以氢氧化钠加入量为横坐标,吸光度为纵坐标,绘制曲线,由曲线上确定最适宜的pH范围。
(4)根据上面条件实验的结果,找出邻二氮菲分光光度法测定铁的测定条件并讨论之。
1.1.3铁含量的测定
(1) 标准曲线的绘制
取25 mL容量瓶6个,分别准确吸取的10μg·mL-l铁标准溶液0.0,1.0,2.0,3.0,4.0和5.0 mL于各容量瓶中,各加100g/L盐酸羟胺溶0.5mL,摇匀,经2 min后再加1mol·L-l醋酸钠溶液2.5mL和1g/L邻二氮杂菲溶液1.5 mL,以水稀释至刻度,摇匀。在分光光度计上用l cm比色皿,在最大吸收波长(510 nm)处测定各溶液的吸光度,以铁含量为横坐标,吸光度为纵坐标,绘制标准曲线。
(2)未知液中铁含量的测定
吸取未知液10mL代替标准溶液,按上述标准曲线相同条件和步骤测定其吸光度。根据未知液吸光度,在标准曲线上查出未知液相对应铁的量,然后计算试样中微量铁的含量,以每升未知液中含铁多少克表示(g·L-1)。
2 数据分析
2.1吸收曲线的绘制

2.2测定条件的影响
2.2.1显色时间的影响

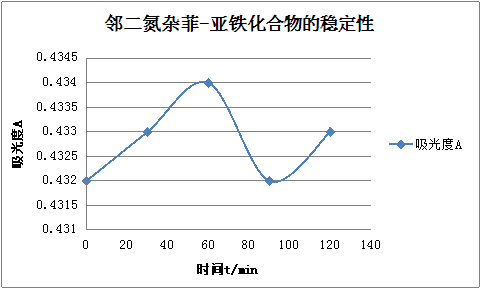
2.2.2显色剂浓度的影响

2.2.3溶液酸度对配合物的影响

2.3铁含量的测定
2.3.1标准曲线的绘制

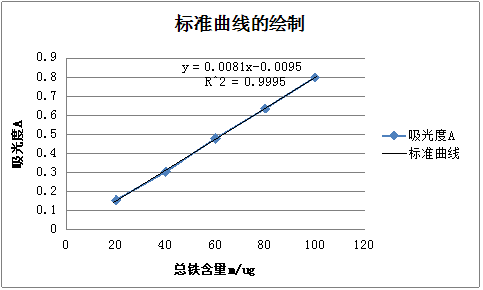
2.3.2未知液中铁含量的测定
由上述标准曲线可得,未知液的吸光度为0.440,由图表可知未知液的铁的含量为60ug,即6mg/ml
1、 摩尔吸光系数计算
在标准曲线的直线部分选择量两点,读取对应的坐标值,计算邻二氮菲配位物在最大吸收波长出的摩尔吸光系数: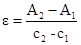
ε=(A2-A1)/(c2-c1)=(0.461—0.233)/(0.06×10-3—0.03×10-3)=0.76×104L/(mol·cm)
3 实验讨论
3.1分光光度计的使用注意事项
(1)测定系列标准溶液和样品溶液时,必须使用同一只比色皿。
(2)比色皿放入分光光度计样品室前,必须使用吸水纸将外表面擦拭干净。
(3)比色皿在换装不同浓度溶液时,必须使用待测溶液润洗至少三次。
(4)在比色皿未放入分光光度计测定光路时,必须将样品室舱打开。
3.2在使用分光计时,使用同一标样,测同一溶液但就会得出不同的值。这可能有几个原因:a、温度,b、长时间使用机器,使得性能降低,所以商量得不同值。
3.3 铁标准液的选择问题
部颁标准规定, 制作标准曲线时应用浓度为0.010mg/L 的Fe2+标准工作液。经验证明, 此标准液极不稳定, 使用期很短, 浓度降低很快, 改用浓度增加10 倍的0.10mg/L的Fe2+标准液, 克服了原标准液的缺陷, 但在移取时因用量减少, 操作必须仔细、准确。
3.4 2mol/LHCl溶液的使用问题
部颁标准中规定, 做标准曲线和测样时都需加入2mol/LHCl溶液5mL.由于过量强酸的加入, 使得显色液呈强酸性, 从而偏离最佳显色酸度, 即使加入缓冲液也无济于事。根据反复试验, 在做标准曲线时, 盐酸轻胺提供的酸性足以使加入NaAc 缓冲液后的p H值落在最佳值范围。测定试液时, 视其预处理情况或碱性大小而定。
3.5 定容问题
先于一定量标准液或试液中依次加入各种试剂, 因浓度较大(溶液体积小),显色反应迅速彻底, 定量准确。按部颁标准, 则体积大,浓度小, 反应不彻底, 转化不完全, 将带来负偏差。
3.6 共存离子的干扰问题
为了验证该法的选择性, 特做干扰试验。结果表明, 相当于铁含量40 倍的Ca2+、Mg2+ 、Zn2+, 2 0 倍的C r3+ 、M n2+ , 5 倍的Co2= 、Cu2+ , Ni+ 均不干扰测定(吸光度值与不含杂质离子时基本相同, 一般在0.404 一0.407之间) 。可见本法选择性很高, 很适应于测定含杂较多的水样及化工原料和产品中微量总铁。
3.7其他注意事项
(1)显色时,加入还原剂、缓冲溶液、显色剂的顺序不可颠倒,以防产生反应后影响操作结果。
(2)测定有色溶液的稳定性所用的时间较长。在进行此实验时,可穿插进行其他实验。
(3)系列浓度铁标准溶液的配置和吸光度测定应和未知液同时进行。
参考文献
[1]、《分析化学实验》第三版 四川大学化工系、浙江大学化学系
[2]、《无机及分析化学实验》 王仁国
[3]、徐斌.邻二氮菲吸光光度法测定总铁含量试验研究.大氮肥。1996
致谢
特别感谢吴明君老师的精心指导!
第二篇:邻二氮杂菲分光光度法测定铁
分析化学实验报告
邻二氮杂菲分光光度法测定铁
一.实验目的
1.了解分光光度法测定物质含量的一般条件及其选定方法
2.掌握邻二氮杂菲分光光度法测定铁的方法
3.了解722型分光光度计的构造和使用方法
二.实验原理
1.光度法测定的条件:分光光度法测定物质含量时应注意的条件主要是
显色反应的条件和测量吸光度的条件。显色反应的条件有显色剂用量、介质的酸度、显色时溶液温度、显色时间及干扰物质的消除方法等;测量吸光度的条件包括应选择的入射光波长,吸光度范围和参比溶液等。
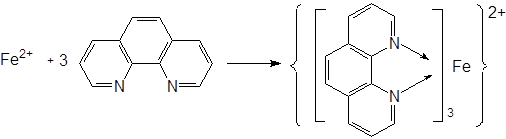
2.在PH=2-9的条件下,Fe2+与邻二氮杂菲(o-ph)生成极稳定的橘红色配合物,反应式如下: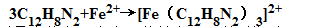
此配合物的lgK稳=21.3 摩尔吸收系数ε510 =1.1×104
在显色前,首先用盐酸羟胺把Fe2+ 还原成Fe3+.其反应式如下:
2Fe 3+ +2NH 2 OH· HC1 =2Fe 2+ +N 2 ↑+2H 2 O+4H + +2C1-
测定时,控制溶液酸度在PH=5左右较为适宜。酸度过高时,反应进行较慢;酸度太低,则Fe 2+水解,影响显色。
三.实验步骤
1.条件实验
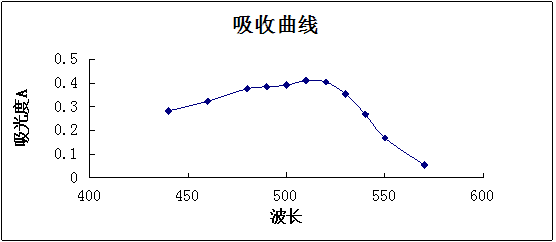
(1)吸收曲线的测绘准确吸取20 μg·mL-1铁标准溶液5 mL于50 mL容量瓶中,加入5%盐酸羟胺溶液1 mL,摇匀,加入1 mol·L-1NaOAc溶液5 mL和0.1%邻二氮杂菲溶液3 mL。以水稀释至刻度,摇匀。放置10 min,在722型分光光度计上,用1 cm比色皿,以水为参比溶液,波长从570 nm到430 nm为止,每隔10 nm测定一次吸光度。如图1所示,其最大吸收波长为510 nm,故该实验选择测定波长为510 nm。
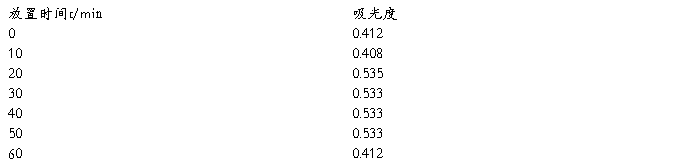
(2)邻二氮杂菲-亚铁配合物的稳定性
用上面溶液继续进行测定,其方法是在最大吸收波长510 nm处,每隔一定时间测定其吸光度,及再加入显色剂后立即测定一次吸光度,经10、20、30、120 min后,再各测一次吸光度。
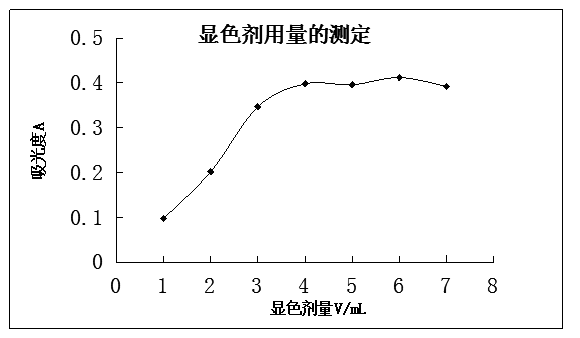
(3)显色剂浓度实验 取50 mL容量瓶7只,编号。每只容量瓶中准确加入20 ug·mL-1铁标准溶液5 mL以及1mL5%盐酸羟胺溶液,经2 min后。再加入5 mL1 mol·L-1NaOAc溶液,然后分别加入0.1%邻二氮杂菲溶液0.3mL、0.6mL、1.0 mL、1.5 mL、2.00 mL、3.0 mL和4.0 mL,用水稀释至刻度,摇匀,在分光光度计上,用最大吸收波长510 nm、1 cm比色皿,以水为参比,测定上述溶液的吸光度。
2.铁含量的测定
(1)标准曲线的绘制 取50mL容量瓶6只,编号。分别吸取20 μg·mL-1铁标准溶液2.0mL、4.0 mL、6.0 mL、8.0 mL和10.0 mL于5只容量瓶中,另一只容量瓶中不加标准溶液(配制空白溶液,作参比)。然后各加5%盐酸羟胺溶液,摇匀,经2 min后,再各加5 mL1 mol·L-1NaAc溶液及3 mL1 g·L-1邻二氮杂菲溶液,以水稀释至刻度线,摇匀。放置10 min,在分光光度计上,用1 cm比色皿,在510 nm处,测定各溶液的吸光度。以铁含量为横坐标,吸光度为纵坐标,绘制标准曲线。
(2)未知液中铁含量的测定 吸取5ml未知液代替标准溶液,其他步骤均同上测定吸光度。由未知液的吸光度在标准曲线上查出5ml未知液中的铁含量,然后以每毫升未知液中含铁多少微克表示结果。
四.记录与计算
(1)吸收曲线的测绘

(2)邻二氮杂菲-亚铁配合物的稳定性
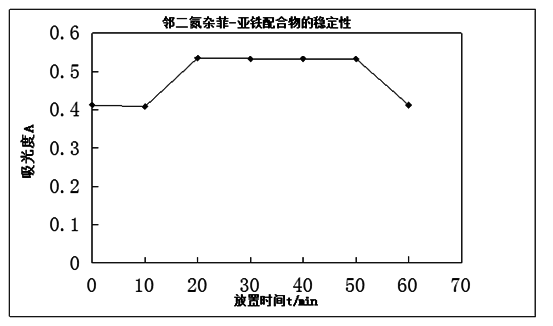
(3)显色剂用量的测定

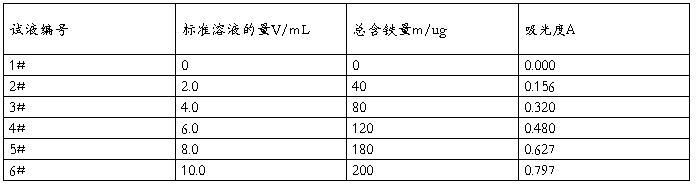
(4)标准曲线的测绘与铁含量的测定
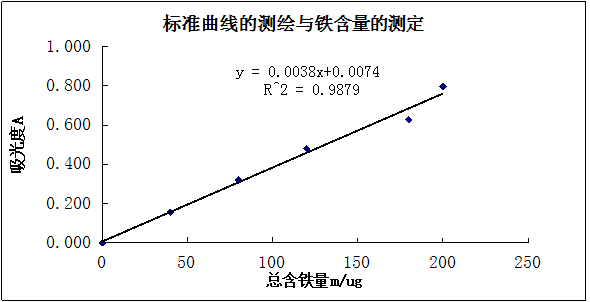
未知液的吸光度为0.282,由图表可知未知液中铁的含量为17/ml
讨论:
1.如用配置已久的盐酸羟胺溶液,对分析结果将带来什么影响?
答:盐酸羟胺是用来将Fe3+还原成Fe2+的,如果配制已久,还原能力减弱,就会使部分铁离子得不到还原,造成分析结果偏小
2.邻二氮杂菲分光光度法测定铁的适宜条件是什么?
答:测定时,要控制PH=5左右较好,弱酸度较高,反应速度较慢,酸度较低,会使二价铁离子水解,影响显色
3. 为什么要用邻二氮菲显色后再测定?
答:因为水中微量组分较少,对光的吸收很小,无法测出其吸光光度,加入显色剂后,与被测组分形成络合物,摩尔吸收系数较高,吸光明显,容易测定。
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
邻二氮菲分光光度法测定水中微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学会吸收曲线及标准曲线的绘制了解分光光度法的基本原理2掌握用邻二氮菲分光光度法测定微量铁的…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁日期20xx318实验者曾惜20xx222702合作者曾子夜20xx222702一实验目的和要求1掌握…
-
邻二氮杂菲分光光度法测定铁 实验报告
分析化学实验报告实验题目邻二氮杂菲分光光度法测定铁学院专业食品科学与工程班级姓名学号同组者姓名一实验目的1了解分光光度法测定物质含…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法3…
-
邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理2掌握TU19xx分光光度…
-
邻二氮菲分光光度法测定水中微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学会吸收曲线及标准曲线的绘制了解分光光度法的基本原理2掌握用邻二氮菲分光光度法测定微量铁的…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁日期20xx318实验者曾惜20xx222702合作者曾子夜20xx222702一实验目的和要求1掌握…