邻二氮菲分光光度法测定微量铁
第二篇:邻二氮菲分光光度法测定微量铁实验报告
实验一、邻二氮菲分光光度法测定微量铁
20##级医学检验 3组 吴茳铃 2009221885
实验目的和要求
1、 掌握紫外可见分光光度计的基本操作;
2、 掌握邻二氮菲分光光度法测定微量铁的原理和方法;
3、 掌握吸收曲线绘制及最大吸收波长选择;
4、 掌握标准曲线绘制及应用。
实验原理
邻二氮菲(1,10—邻二氮杂菲)是一种有机配位剂,可与Fe2+形成红色配位离子
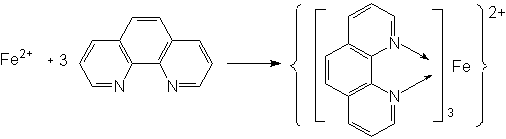
在pH=3~9范围内,该反应能够迅速完成,生成的红色配位离子在510nm波长附近有一吸收峰,摩尔吸收系数为1.1×104,反应十分灵敏,Fe2+ 浓度与吸光度符合光吸收定律,适合于微量铁的测定。
实验中,采用pH=4.5-5的缓冲溶液保持标准系列溶液及样品溶液的酸度;采用盐酸羟胺还原标准储备液及样品溶液中的Fe3+并防止测定过程中Fe2+被空气氧化。
实验仪器与试剂
1. 752S型分光光度计 2. 标准铁储备溶液(1.00×10-3mol/L) 3. 邻二氮菲溶液(0.15%,新鲜配制) 4. 盐酸羟胺溶液(10%,新鲜配制) 5. NaAC缓冲溶液
6. 50ml容量瓶7个 8.1cm玻璃比色皿2个 9. 铁样品溶液
实验步骤
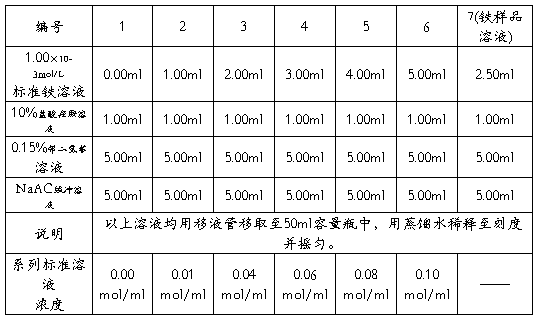
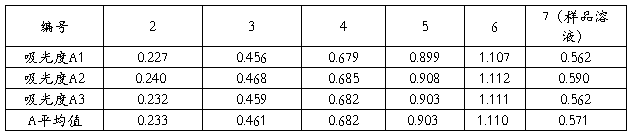
1、 标准系列溶液及样品溶液配制,按照下表配制铁标准系列溶液及样品溶液。
2、 吸收曲线绘制
用1cm比色皿,以1号溶液作为参比溶液,测定4号溶液在各个波长处的吸光度,绘制吸收曲线,并找出最大吸收波长。
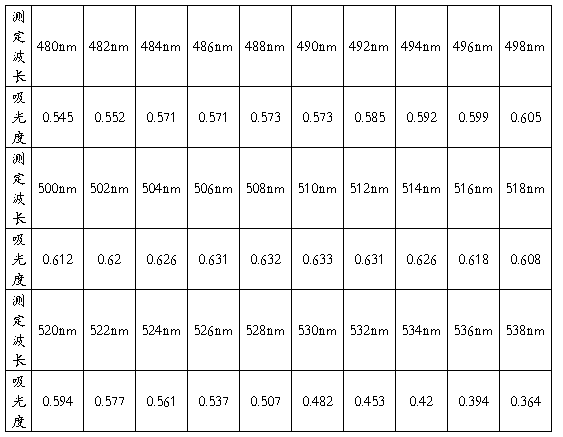
绘图如下:
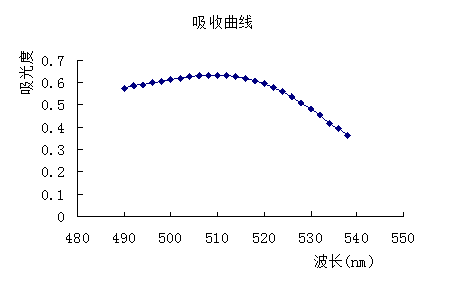
选择的最大吸收波长为:λmax = 510nm
3、 标准曲线制作
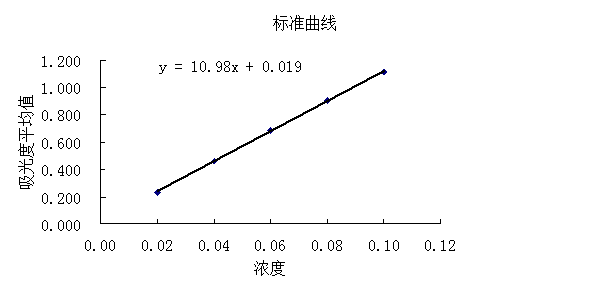
在选定最大吸收波长处,用1cm比色皿,以1号溶液作为参比溶液,分别测定2至7号溶液的吸光度,平行测定3次,计算吸光度平均值,绘制标准曲线。
绘制标准曲线:
实验数据处理
1、 样品中铁的计算
Cx=C读取值×50.00/2.50=0.05×20=1×10-3(mol/L)
2、 摩尔吸光系数计算
在标准曲线的直线部分选择量两点,读取对应的坐标值,计算邻二氮菲配位物在最大吸收波长出的摩尔吸光系数:
ε=(A2-A1)/(c2-c1)=(0.461—0.233)/(0.04×10-3—0.02×10-3)=1.14×104L/(mol·cm)
实验讨论
1、 查资料红色配位物的摩尔吸光系数与实验计算一致,影响成败的关键可能有:标准液和样品液的配置不准、分光光度计使用不当。
2、 比色皿在换装不同浓度的溶液时,必须用待测的溶液润洗至少三次。
3、 注意分光光度计的正确操作。
4、 PH值影响配位物的解离程度,故缓冲液要适量。
5、 比色皿放入分光光度计样品室钱,必须用吸收纸将表面擦拭干净。
指导老师:颜玉蓉 时间:2011 年10月
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁一实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法3…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁一实验目的1学习确定实验条件的方法和测定微量铁的分光光度法2掌握TU19xx型双光束紫外可见分光光度计…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法3…
-
邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理2掌握TU19xx分光光度…
-
邻二氮菲分光光度法测定水中微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学会吸收曲线及标准曲线的绘制了解分光光度法的基本原理2掌握用邻二氮菲分光光度法测定微量铁的…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁日期20xx318实验者曾惜20xx222702合作者曾子夜20xx222702一实验目的和要求1掌握…