邻二氮杂菲分光光度法测定铁
邻二氮杂菲分光光度法测定铁
应用化学 20##级 杨兰森
指导老师 吴明君 副教授
摘要:本文论述了邻二氮杂菲分光光度法测定铁含量的原理和方法,先通过条件实验找到适宜的实验条件,再在确定的适宜条件下测定已知浓度的铁样以绘制标准曲线,最后在确定的适宜条件下测定未知浓度的铁样,通过对照标准曲线得出未知溶液的铁含量
关键字:邻二氮杂菲 分光光度法 标准曲线
Determination of iron content by Spectrophotometric method
Yang Lansen Student ID20096842 Apply Chemistry
Directed by WU Mingjun
Abstract: This paper discusses phenanthroline spectrophotometric determination of iron content of the principles and methods, first through the conditions of experiments to find suitable experimental conditions, and then determine the appropriate conditions in a known concentration of iron-like determination to draw a standard curve, and finally Conditions in determining the appropriate determination of the unknown concentration of iron samples obtained by comparison with standard curve of the iron content of the unknown solution
Keywords: phenanthroline spectrophotometric standard curve
1 综述
分光光度法:也叫吸光光度法,是基于物质对光的选择性吸收而建立起来的分析方法,包括可见及紫外分光光度法及红外分光光度法等。本实验采取可见光区的吸光光度法。
在可见光分光光度法的测定中,通常是将被测物与显色剂反应,使之生成有色物质,然后测其吸光度,进而求得被测物质的含量。因此,显色条件的完全程度和吸光度的测量条件都会影响到测量结果的准确性。为了使测定有较高的灵敏度和准确性,必须选择适宜的显色反应条件和仪器测量条件。通常所研究的显色反应条件有显色温度和时间,显色剂用量,显色液酸度,干扰物质的影响因素及消除等,但主要是测量波长和参比溶液的选择。对显色剂用量和测量波长的选择是该实验的内容。
条件试验的一般步骤为改变其中一个因素,暂时固定其他因素,显色后测量相应溶液吸光度,通过吸光度与变化因素的曲线来确定适宜的条件。
本试验测定工业盐酸中铁含量的原理:根据朗伯-比耳定律:A=εbc。当入射光波长λ及光程b一定时,在一定浓度范围内,有色物质的吸光度A与该物质的浓度c成正比。只要绘出以吸光度A为纵坐标,浓度c为横坐标的标准曲线,测出试液的吸光度,就可以由标准曲线查得对应的浓度值,即工业盐酸中铁的含量。
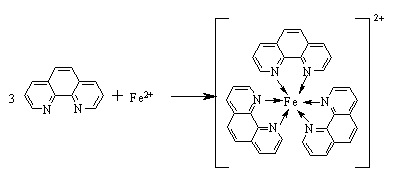
邻二氮菲法的优点:用分光光度法测定试样中的微量铁,目前一般采用邻二氮菲法,该法具有高灵敏度、高选择性,且稳定性好,干扰易消除等优点。⒌邻二氮菲法简介: 邻二氮菲为显色剂,选择测定微量铁的适宜条件和测条件,并用于工业盐酸中铁的测定。
邻二氮菲可测定试样中铁的总量的条件和依据:邻二氮菲亦称邻菲咯啉(简写phen),是光度法测定铁的优良试剂。在pH=2~9的范围内,邻二氮菲与二价铁生成稳定的桔红色配合物((Fe(phen)3)2+)。此配合物的lgK稳 = 21.3,摩尔吸光系数ε510 = 1.1×104 L·mol-1·cm-1,而Fe3+能与邻二氮菲生成3∶1配合物,呈淡蓝色,lgK稳=14.1。所以在加入显色剂之前,应用盐酸羟胺(NH2OH·HCl)将Fe3+还原为Fe2+,其反应式如下:2 Fe3+ + 2 NH2OH·HCl → 2Fe2+ + N2 + H2O + 4H+ + 2Cl-,测定时控制溶液的酸度为pH≈5较为适宜。
1 实验目的
1了解分光光度法测定物质含量的一般条件及其选定方法 。
2掌握邻二氮杂菲分光光度法测定铁的方法
3了解722型分光光度计的构造和使用方法
2 实验原理
邻二氮菲(phen)和Fe2+在pH3~9的溶液中,生成一种稳定的橙红色络合
物Fe(phen) 32+,其lgK=21.3,κ508=1.1 × 104L·mol-1·cm-1,铁含量在0.1~6μg·mL-1范围内遵守比尔定律。其吸收曲线如图1-1所示。显色前需用盐酸羟胺或抗坏血酸将Fe3+全部还原为Fe2+,然后再加入邻二氮菲,并调节溶液酸度至适宜的显色酸度范围。有关反应如下:
2Fe3++2NH2OH·HC1=2Fe2++N2↑+2H2O+4H++2C1-
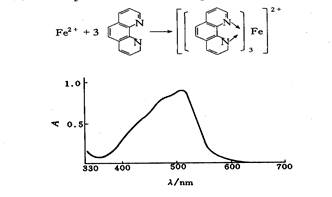
图1-1 邻二氮菲一铁(Ⅱ)的吸收曲线
用分光光度法测定物质的含量,一般采用标准曲线法,即配制一系列浓度的
标准溶液,在实验条件下依次测量各标准溶液的吸光度(A),以溶液的浓度为横
坐标,相应的吸光度为纵坐标,绘制标准曲线。在同样实验条件下,测定待测溶
液的吸光度,根据测得吸光度值从标准曲线上查出相应的浓度值,即可计算试样中被测物质的质量浓度。
3仪器与试剂
仪器:分光光度计,容量瓶,移液管,洗瓶。
试剂:(1) 100 ug/mL铁标准溶液
(2) 20 ug/mL的铁标准溶液
4实验步骤
4.1条件实验
(1) 吸收曲线的测绘 用吸量管移取20 ug/mL 铁的标准溶液 5.00 mL 于 50 mL 容量瓶中,用吸量管依次加入 5% 的盐酸羟胺溶液 1 mL,摇匀,加 1 mol/L NaAc 溶液 5 mL和0.1% 邻二氮菲溶液 3 mL,以水稀释至刻度,摇匀。在分光光度计上用 l cm 比色皿,以水为参比溶液,在570-430 nm 之间,每隔 10 nm 测定一次吸光度,以波长为横坐标,吸光度为纵坐标,绘制吸收曲线,找出最大吸收波长 ?max 。
(2) 邻二氮杂菲-亚铁配合物的稳定性
在最大吸收波长处每隔一定时间测定其吸光度然后以时间为横坐标,吸光度为纵坐标绘制曲线
(3 ) 显色剂浓度实验
取 7 只 50 mL 容量瓶,并且对其编号用吸量管依次加入 20 ug/mL的铁标准溶液 5mL 与容量瓶中和 5% 盐酸羟胺溶液 1 mL,摇匀,经二分钟后,加入 1 mol/L NaAc 溶液 5 mL,然后分别加入 0.1% 的邻二氮菲溶液0.3 mL,0.6 mL, 1.0 mL,2.0 mL,3.0 mL ,4.0 mL,以水稀释至刻度,摇匀。在分光光度计上,用 l cm 比色皿,在适宜波长下,以水为参比溶液,测定以上七个溶液的吸光度。以邻二氮菲的体积 (mL) 为横座标,相应的吸光度为纵座标,绘制吸光度-显色剂用量曲线,找出在测定中应加人的显色剂的体积(mL)。
(4)溶液适宜酸度范围的确定 在7只50 mL容量瓶中各加入2.0 mL10-3 mol·L-1。铁标准溶液和1.0 mL 100 mol·L-1盐酸羟胺溶液,摇匀后放置2 min。各加2 mL 1.5 g·L-1邻二氮菲溶液,然后从滴定管中分别加入0,2.00,5.00,8.00,10.00,20.00,25.00,30.00,40.00 mL 0.1 mol·L-1NaOH溶液摇匀,以水稀释至刻度,摇匀。用精密pH试纸或酸度计测量各溶液的pH。
以水为参比,在选定波长下,用1 cm吸收池测量各溶液的吸光度。绘制A—pH曲线,确定适宜的pH范围。
4.2铁含量的测定
标准曲线的测绘:去50 mL容量瓶6只,分别移取(务必准确移取)20 ug/mL铁标准溶液2.0 mL,4.0 mL,6. 0mL ,8.0 mL ,10.0 mL于五只容量瓶中不加铁标准溶液醅空白液作参比,然后各加1MOL5%盐酸羟胺溶液,摇匀经二分钟后,再各加5ML1MOL.L-1NaAc溶液及3ML0.1%邻二氮杂菲溶液,用水稀释至刻度摇匀在分光光度计上,一同1cm比色皿在最大吸收波长510nm处测定各溶液吸光度,以铁含量为横坐标,吸光度为纵坐标绘制标准曲线。
未知液中铁含量的测定 ,吸取5ML未知液代替标准溶液,其他步骤均同上,测定吸光度,由未知液吸光度在标准曲线上查出5ML未知液中铁含量然后以每毫升未知液中含铁多少微克表示结果。
5.结果与讨论
(1) 吸收曲线的测绘
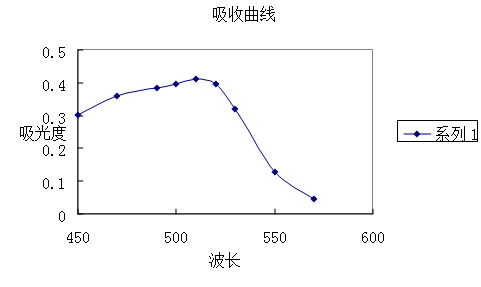

从吸收曲线可以看出邻二氮杂菲-亚铁配合物在波长510nm处吸光度最大,因此测定铁时宜用波长为510nm。
(2)邻二氮杂菲-亚铁配合物的稳定性
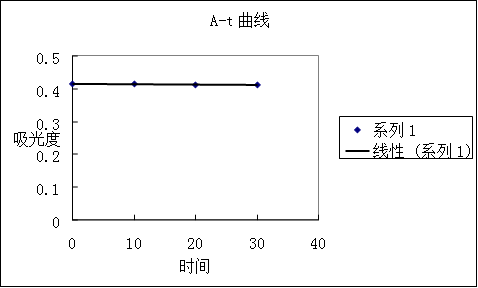

邻二氮杂菲-亚铁配合物吸光度随时间变化不大,说明其稳定型很好。
(3)显色剂用量的确定

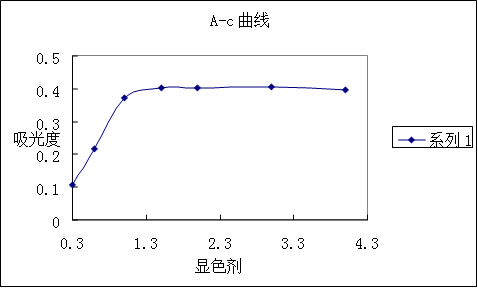

显色剂最适宜的用量应是吸光度较大而用量较小的点,由图看出显色剂最适宜用量为1mL。
(4)标准曲线的测绘与铁含量的测定
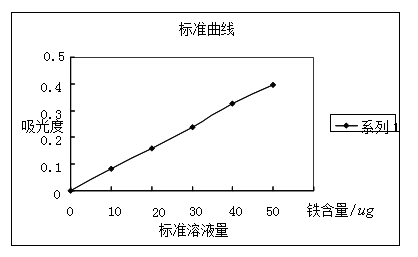
图中标准曲线近似一条直线,从该曲线可以测定未知液中铁的含量。
(5)实验结果:
1.在条件实验确定的适宜条件下测得未知液吸光度为A=0.328.比照标准曲线,标准曲线回归方程为y=0.0092x-0.0094,将A=0.328代入得铁含量为36.665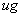 ,
,
所以未知液铁含量为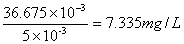
2.茶叶灰中铁含量测定,称取茶叶灰为0.3957g,在条件实验确定的适宜条件下测得吸光度A=0.396,代入线性回归方程得铁含量为44.065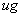 ,所以茶叶灰中铁含量为
,所以茶叶灰中铁含量为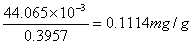
结论
结合实验数据及结果,精密度及误差在允许范围内,满足分析实验要求,说明该实验方法可行度大,有一定重现性,结果满意。
致谢
此次实验是在吴明君老师的精心指导下完成的,在此衷心感谢吴老师!
参考文献
[1]:《分析化学实验》第三版(高等教育出版社)
[2]:《分析化学》.武汉大学.(高等教育出版社)
[3]:宋天佑,程鹏,王杏乔.《无机化学》.(高等教育出版社)
第二篇:邻二氮杂菲分光光度法测定铁 实验报告


分析化学实验报告
实验题目:
邻二氮杂菲分光光度法测定铁
学 院:
专 业: 食品科学与工程
班 级:
姓 名:
学 号:
同组者姓名:
一.实验目的
1.了解分光光度法测定物质含量的一般条件及其选定方法
2.掌握邻二氮杂菲分光光度法测定铁的方法
3.了解722型分光光度计的构造和使用方法
二.实验原理
1.光度法测定的条件:分光光度法测定物质含量时应注意的条件主要是
显色反应的条件和测量吸光度的条件。显色反应的条件有显色剂用量、介质的酸度、显色时溶液温度、显色时间及干扰物质的消除方法等;测量吸光度的条件包括应选择的入射光波长,吸光度范围和参比溶液等。
2.在PH=2-9的条件下,Fe2+与邻二氮杂菲(o-ph)生成极稳定的橘红色配合物,反应式如下:
此配合物的lgK稳 =21.3 摩尔吸收系数ε510 =1.1×104
在显色前,首先用盐酸羟胺把Fe2+ 还原成Fe3+.其反应式如下:
2Fe 3+ +2NH 2 OH· HC1 =2Fe 2+ +N 2 ↑+2H 2 O+4H + +2C1-
测定时,控制溶液酸度在PH=5左右较为适宜。酸度过高时,反应进行较慢;酸度太低,则Fe 2+水解,影响显色。
三、实验仪器
分光光度计、容量瓶、移液管、洗瓶
四、实验步骤
1.条件实验
(1)吸收曲线的测绘准确吸取20 μg·mL-1铁标准溶液5 mL于50 mL容量瓶中,加入5%盐酸羟胺溶液1 mL,摇匀,加入1 mol·L-1NaOAc溶液5 mL和0.1%邻二氮杂菲溶液3 mL。以水稀释至刻度,摇匀。放置10 min,在722型分光光度计上,用1 cm比色皿,以水为参比溶液,波长从570 nm到430 nm为止,每隔10 nm测定一次吸光度。如图1所示,其最大吸收波长为510 nm,故该实验选择测定波长为510 nm。
(2)邻二氮杂菲-亚铁配合物的稳定性
用上面溶液继续进行测定,其方法是在最大吸收波长510 nm处,每隔一定时间测定其吸光度,及再加入显色剂后立即测定一次吸光度,经10、20、30、120 min后,再各测一次吸光度。
(3)显色剂浓度实验 取50 mL容量瓶7只,编号。每只容量瓶中准确加入20 ug·mL-1铁标准溶液5 mL以及1mL5%盐酸羟胺溶液,经2 min后。再加入5 mL1 mol·L-1NaOAc溶液,然后分别加入0.1%邻二氮杂菲溶液0.3mL、0.6mL、1.0 mL、1.5 mL、2.00 mL、3.0 mL和4.0 mL,用水稀释至刻度,摇匀,在分光光度计上,用最大吸收波长510 nm、1 cm比色皿,以水为参比,测定上述溶液的吸光度。
2.铁含量的测定
(1)标准曲线的绘制
取50mL容量瓶6只,编号。分别吸取20 μg·mL-1铁标准溶液2.0mL、4.0 mL、6.0 mL、8.0 mL和10.0 mL于5只容量瓶中,另一只容量瓶中不加标准溶液(配制空白溶液,作参比)。然后各加5%盐酸羟胺溶液,摇匀,经2 min后,再各加5 mL1 mol·L-1NaAc溶液及3 mL1 g·L-1邻二氮杂菲溶液,以水稀释至刻度线,摇匀。放置10 min,在分光光度计上,用1 cm比色皿,在510 nm处,测定各溶液的吸光度。以铁含量为横坐标,吸光度为纵坐标,绘制标准曲线。
(2)未知液中铁含量的测定
吸取5ml未知液代替标准溶液,其他步骤均同上测定吸光度。由未知液的吸光度在标准曲线上查出5ml未知液中的铁含量,然后以每毫升未知液中含铁多少微克表示结果。
五、记录与计算
(1)吸收曲线的测绘

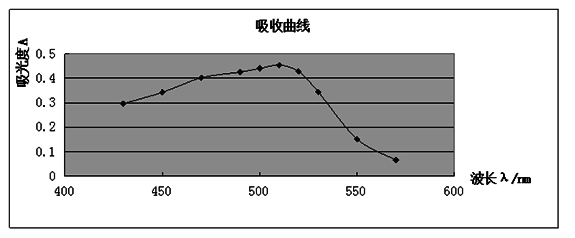
讨论:从曲线可以看出,在一定范围内,当波长较小时,随波长增加吸光度增加。测定的适宜波长是510nm。
(2)邻二氮杂菲亚铁配合物的稳定性

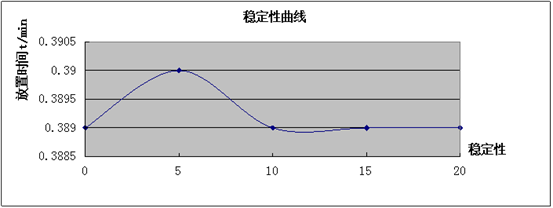 讨论:从曲线可以看出,配合物稳定性较好。
讨论:从曲线可以看出,配合物稳定性较好。
(3) 显色剂用量的测定


讨论:当显色剂较小时,随显色剂含量增加吸光度增加,当加入显色剂为1.5ml吸光度最大。所以显色剂的适宜加入的量为1.5ml
(4)标准曲线的测绘与铁含量的测定

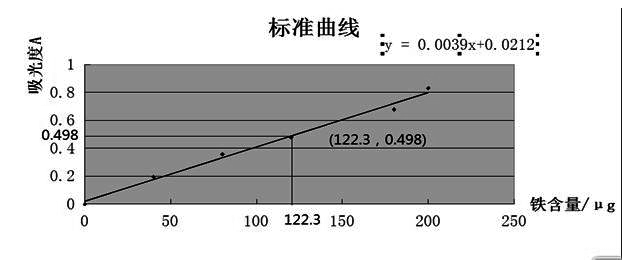
讨论;由测定的未知液吸光度为0.498通过函数关系可得铁的含量为122.3m/μg
讨论:
1.再用分光光度计测量显色剂量不同时的吸光度时应注意什么?
答:再用分光光度计测量显色剂量不同时的吸光度时,应保持用一个比色皿测量,这样可以减小比色皿自身对实验产生的影响。
2.如用配置已久的盐酸羟胺溶液,对分析结果将带来什么影响?
答:盐酸羟胺是用来将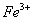 还原成
还原成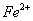 的,如果配制已久,还原能力减弱,就会使部分铁离子得不到还原,造成分析结果偏小
的,如果配制已久,还原能力减弱,就会使部分铁离子得不到还原,造成分析结果偏小
3.邻二氮杂菲分光光度法测定铁的适宜条件是什么?
答:测定时,要控制PH=5左右较好,弱酸度较高,反应速度较慢,酸度较低,会使二价铁离子水解,影响显色
4.为什么要用邻二氮菲显色后再测定?
答:因为水中微量组分较少,对光的吸收很小,无法测出其吸光光度,加入显色剂后,与被测组分形成络合物,摩尔吸收系数较高,吸光明显,容易测定。
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
邻二氮菲分光光度法测定水中微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学会吸收曲线及标准曲线的绘制了解分光光度法的基本原理2掌握用邻二氮菲分光光度法测定微量铁的…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁日期20xx318实验者曾惜20xx222702合作者曾子夜20xx222702一实验目的和要求1掌握…
-
邻二氮菲分光光度法测定铁
实验十九分光光度法测定微量铁一实验目的1了解分光光度计的构造和使用方法2了解邻二氮菲光度法测定铁的实验条件掌握和了解实验条件的一般…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法3…
-
邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理2掌握TU19xx分光光度…
-
邻二氮菲分光光度法测定水中微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学会吸收曲线及标准曲线的绘制了解分光光度法的基本原理2掌握用邻二氮菲分光光度法测定微量铁的…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁日期20xx318实验者曾惜20xx222702合作者曾子夜20xx222702一实验目的和要求1掌握…