邻二氮菲分光光度法测定微量铁实验

摘要:本文采用邻二氮菲分光光度法,该方法具有灵敏度高、操作简单、重现性好等特定,效果令人满意
关键词:邻二氮菲 分光光度法 微量铁测量 吸光度
目录
1.实验部分... 4
1.1实验原理... 4
1.2仪器和试剂... 5
1.3实验内容... 5
1.3.1配制10ug/ml铁标准溶液... 5
1.3.2配制标准溶液和待测液... 5
1.3.3吸收曲线的绘制... 5
1.3.4标准曲线的绘制... 6
1.3.5未知铁溶液的测定... 6
1.4实验数据处理... 6
1.4.1吸收曲线的绘制... 6
1.4.2标准曲线的绘制... 6
2.结论与思考... 7
3.参考资料... 7
铁与人类的生活密切相关,也是维持人体新陈代谢必不可少的微量元素之一,是构成血红蛋白、肌红蛋白以及多种酶的重要成分,若缺少铁,可影响血红蛋白、肌红蛋白的合成,使某些酶的活性降低,引起人体生理上的变化,导致免疫力下降,智力降低和机体抗感染能力降低等各种疾病的产生。铁广泛的存在于各类动物性和植物性食品当中,如动物的肝脏、全血、肉类、蛋类、枣、苹果、山楂、木耳、海藻等食品中都含有大量铁,此外部分果汁、牛奶、酸奶中也含有微量铁。因此对于微量铁的检测尤为重要,目前测定微量铁的方法主要有分光光度法、荧光法、原子吸收法,本文采用邻二氮菲分光光度法,邻二氮菲是一种显色剂,在pH=2.0~9.0的溶液中能与Fe2+形成橙红色络合物,该方法具有灵敏度高、操作简单、重现性好等特定,效果令人满意。
1.实验部分
1.1实验原理
邻二氮菲(Phen)是测定二价铁离子的一种高高灵敏度、高选择性显色试剂,在pH=2.0~9.0的溶液中能与Fe2+形成橙红色络合物Fe(Phen)32+,反应方程式如下:

此络合物的lgK稳θ=21.3(20 0C),摩尔吸光系数εmax=1.1×104L·mol-1·cm-1。稳定性常数2.0×1021,铁含量在0.1~6μg·ml-1范围内遵循比尔定律。在还原剂存在下,颜色可以保持几个月不变。
邻二氮菲可与Fe3+生成配位比为3:1的淡蓝色配合物,其稳定性常数为1.2×1014,因此在使用邻二氮菲测定铁时,显色前应先用还原剂如盐酸羟胺(NH2OH·HCl)或对苯二酚将Fe3+全部还原为Fe2+。本文采用盐酸羟胺为还原剂,还原反应为:
4Fe3++2NH2OH===4Fe2++4H++N2O+H2O
其显色反应的适宜pH范围很宽,且其色泽与pH无关,但酸度高时反应进行较慢,酸度低时二价铁离子会水解,所以为避免Fe2+水解及其他杂质的影响并且保持较高的反应速率,通常在pH约为5~6的HAc—NaAc缓冲介质中进行测定。
利用分光光度法进行定量测定时,通常选择吸光物质的最大吸收波长λmax作为入射波长,因此时测得的摩尔吸收系数最大,即测定的灵敏度最高。测定吸光物质在不同波长下的吸光度A,绘制A—λ吸收曲线,即可求得该吸光物质的最大吸收波长λmax。
标准曲线法是定量测定中最常使用的方法。先配制一系列不同浓度的被测物质的标准溶液,在选定的条件下显色,在最大吸收波长下测定其相应的吸光度,绘制A—c标准曲线。根据朗伯—比尔定律:A=κbc,标准曲线应为一条斜率为κb的过原点的直线。另取试液经适当处理后,在与上述相同的条件下显色、测定,由测得的吸光度从标准曲线上求出被测物质的含量。
1.2仪器和试剂
1.仪器:722型分光光度计 50ml容量瓶7只 吸量管(10ml两支、5ml两支、1ml一支) 比色皿(10mm、20mm各一) 移液管(1ml两支、2ml一支、5ml一支) 电子天平
2.试剂: 铁标准溶液(100.0 μg/ml)
邻二氮菲溶液(1.5g/L)
盐酸(6mol/L)
盐酸羟胺溶液(100g/L)
HAc—NaAc缓冲溶液(pH=4.6)
未知浓度铁待测液
1.3实验内容
1.3.1配制10ug/ml铁标准溶液
用移液管量取5.00ml铁标准溶液于50ml容量瓶中,酸化后定容,摇匀。
1.3.2配制标准溶液和待测液
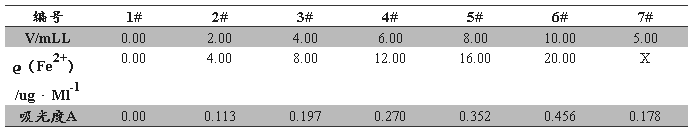
在序号为1~6的6只50ml容量瓶中用吸量管分别加入0.00、2.00、4.00、6.00、8.00、10.00ml10ug/ml铁标准溶液,均加入1.0ml盐酸羟胺溶液,摇匀放置2min后,各加入2.0ml邻二氮菲溶液、5ml HAc—NaAc缓冲溶液,加水稀释,定容,摇匀,放置10min。
用吸量管加入5.00ml待测溶液于7号容量瓶中,加入1.0ml盐酸羟胺溶液,摇匀放置2min后,加入2.0ml邻二氮菲溶液、5.0ml HAc—NaAc缓冲溶液,加水稀释,定容,摇匀,放置10min。
1.3.3吸收曲线的绘制
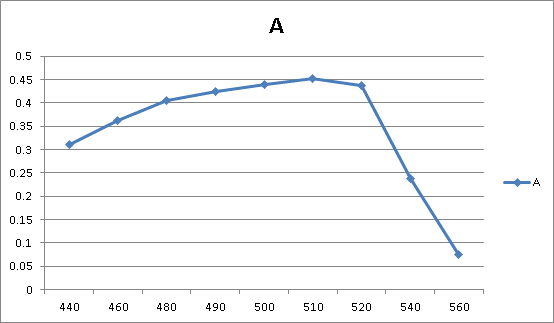
使用1cm吸收池,以1号空白溶液为参比,用分光光度计分别在440、460、480、490、500、510、520、540、560nm波长测定6好溶液的吸光度A并记录之,绘制A—λ吸收曲线图,求出最大波长λmax。
1.3.4标准曲线的绘制
在选定的波长下以1号空白溶液为参比分别测定2~6号的吸光度A并记录,绘制A—c标准曲线图。
1.3.5未知铁溶液的测定
测定7号待测溶液的吸光度在A—c标准曲线图中查找出对应的浓度。
1.4实验数据处理
1.4.1吸收曲线的绘制
实验步骤1.3.3数据见表一
表一

绘制的吸收曲线如图一
图一
1.4.2标准曲线的绘制
实验步骤1.3.4数据见表二
表二
绘制的标准曲线如图二
图二
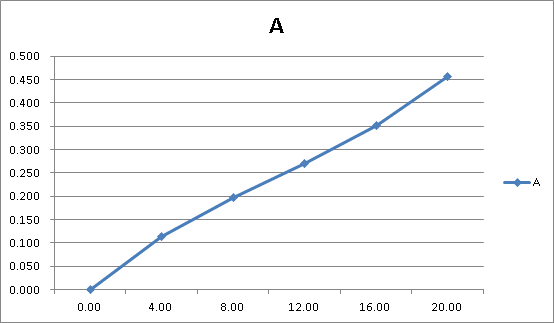
根据标准曲线得出待测溶液的浓度约为6.9ug/ml
2.结论与思考
实验结果表明邻二氮菲分光光度法能够准确的测定未知样品中的铁含量,相对误差小于1.6%,操作方法简单,结果令人满意。在实验过程中学习了分光光度计的使用方法,学会了测绘吸收曲线的方法,掌握了利用标准曲线法进行微量成分测定的基本原理与方法。
3.参考资料
[1]韩晓霞.赵堂.基础化学实验[M].宁夏:宁夏人民教育出版社.2012.8
[2]倪静安.高世萍.李运涛.郭敏杰.无机及分析化学实验[M].北京:高等教育出版社.2007.2
[3]胡小明.潘自红.分光光度法测定发样中的微量铁[J].广州:广州化工.2012.3
[4]孙宁.化学实验与学生能力的培养[J].上海:上海教育.2005.3
[5]李涛. 邻二氮菲分光光度法测定微量铁对照实验[J].江苏:南京化工职业技术学院学报.2012.3
第二篇:邻二氮菲分光光度法测定铁 一、实验原理
邻二氮菲分光光度法测定铁
一、实验原理
邻二氮菲(phen)和Fe2+在pH3~9的溶液中,生成一种稳定的橙红色络合物Fe(phen) 32+,其lgK=21.3,κ508=1.1 × 104L·mol-1·cm-1,铁含量在0.1~6μg·mL-1范围内遵守比尔定律。其吸收曲线如图1-1所示。显色前需用盐酸羟胺或抗坏血酸将Fe3+全部还原为Fe2+,然后再加入邻二氮菲,并调节溶液酸度至适宜的显色酸度范围。有关反应如下:
2Fe3++2NH2OH·HC1=2Fe2++N2↑+2H2O+4H++2C1
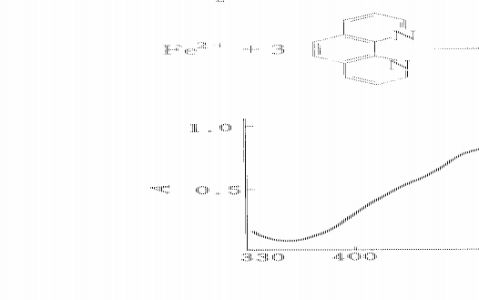
-
图1-1 邻二氮菲一铁(Ⅱ)的吸收曲线
用分光光度法测定物质的含量,一般采用标准曲线法,即配制一系列浓度的标准溶液,在实验条件下依次测量各标准溶液的吸光度(A),以溶液的浓度为横坐标,相应的吸光度为纵坐标,绘制标准曲线。在同样实验条件下,测定待测溶液的吸光度,根据测得吸光度值从标准曲线上查出相应的浓度值,即可计算试
样
中被测物质的质量浓度。
二、仪器和试剂
1.仪器 721或722型分光光度计。
2.试剂
(1)0.1 mg·L-1铁标准储备液 准确称取0.702 0 g NH4Fe(S04)2·6H20置于烧杯中,加少量水和20 mL 1:1H2S04溶液,溶解后,定量转移到1L容量瓶中,用水稀释至刻度,摇匀。
(2)10-3 moL-1铁标准溶液 可用铁储备液稀释配制。
(3)100 g·L-1盐酸羟胺水溶液 用时现配。
(4)1.5 g·L-1邻二氮菲水溶液 避光保存,溶液颜色变暗时即不能使用。 (5)1.0 mol·L-1叫乙酸钠溶液。
(6)0.1 mol·L-1氢氧化钠溶液。
三、实验步骤
1.显色标准溶液的配制 在序号为1~6的6只50 mL容量瓶中,用吸量管分别加入0,0.20,0.40,0.60,0.80,1.0 mL铁标准溶液(含铁0.1 g·L-1),分别加入1 mL 100 g·L-1盐酸羟胺溶液,摇匀后放置2 min,再各加入2 mL 1.5 g·L-1邻二氮菲溶液、5 mL 1.0 mol·L-1乙酸钠溶液,以水稀释至刻度,摇匀。
2.吸收曲线的绘制 在分光光度计上,用1 cm吸收池,以试剂空白溶液(1号)为参比,在440~560 nm之间,每隔10 nm测定一次待测溶液(5号)的吸光度A,以波长为横坐标,吸光度为纵坐标,绘制吸收曲线,从而选择测定铁的最
大吸收波长。
3.显色剂用量的确定 在7只50 mL容量瓶中,各加2.0 mL 10-3 mol·L-1铁标准溶液和1.0 mL 100 g·L-1盐酸羟胺溶液,摇匀后放置2 min。分别加入0.2,0.4,0.6,0.8,1.0,2.0,4.0 mL 1.5 g·L-1邻二氮菲溶液,再各加5.0 mL1.0 mol·L-1 乙酸钠溶液,以水稀释至刻度,摇匀。以水为参比,在选定波长下测量各溶液的吸光度。以显色剂邻二氮菲的体积为横坐标、相应的吸光度为纵坐标,绘制吸光度-显色剂用量曲线,确定显色剂的用量。
4.溶液适宜酸度范围的确定 在9只50 mL容量瓶中各加入2.0 mL10-3 mol·L-1。铁标准溶液和1.0 mL 100 mol·L-1盐酸羟胺溶液,摇匀后放置2 min。各加2 mL 1.5 g·L-1邻二氮菲溶液,然后从滴定管中分别加入0,2.00,5.00,8.00,10.00,20.00,25.00,30.00,40.00 mL 0.1 mol·L-1NaOH溶液摇匀,以水稀释至刻度,摇匀。用精密pH试纸或酸度计测量各溶液的pH。
以水为参比,在选定波长下,用1 cm吸收池测量各溶液的吸光度。绘制A—pH曲线,确定适宜的pH范围。
5.络合物稳定性的研究 移取2.0 mL 10-3 mol·L-1铁标准溶液于50 mL容量瓶中,加入1.0 mL 100 g·L-1盐酸羟胺溶液混匀后放置2 min。2.0 mL 1.5 g.L-1邻二氮菲溶液和5.0 mL 1.0 mol·L-1。乙酸钠溶液,以水稀释至刻度,摇匀。以水为参比,在选定波长下,用1 cm吸收池,每放置一段时间测量一次溶液的吸光度。
放置时间:5 min,10 min,30 min,1 h,2 h,3 h。
以放置时间为横坐标、吸光度为纵坐标绘制A-t曲线,对络合物的稳定性作出判断。
6.标准曲线的测绘 以步骤l中试剂空白溶液(1号)为参比,用1 cm吸收池,在选定波长下测定2~6号各显色标准溶液的吸光度。在坐标纸上,以铁的浓度为横坐标,相应的吸光度为纵坐标,绘制标准曲线。
7.铁含量的测定试样溶液按步骤1显色后,在相同条件下测量吸光度,由标准曲线计算试样中微量铁的质量浓度。
四、思考题
1.用邻二氮菲测定铁时,为什么要加入盐酸羟胺?其作用是什么?试写出有关反应方程式。
2.根据有关实验数据,计算邻二氮菲一Fe(Ⅱ)络合物在选定波长下的摩尔吸收系数。
3.在有关条件实验中,均以水为参比,为什么在测绘标准曲线和测定试液时。要以试剂空白溶液为参比?
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁20xx级医学检验3组吴茳铃20xx221885实验目的和要求1掌握紫外可见分光光度计的基本操作…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁一实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法3…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法3…
-
邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理2掌握TU19xx分光光度…
-
邻二氮菲分光光度法测定水中微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学会吸收曲线及标准曲线的绘制了解分光光度法的基本原理2掌握用邻二氮菲分光光度法测定微量铁的…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁日期20xx318实验者曾惜20xx222702合作者曾子夜20xx222702一实验目的和要求1掌握…