药物化学实验
实验一、磺胺醋酰钠的制备
磺胺是临床上应用最早的磺胺类抗菌药,但水溶性小,不便应用,磺胺分子中的磺酰氨基近乎中性。虽可与NaOH成盐而水溶性增大,但极易水解,水溶液呈强碱性,也不能应用于临床,如果将磺酰氨基进一步酰化,酸性增强,成钠盐后,水解性减低,碱性减弱,能在临床上应用,乙酰化的产物为磺胺醋酰。其钠盐近中性,可配成滴眼剂使用。
一、实验目的
1.了解磺胺醋酰合成的基本路线.
2.熟悉pH、温度等条件在药物合成中的重要性.
3.掌握利用理化性质的差异来分离纯化产品的方法.
二、实验内容
磺胺醋酰的制备及产品的分离纯化。
三、实验原理
在碱性条件下以磺胺为原料与乙酸酐反应,磺酰氨基乙酰化制备得到磺胺醋酰,再与氢氧化钠反应制备磺胺醋酰钠。

注:乙酐酰化时有副产物双乙酰化物产生。
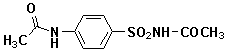
四、实验材料与设备
1.实验设备、仪器
圆底烧瓶(100 mL),球形冷凝管,布氏漏斗,抽滤瓶,温度计,恒温磁力搅拌器,三颈瓶,抽滤瓶,布氏漏斗。
2.实验材料、试剂
NaOH(分析纯),磺胺(药用),醋酐(分析纯),盐酸(分析纯),活性碳(化学纯)。
五、实验步骤
(一) 磺胺醋酰的制备
在装有搅拌、温度计、回流冷凝管的250 mL三颈烧瓶中,加入26 g磺胺(SA)和22.5%的NaOH溶液(33 mL)。搅拌,水浴逐渐升温至50~55℃,待物料溶解后,滴加Ac2O(7.5 mL),5 min后加入77%NaOH溶液4.5 mL(注1),并保持反应液pH在12~13之间,剩余13 mL醋酐与14.5 mL 77%NaOH溶液以每隔5 min每次2 mL(注2)交替加入。加料期间的反应温度维持在50~55℃及pH在12~14(注3)。加料完毕后,继续搅拌30 min。反应结束后将反应液倾入250 mL烧杯中,加水30 mL稀释,滴加浓盐酸酸化至pH 7,于冰水浴中冷却1 h左右,析出未反应原料磺胺,过滤,滤饼用少量冰水洗涤(注4),滤液与少量洗液合并后用浓盐酸调pH至4~5,有固体析出,过滤,将滤饼压紧抽干(注5),滤饼用3倍量的10%盐酸溶液溶解,放置30 min,抽滤除去不溶物,滤液加少量活性碳室温脱色10 min,过滤,滤液用40%的NaOH溶液调pH至5,析出磺胺醋酰粗品,过滤,滤饼用10倍左右的水加热,使产品溶解,趁热过滤,滤液放冷,慢慢析出结晶,过滤,干燥得磺胺醋酰精制品,m.p. 179~182℃。
(二) 磺胺醋酰钠的制备
将所得磺胺醋酰精制品放入100 mL烧杯中,以少量水浸润后,于水浴上加热至90℃,用滴管滴加40%NaOH溶液至pH为7~8恰好溶解,趁热过滤,滤液移至烧杯中,冷却析出晶体,滤取结晶,干燥,得磺胺醋酰钠产品。
六、附注
1. 本实验中使用NaOH溶液有多种不同浓度,在实验中切勿用错,否则会导致实验失败。
2. 滴加醋酐和NaOH溶液是交替进行,每滴完一种溶液后,让其反应5 min后,再滴加另一种溶液。滴加是用滴管加入,滴加速度以液滴一滴一滴滴下为宜。
3. 反应中保持反应液pH在12~13之间很重要,否则收率将会降低。
4. 在pH为7时析出的固体不是产物,应弃去。产物在滤液中,切勿搞错。在pH 4~5析出的固体是产物。
5. 在本实验中,溶液pH的调节是反应能否成功的关键,应小心注意,否则实验会失败或收率降低。
6. 氢氧化钠固体及其溶液具有强腐蚀性,不慎粘有时,应及时用大量清水冲洗。
7. 醋酐具有催泪性和腐蚀性,取用时在通风橱中进行,不慎粘有时,应及时用大量清水冲洗。
七、实验报告内容
写出实验目的、原理、所用仪器及型号,记录实验过程、现象及结果,并进行分析与讨论。
八、思考题
1.反应中用NaOH的作用是什么?
2.在制备SA时,芳伯胺基可发生酰化吗?
3.该制备中产生哪些副产物,应如何减少副产物提高收率?
实验二对乙酰氨基酚的制备及质量控制
一、实验目的
1.了解选择性乙酰化的方法,掌握药物的精制、杂质检查、结构鉴定等方法与技能。
2.掌握易被氧化产品的重结晶精制方法。
二、实验原理
对乙酰氨基酚为白色结晶性粉末;无臭味,微苦。在热水或乙醇中易溶,在丙酮中溶解,在水中略溶。mp.168~172℃。
合成路线:

三、实验步骤
1.对乙酰氨基酚的制备:
于干燥的100ml锥形瓶中加入对氨基苯酚10.6g,水30ml,醋酐12ml,轻轻振摇使成均相。再于80℃水浴中加热反应30min,放冷,析晶,过滤,滤饼以10ml冷水洗2次,抽干,干燥,得白色结晶性对乙酰氨基酚粗品。
2.精制:
于100ml锥形瓶中加入对乙酰氨基酚粗品,每克用水5ml,加热使溶解,稍冷后加入活性碳1g,煮沸5min,在吸滤瓶中先加入亚硫酸氢钠0.5g,趁热过滤,滤液放冷析晶,过滤,滤饼以0.5%亚硫酸氢钠溶液5ml分2次洗涤,抽干,得白色对乙酰氨基酚纯品。
3.对乙酰氨基酚的鉴别:
(1)取对乙酰氨基酚0.1g,加稀盐酸5ml,置水浴中加热40分钟,放冷;取0.5ml,滴加亚硝酸钠试液5滴,摇匀,用水3ml稀释后,加碱性β-萘酚试液2ml,振摇,即显红色。
(2)红外光吸收图谱应与对照的图谱(光谱集131图)一致。
(3)熔点168~172℃。
4.对乙酰氨基酚的检查:
(1)有关物质 取对乙酰氨基酚1.0g,置具塞离心管或度管中,加乙醚5ml,立即密塞,振摇30分钟,离心或放置至澄清,取上清液作为供试品溶液;另取每1ml中含对氯苯乙酰胺1.0mg的乙醇溶液适量,用乙醚稀释成每1ml中含50μg的溶液作为对照溶液。吸取供试品溶液200μl与对照溶液40μl,分别点于同一硅胶GF254薄层板上。以三氯甲烷-丙酮-甲苯(13:5:2)为展开剂,展开,晾干,置紫外灯(254nm)下检视,供试品溶液如显杂质斑点,与对照溶液的主斑点比较,不得更深。
(2)对氨基酚 取对乙酰氨基酚1.0g,加甲醇溶液(1→2)20ml溶解后,加碱性亚硝基铁氰化钠试液1ml,摇匀,放置30分钟;如显色,与对乙酰氨基酚对照品1.0g加对氨基酚50μg用同一方法制成的对照液比较,不得更深(0.005%)。
四、问题与讨论
1、酰化反应为何选用醋酐而不用醋酸作酰化剂?
2、加亚硫酸氢钠的目的何在?
3、对乙酰氨基酚中的特殊杂质是何物?它是如何产生的?
五、注意事项
1.对氨基苯酚的质量是影响对乙酰氨基酚产量、质量的关键。
2.酰化反应中,加水30ml。有水存在,醋酐可选择性地酰化氨基而不与酚羟基作用。若以醋酸代替醋酐,则难以控制氧化副反就,反应时间长,产品质量差。
3.加亚硫酸氢钠可防止对乙酰氨基酚被空气氧化,但亚硫酸氢钠浓度不宜过高,否则会影响产品质量。
实验三、烟酸的制备
烟酸(Nicotinic acid)学名为吡啶-3-羧酸,又称维生素B5,是B族维生素中的一种,富集于酵母、米糠之中,可用于防治糙皮病,也可用作血管扩张药,并大量用作食品和饲料的添加剂。作为医药中间体,可用于烟酰胺、尼可刹米及烟酸肌醇酯的生产。
 烟酸的化学结构:
烟酸的化学结构:
分子式:C6H5NO2; 分子量:123
本品为无色针状结晶,m.p. 236~239℃。
一、实验目的
1.掌握高锰酸钾氧化法对芳烃的氧化原理及实验方法
2.熟悉酸碱两性有机化合物的分离纯化技术
3.了解烟酸的合成路线。
二、实验内容
1. 3-甲基吡啶的氧化反应
2. 烟酸的精制
三、实验原理
烟酸可以由喹啉经氧化、脱羧合成,但合成路线长,且所用的试剂为腐蚀性的强酸。因此可以通过对3-甲基吡啶的氧化来制取。

四、实验材料与设备
1. 仪器和设备
球形冷凝器、圆底烧瓶、三颈烧瓶、尾接管、布氏漏斗、抽滤瓶、圆底烧瓶、温度计、恒温磁力搅拌器。
2. 试剂和药品:3-甲基吡啶、 高锰酸钾、浓盐酸
五、实验步骤
1、投料比
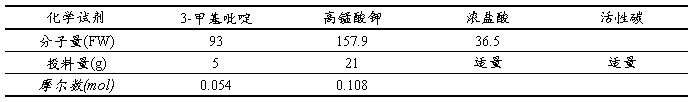
2、操作步骤
 在配有回流冷凝管、温度计和搅拌子的三口烧瓶中。加入3-甲基吡啶5 g、蒸馏水200 mL水,水浴加热至85℃。在搅拌下,分批加入高锰酸钾21 g, 控制反应温度在85~90℃,加毕,继续搅拌反应1 h。停止反应,改成常压蒸馏装置,蒸出水及未反应的3-甲基吡啶,至流出液呈现不浑浊为止,约蒸出130 mL水,停止蒸馏,趁热过滤,用12 mL沸水分三次洗涤滤饼(二氧化锰),弃去滤饼, 合并滤液与洗液,得烟酸钾水溶液。
在配有回流冷凝管、温度计和搅拌子的三口烧瓶中。加入3-甲基吡啶5 g、蒸馏水200 mL水,水浴加热至85℃。在搅拌下,分批加入高锰酸钾21 g, 控制反应温度在85~90℃,加毕,继续搅拌反应1 h。停止反应,改成常压蒸馏装置,蒸出水及未反应的3-甲基吡啶,至流出液呈现不浑浊为止,约蒸出130 mL水,停止蒸馏,趁热过滤,用12 mL沸水分三次洗涤滤饼(二氧化锰),弃去滤饼, 合并滤液与洗液,得烟酸钾水溶液。
将烟酸钾水溶液移至500 mL烧杯中,用滴管滴加浓盐酸调pH值至3-4(烟酸的等电点的pH值约3.4,注意:用精密pH试纸检测),冷却析晶,过滤,抽干,得烟酸粗品。
3、精制
将粗品移至250 ml圆底烧瓶中,加粗品5倍量的蒸馏水,水浴加热,轻轻振摇使溶解,稍冷,加活性碳适量,加热至沸腾,脱色10 min,趁热过滤,慢慢冷却析晶(注1),过滤,滤饼用少量冷水洗涤,抽干,干燥,得无色针状结晶烟酸纯品,mp236~239℃。
六、附注
1.慢慢冷却结晶,有利于减少氯化钾在产物中的夹杂量。
2.氧化反应若完全,二氧化锰沉淀滤去后,反应液不再显紫红色。如果显紫红色,可加少量乙醇,温热片刻,紫色消失后,重新过滤。
3.精制中加入活性碳的量可由粗品的颜色深浅来定,若颜色较深可多加一些。
七、实验报告内容
写出实验目的、原理、所用仪器及型号,记录实验过程、现象及结果,并进行分析与讨论。
八、思考题:
1. 氧化反应若反应完全,反应液呈什么颜色?
2. 为什么加乙醇可以除去剩余的高锰酸钾?
3. 在产物处理过程后,为什么要将pH值调至烟酸的等电点?
4. 本实验在烟酸精制过程中为什么要强调缓慢冷却结晶处理?冷却速度过快会造成什么后果?
5. 如果在烟酸产物中尚含有少量氯化钾,如何除去?试拟定分离纯化方案。
实验四、维生素K3的制备
一、实验要求:
熟悉维生素K3的制备方法。
二、实验原理:
β-甲基萘在三氧化铬作用下被氧化成中间体 β-萘醌,β-萘醌与亚硫酸氢钠起
加成反应生成产品维生素K3,反应式如下:

三、实验步骤:
1. 中间体 β-萘醌的制备
1) 量取β-甲基萘-醋酸溶液40毫升(其中含β-甲基萘5克)置于 250 毫升三口瓶中;
2) 称取三氧化铬 22.5 克于小烧杯中,加水 22 毫升溶解备用;
3) 三口烧瓶中加磁转子,安装温度计,启动搅拌,保持35-40℃慢慢滴加三氧化铬溶液,期间以冷水浴降温控制反应温度;
4) 保温:40℃以下保温搅拌30分钟,升温到70℃保温搅拌30分钟,再升到85℃保温搅拌 15 分钟;
5) 结晶:将反应物倾入盛有200毫升冷水的烧杯中,搅拌,过滤。用适量冷水洗涤,晾干滤饼,备用。
2. 维生素K3 粗品的制备
6) 称取自制中间体β-萘醌M克,置于250毫升三口瓶中,加无水乙醇4.7M毫升,加入磁转子搅拌溶解;
7) 称取亚硫酸氢钠1.2M克置于小烧杯中,加1.2M毫升水溶解备用;
8) 将亚硫酸氢钠溶液慢慢滴加到三口瓶中,保持反应温度小于 40℃;
9) 35-40℃继续保温搅拌 1 小时;
10) 结晶:将三口瓶置于冰水中冷却至10℃以下,待出现结晶时继续保冷 10 分钟以上;
11) 抽滤,并用少量乙醇洗涤,晾干,备用。
3. 精制
12) 称取自制维生素K3粗品为 N 克,置于 100 毫升锥形瓶中,加 8N 毫升乙醇及少量亚硫酸氢钠,加热至熔,保温60-70℃ 30分钟;
13) 趁热过滤;
滤液倒入干净的锥形瓶中,置于在冰水中冷却至 10℃以下,待出现结晶时继续保冷10 分钟以上;
14) 抽滤,并用少量乙醇洗涤;
15) 将湿滤饼在 70℃以下干燥,得白色晶体维生素 K3。
四、注意事项:
1) 氧化反应为放热反应,必须将三氧化铬溶液逐渐滴入 β-甲基萘-HAC溶液中,切不可将三氧化铬溶液一次倒入,以防 生冲料危险。
2) 因β-萘醌微溶于冷水,故洗涤用冷水。
思考题:
1、有机反应中常用的氧化剂有哪些?
2、氧化反应中应注意哪些安全问题?
实验五、苯佐卡因的合成
外科手术所必需的麻醉剂或称止痛剂,是一类已被研究透彻的药物。化学家在这方面充分显示了他们的才能,他们对天然药物古柯碱研究的结果最终以更理想的合成品来替代它们,这种合成品作用更强,且无副作用和危险性。
最早的局部麻醉药是从南美洲生长的古柯植物中提取的古柯碱或称可卡因,但具有容易成瘾和毒性大等缺点,在搞清楚了古柯碱的结构和药理作用之后,人们已合成和试验了数百种局部麻醉剂,苯佐卡因和普鲁卡因仅是其中的两种。已经发现的有活性的这类药物均有如下共同的结构特征:分子的一端是芳环,另一端则是仲胺或叔胺,两个结构单元之间相隔1-4个原子连结的中间链。苯环部分通常为芳香酸酯,它与麻醉剂在人体内的解毒有密切的关系;氨基还有助于使此类化合物形成溶于水的盐酸盐以制成注射液。

本实验阐述了局部麻醉药苯佐卡因的制备,它是一种白色的晶体粉末,制成散剂或软膏用于疮面溃疡的止痛。
一、实验目的和要求
1.掌握文献查阅和局麻药苯佐卡因合成路线选择的基本原理和评价.
2.熟悉氧化、酯化、还原、酰化反应的原理和操作方法.
3.了解化合物的酸碱性进行纯化的方法.
二、实验原理
苯佐卡因通常有两条合成路线:方法一由对硝基甲苯首先被氧化成对硝基苯甲酸,再经乙酯化后还原而得。

这是一条比较经济合理的路线。
方法二采用对甲苯胺为原料,经酰化、氧化、水解、酯化一系列反应制备苯佐卡因。

此路线虽然比方法一以对硝基甲苯为原料长一些,但原料易得,操作方便,适合于实验室小量制备。
两条路线均有大量文献报道。现将两种合成方法列出,根据同学查阅文献的情况和兴趣,自己确定合成方法。
三、实验内容(在文献检索的基础上,指导教师审核)
1.以对硝基甲苯为原料,经氧化、酯化、还原反应合成苯佐卡因.
2.以对氨基甲苯为原料,经酰化、氧化、酯化反应合成苯佐卡因.
四、实验仪器
三颈烧瓶、圆底烧瓶、干燥管、烧杯、锥形瓶、球形冷凝管、机械搅拌器、布氏漏斗、抽滤瓶.
苯佐卡因的制备(方法一)
一、对硝基苯甲酸的合成(氧化反应)
[试剂]
对硝基甲苯 (10 g m.p. 51~54℃)、重铬酸钾 (34 g)、浓硫酸 (40 mL)、5%硫酸 (40 mL)、5%NaOH (75 mL)、10%硫酸 (150 mL)、活性碳(适量)
[实验步骤]
在三颈烧瓶中加入对硝基甲苯(10 g,73 mmol)、重铬酸钾(34 g,0.115 mol)和水(65 mL),搅拌下小心滴加浓硫酸(40 mL),滴加过程中,控制反应体系内温度不超过60 ℃ ,必要时用水浴冷却之,当加入一半量硫酸后,注意控制温度,勿使反应过分剧烈。硫酸加毕后,升温至微沸,缓缓回流1 h,至反应液呈绿色,冷却到50 ℃ ,将反应液倒入烧杯中,加入冷水80 mL, 搅拌析出晶体,抽滤,用冷水(40 mL)分两次洗涤滤饼。
粗品对硝基苯甲酸为黄黑色,可将其置于5%的硫酸40 mL中,加热10 min,以溶解铬酸,冷却,过滤,抽干,得晶体。再将晶体溶于温热的5%氢氧化钠溶液中,冷却,过滤(注1),滤液中加入约0.5 g的活性炭,温热至约 50 ℃,振摇或搅拌5-10 min后过滤。滤液冷却,搅拌下将滤液滴加到10%的硫酸(150 mL)中,冷却,析出晶体充分,过滤(注2),用冷水洗涤,干燥,计算收率,测定熔点(注3)。
[注]:
1. 这一步是除去未反应的对硝基甲苯和铬酸,将铬酸变成氢氧化铬后除去。
2. 硫酸不能反加到滤液中,否则生成的沉淀包含杂质,影响产物的纯度。
3. 必要时用水、乙醇、苯或冰醋酸重结晶。
二、对硝基苯甲酸乙酯的制备(酯化反应)
[试剂]
对硝基苯甲酸 (8 g)、浓硫酸 (9.6 g,5.3 mL)、95%乙醇 (20 mL)、5%的碳酸钠溶液
[实验步骤]
将95%的乙醇(20 mL)置于100 mL干燥的圆底烧瓶中,慢慢加入浓硫酸(5.3 mL),再加入对硝基苯甲酸(8 g),装上球形冷凝管,于85℃水浴中搅拌、回流1.5 h, 至对硝基苯甲酸固体消失(注1),瓶底有透明的油状物。反应完毕后,取下圆底烧瓶,在剧烈振摇下冷却(注2)析出晶体,然后倒入80 mL冷水中,搅拌,过滤,得滤液(I)。滤饼用水洗涤2次,然后置于5%的碳酸钠溶液中,使pH = 8左右,以溶去未反应的对硝基苯甲酸,过滤,得到滤液(II),滤饼用水洗涤至中性,减压干燥,得对硝基苯甲酸乙酯,计算收率,测定熔点(本品熔点较低,注意干燥温度)。合并滤液(I),(II),用酸酸化,过滤,可以回收部分未反应的对硝基苯甲酸。
[注]:
1. 若沉淀没有完全溶解,说明酯化还未进行完全,可视情况酌量补加硫酸和乙醇再继续回流之。
2. 必须剧烈振摇,使油层乳化,这样冷却后析出的结晶颗粒细,以后用碳酸钠处理时易除去酸,否则会结块,用碳酸钠不易处理。
三、苯佐卡因的合成(还原反应)
[试剂]
对硝基苯甲酸乙酯 (8 g)、铁粉 (7.2 g)、醋酸 (1 g)、95%乙醇 (90 mL)、10%硫化钠溶液、活性碳 (0.1-0.2 g).
[实验步骤]
将铁粉7.2 g、水24 mL和醋酸1 g置于装有搅拌器和温度计的100 mL三颈烧瓶中,80℃ 搅拌15 min(注1),然后缓慢加入(注2)对硝基苯甲酸乙酯,于80℃剧烈搅拌(注3)三小时。冷却到40℃,过滤,滤饼用水洗涤至中性,将滤渣移入100 mL烧杯中,加乙醇分三次热提取(50 mL一次,20 mL二次),于70℃水浴上加热,搅拌5 min过滤,合并三次的滤液。加10%硫化钠溶液一滴,检查有无铁离子,若有,再加硫化钠溶液至不再有黑色沉淀产生为止(此时需过滤),加活性炭,加热15 min脱色,趁热过滤,滤液浓缩至20 mL,冷却,析出晶体,过滤,用少量70%左右的稀醇洗涤,得白色结晶,必要时用稀醇进行重结晶(W:V = 1:5),本品的m.p. 91-92℃。用TLC检测纯度,计算收率。
[注]:
1. 先加热15 min的目的是使Fe活化,同时生成催化剂Fe(Ac)2。
2. 对硝基苯甲酸乙酯加入时反应放热,如加料速度快,则导致冲料。
3. 铁粉重,必须剧烈搅拌,才能使之不致沉积在烧瓶底部,使反应完全。
[思考题]
1. 用重铬酸盐氧化时,除生成对硝基苯甲酸外,可能还有哪些副产物存在,如何分离及充分利用?
2. 试述酯化反应的基本原理,指出做好酯化反应的关键在哪里?在纯化酯化产物时应注意哪些问题?
苯佐卡因的制备(方法二)
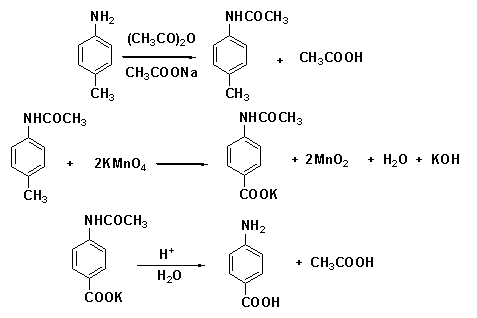
一、对氨基苯甲酸的合成
对氨基苯甲酸是一种与维生素B有关的化合物(又称PABA),它是维生素B10(叶酸)的组成部分。细菌把PABA作为组分之一合成叶酸,磺胺药则具有抑制这种合成的作用。
对氨基苯甲酸的合成涉及三个反应。第一步反应是将对甲苯胺用醋酸酐处理转化为相应的酰胺,这是一个制备酰胺的常用方法,其目的是在第二步用高锰酸钾氧化反应中保护氨基,避免氨基被氧化,形成的酰胺在所采用的氧化条件下是稳定的。
第二步是将对甲基乙酰苯胺中的甲基被高锰酸钾氧化为羧基。氧化过程中,紫色的高锰酸钾被还原成棕色的二氧化锰沉淀。鉴于溶液中有氢氧根离子生成,故要加入少量的硫酸镁作缓冲剂,使溶液碱性变得不致太强而使酰胺基发生水解。反应产物是羧酸盐,经酸化后可使生成的羧酸从溶液中析出。
最后一步是酰胺水解,除去起保护作用的乙酰基,此反应在稀酸溶液中很容易进行。
[反应式]
[试剂]
对甲苯胺 (7.5 g, 0.07 mol)、醋酸酐 (8.7 g, 8 mL, 0.085 mol)、醋酸钠(CH3COONa·3H2O) (12 g)、高锰酸钾 (20.5 g, 0.13 mol)、硫酸镁晶体(MgSO4·7H2O) (20 g,0.08 mol)、乙醇、盐酸、硫酸、氨水.
[实验步骤]
1. 对甲基乙酰苯胺的合成
在500 mL烧杯中,加入7.5 g对甲苯胺,175 mL水和7.5 mL浓盐酸,必要时在水浴上温热搅拌促使溶解。若溶液颜色较深,可加入适量的活性碳脱色后过滤。同时配置12 g三水合醋酸钠溶于20 mL水的溶液,必要时温热至所有的固体溶解。
将脱色后的盐酸对甲苯胺溶液加热至50℃,加入8 mL醋酸酐,并立即加入预先配制好的醋酸钠溶液,充分搅拌后将混合物置于冰浴中冷却,此时应析出对甲基乙酰苯胺的白色固体。抽滤,用少量冷水洗涤,干燥后称重,计算收率,测定熔点。对甲基乙酰苯胺纯品的熔点为154℃。
2. 对乙酰氨基苯甲酸的合成
在600 mL烧杯中,加入上述制得的对甲基乙酰苯胺(约7.5 g)、20 g七水合结晶硫酸镁和350 mL水,将混合物在水浴上加热到约85℃。同时制备20.5 g高锰酸钾溶于70 mL沸水的溶液。
在充分搅拌下,将热的高锰酸钾溶液在30 min内分批加入到对甲基乙酰苯胺的混合物中,以免氧化剂局部浓度过高破坏产物。加完后,继续在85℃搅拌15 min。
混合物变成深棕色,趁热用两层滤纸抽滤除去二氧化锰沉淀,并用少量热水洗涤二氧化锰。若滤液呈紫色,可加入2-3 mL乙醇煮沸直至紫色消失,将滤液再用滤纸过滤一次。
冷却无色滤液,加20%硫酸酸化至溶液呈酸性,此时应生成白色固体,抽滤,压干,干燥后得到对乙酰氨基苯甲酸。计算收率,测定熔点。纯品的熔点为250-252℃。湿品可直接进行下一步合成。
3. 对氨基苯甲酸的合成
称量上步得到的对乙酰氨基苯甲酸,将每克湿产物用5 mL18%的盐酸进行水解。将反应物置于250 mL圆底烧瓶中,在石棉网上用小火缓缓回流30 min。待反应物冷却后,加入30 mL冷水,然后用10%氨水中和,使反应混合物对石蕊试纸恰成碱性,切勿使氨水过量。每30 mL最终溶液加1 mL冰醋酸,充分振摇后置于冰水浴中骤冷以引发结晶,必要时用玻棒摩擦瓶壁或放入晶种引发结晶。抽滤收集产物,干燥后以对甲苯胺为标准计算累计产率,测定产物的熔点。纯品的熔点为186-187℃。实验得到的熔点略低一点(注1)。
[注释]
1. 对氨基苯甲酸不必重结晶,对产物重结晶的各种尝试均未获得满意的结果,产物可直接用于合成苯佐卡因。
[思考题]
1. 对甲苯胺用醋酸酐酰化反应中加入醋酸钠的目的何在?
2. 对甲乙酰苯胺用高锰酸钾氧化时,为何要加入硫酸镁结晶?
3. 在氧化步骤中,若滤液有色,需要加入少量乙醇煮沸,发生了什么反应?
4. 在最后水解步骤中,用氢氧化钠代替氨水中和可以吗?中和后加入醋酸的目的何在?
4. 对氨基苯甲酸乙酯(苯佐卡因)的合成
[反应式]

[试剂]
对氨基苯甲酸 (2 g, 0.0145 mol)、95%乙醇 (25 mL)、浓硫酸 (2 mL)、10%碳酸钠溶液、乙醚、无水硫酸镁.
[实验步骤]
在100 mL圆底烧瓶中,加入2 g对氨基苯甲酸和95%乙醇25 mL,旋转烧瓶使大部分固体溶解。将烧瓶置于冰水浴中冷却,加入2 mL浓硫酸,立即产生大量沉淀(在接下来的回流中沉淀将逐渐溶解),将反应混合物在水浴上搅拌、回流1 h。
将反应混合物转入烧杯中,冷却后分批加入10%碳酸钠溶液中和(约需12 mL),可观测到有气体逸出,并产生泡沫(发生了什么反应?),直至加入碳酸钠溶液后无明显气体释放。反应混合物接近中性时,检查溶液pH值,再加入少量碳酸钠溶液至pH值为9左右。在中和过程中产生少量固体沉淀(生成了什么物质?)。将溶液倾倒入分液漏斗中,并用少量乙醚洗涤固体后并入分液漏斗。向分液漏斗中加入40 mL乙醚萃取,振摇后分出醚层。经无水硫酸镁干燥后,在水浴上蒸出乙醚和大部分乙醇,至残留油状物约2 mL为止。残留物用乙醇-水重结晶,计算收率,测定熔点。
纯品的熔点为91-92℃。
[思考题]
1. 本实验中加入浓硫酸后,产生的沉淀是什么物质?试解释之。
2. 酯化反应结束后,为什么要用碳酸钠溶液而不用氢氧化钠溶液进行中和?为什么不中和至pH为7而要使溶液pH为9左右?
3. 如何由对氨基苯甲酸为原料合成普鲁卡因(procaine)?
-
药化实验报告模板
药物化学实验报告模板实验室间20xx年10月28日天气晴温度2225扑炎痛的合成一实验原理二主要试剂及仪器原料名称阿司匹林氯化亚砜…
-
药物化学实验报告
北京广播电视大学医药分校北京广播电视大学药物化学实验报告姓名高振峰学号1311001456929组别A组成绩实验名称阿司匹林乙酰水…
-
药 物 化 学 实 验
药物化学实验王瑞孙铁民沈阳药科大学药物化学教研室20xx年9月1前言药物化学实验是依据药物化学教学大纲的要求编定目的是通过实验加深…
-
药物化学实验报告
北京广播电视大学医药分校北京广播电视大学药物化学实验报告姓名学号组别20xx秋药学班成绩实验名称阿司匹林乙酰水杨酸的合成实验时间2…
-
药物化学实验报告
药物化学实验报告的要求一目的要求二反应式照片中的反应式与SA制备分离的基本原理三原料试剂主要物理常数图五实验操作现象记录每页纸分成…
-
20xx年北京各区初三物理二模实验设计题总结_含答案
37.实验桌上有如下器材:符合实验要求的电源、滑动变阻器和电流表各一个,装有适量煤油的保温容器一个(容器内部封装有电阻不变的加热电…
-
20xx企业员工工作总结
要想成为一名优秀的管理者,还必须掌握常用的现代办公软件,以及学习其他优秀的管理方法。在这方面,我平时除了学习一些常用的文字、图像处…
-
医院工会工作总结范文
今年上半年,院工会在院党委和上级工会领导下,以党的xx届6中全会精神和“xxxx”重要思想为指导,加强工会自身建设,围绕医院中心工…
-
石月亮中学四群教育工作总结
石月亮中学开展“四群”教育工作总结深入开展群众观点、群众路线、群众利益、群众工作的?四群?教育活动,实行干部直接联系群众制度,是省…
-
教育实习个人总结-实习总结
我实习所在学校是河源市和平中学,实习基本内容包括三部分:课堂教学、班主任工作和教育调查。基本情况如下:1、课堂教学:完成教案数28…