氧化还原反应教学案例
第三节氧化剂和还原剂(第1课时)教学案例
一、设计说明
(一)教学背景分析
教材分析
初中教材中已经通过C还原CuO浅层次地学习了氧化反应与还原反应,学生对基本的氧化与还原有一定的基础知识。本节内容对氧化还原反应进行系统深入地讲解,是进一步学习化学的基础,因此是高中化学的重点内容。通过这部分的学习,学生可以根据有无化合价变化判断一个反应是不是氧化还原反应,通过实验事实了解氧化还原反应的本质是电子的转移,能够举例说明生产、生活中常见的氧化还原反应。学生可以在初中化学的基础上,进一步去了解氧化还原反应的本质,达到优化知识结构的效果。对氧化还原反应在生活中应用的介绍,起到了培养学科感情的目的,同时,教材还辨证地介绍了氧化还原反应会给人类带来危害,以引导学生形成辨证看问题的科学思维方式。
学情分析
有关氧化还原的知识,学生在初中就已经从得、失氧的角度学习过,因此有较好的知识基础,通过初中和高中阶段的训练,学生也具备了一定的分析和归纳问题的能力,因此在本节教学中可以把通过比较和归纳得出结论的任务交给学生完成,以激发学习兴趣,形成探究习惯。
(二)教学目标
知识与技能目标
(1)使学生了解四种基本反应类型与氧化还原反应的关系。
(2)会从化合价角度判断氧化还原反应。
(3)理解氧化还原反应的实质是电子的转移。
过程与方法目标
(1)使学生学会多角度看待事物,培养思维的全面性。
(2)通过小组合作学习,讨论、探究培养学生的合作共赢意识。
情感态度价值观目标
使学生体会“透过现象看本质”和“对立统一”的辩证唯物主义观,促进学生形成科学的世界观。
(三)教学重点和难点
重点:氧化还原反应的概念和实质
难点:用化合价升降和电子转移的角度分析氧化还原反应。
(四)教学方法
1.实验法。
2.学案导学:见后面的学案。
3.新授课教学基本环节:情境导入→展示目标→合作探究→精讲点拨→反思总结→当堂检测→布置作业
二、实施过程
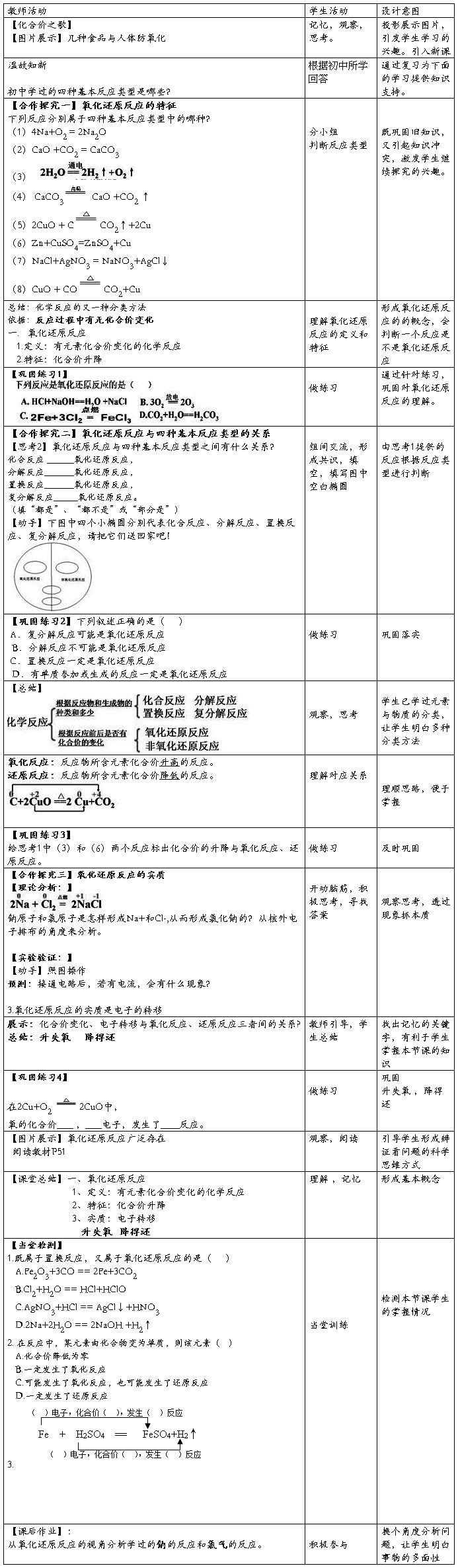
三、效果分析
本节课通过小组合作竞争的方式学习,前边8个反应的标化合价和判断是否为氧化还原反应为必答题,巩固训练为抢答题,一个小组必答错误的题目其他小组可以抢答,通过这种竞赛式的学习,学生的积极性很强,一个问题往往8个小组的同学都起来抢答,这样老师可以给每个小组都加分,但是老师可以选择一个题目中的其他选项让学生解释,从而给有能力的小组进行加分,同时也促使学生不能只看到一个正确选项就不思考其他的选项了。
反思:有竞争才有活力,希望在以后的教学中老师要多采取这种教学方式,激发学生的积极性。
第二篇:高中化学 氧化还原反应 第2课时优秀教案 新人教版必修1
第2课时
●三维目标
知识与技能
1.应用电子转移的观点进一步理解氧化还原反应。
2.应用电子转移的观点判断、分析氧化还原反应,并能举例说明化学反应中元素化合价的变化与电子转移的关系。
3.认识氧化还原反应中各有关物质的相互关系。
过程与方法
1.经历对氧化还原反应探究的过程,理解科学探究的意义,学习科学探究的基本方法,提高科学探究能力。
2.能够发现和提出有探究价值的化学问题,敢于质疑,勤于思索,逐步形成独立思考的能力,善于与人合作,具有团队精神。
情感、态度与价值观
1.发展学习化学的兴趣,乐于探究氧化还原反应的奥秘,体验科学探究的艰辛和喜悦,感受化学世界的奇妙与和谐。
2.树立辩证唯物主义的世界观,养成求真务实、勇于创新、积极实践的科学态度。
●教学重点
氧化还原反应的本质
●教学难点
氧化还原反应的本质
培养探究能力、思维能力、归纳能力
●教具准备
多媒体课件、投影仪
●教学过程
[新课导入]
【投影】
1.什么叫氧化反应?什么叫还原反应?
生:氧化反应:物质得到氧的化学反应。
还原反应:含氧化合物里的氧被夺去的反应。
2.请判断下表中的反应是不是氧化还原反应,分析反应前后元素化合价的变化。
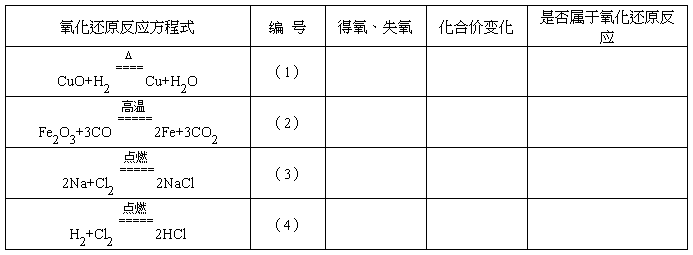
生:(1)和(2)是物质得氧、失氧的化学反应,反应前后元素化合价发生了变化。(3)和(4)反应中没有氧的得失,但反应前后元素化合价发生了变化,也是氧化还原反应。
师:(3)和(4)也是氧化还原反应,那么,反应前后元素化合价的变化与电子得失又是什么关系?这就要从微观的角度上认识氧化还原反应。
[推进新课]
师:请同学们写出H、O、Ne、Na、Mg、Cl原子结构示意简图。
生: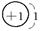
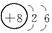
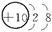
H O Ne
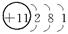
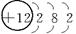
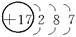
Na Mg Cl
1.化合物NaCl的形成过程
师:请大家看书P31:让学生回答化合物NaCl的形成过程。
生:钠原子最外层有一个电子,在化学反应中易失去一个电子达到像氖原子电子层的稳定结构,氯原子最外层有7个电子,在化学反应中易得一个电子达到像氖原子电子层的稳定结构,钠原子把一个电子先给了氯原子,从而使Na原子变为Na+,Cl原子变为Cl-,Na+和Cl-相互吸引形成NaCl。
[投影]NaCl的形成过程(见下图)。
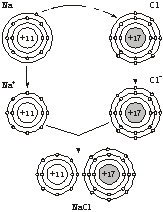
氯化钠形成示意图
2.化合物HCl的形成过程
师:请大家看书P31:提问学生回答化合物HCl的形成过程。
生:氢原子最外层为一个电子,因最外层是K层,希望获得一个电子变为稳定结构,氯原子最外层为7个电子,同样希望获得一个电子达到稳定结构,但二者争夺电子能力相差不大,都未能将对方的电子夺取过来,只好各拿出一个电子组成一对电子,这对电子为两个原子共有,所以氢原子和氯原子是靠共用电子对形成氯化氢分子的。但由于氯原子吸引电子能力强,电子对偏向于氯原子,偏离氢原子,从而使氯原子一方略显负电性,氢原子一方略显正电性。
[投影]HCl分子的形成过程。
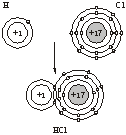
学生讨论:在化合物中,化合价是如何确定的?
[投影]请学生填写下表:

[知识拓展]
师:元素的化合价变化与电子得失或电子对偏移有什么关系?
生:在氧化还原反应中,得电子(或电子对偏向)表现为所含元素化合价降低,失电子(或电子对偏离)表现为所含元素化合价升高。
师:氧化还原反应的实质是什么?
生:氧化还原反应的实质是电子发生转移(电子的得失或电子对偏移)。
师:根据元素的化合价变化与电子得失或电子对偏移的关系,从电子得失的角度分析什么是氧化反应、还原反应?
生:失去电子的反应为氧化反应,得到电子的反应为还原反应。
[板书]一、氧化还原反应概念的辨析
[合作探究]
1.氧化反应(被氧化):指反应物中的某元素失电子、化合价升高的反应过程。
师:上述概念应从哪几方面理解?
生:(1)氧化反应的对象是反应物中的某元素;
(2)氧化反应的本质是元素的原子失去电子;
(3)氧化反应的特征是元素化合价升高;
(4)氧化反应对反应过程而言。
2.还原反应(被还原):指反应物中某元素得电子、化合价降低的反应过程。
师:上述概念应有哪儿方面理解?
(1)还原反应的对象是反应物中的某元素;
(2)还原反应的本质是元素的原子得到电子;
(3)还原反应的特征是元素化合价降低;
(4)还原反应对反应过程而言。
3.氧化还原反应:凡是有电子转移、化合价变化的反应叫氧化还原反应。
师:如何认识氧化还原反应中各有关物质?
生:4.氧化剂:指反应物中含得电子、化合价降低元素的物质。
师:上述概念应从哪几方面理解?
生:(1)氧化剂是指反应物;
(2)其本质是得电子,特征为化合价降低。
(3)氧化剂具有氧化性。
5.还原剂:反应物中含有失电子、化合价升高元素的物质。
师:上述概念应从哪几方面理解?
生:(1)还原剂指反应物;
(2)其本质为失电子,特征是化合价升高。
(3)还原剂具有还原性。
[课堂小结]
本节课我们进一步学习了氧化还原反应的知识,认识了氧化还原反应的本质是电子的转移,要求同学们能够理解氧化还原反应的发展历史:从得氧、失氧,到化合价变化,到电子转移。
[板书]二、氧化还原反应的本质是电子转移;氧化还原反应的特征是化合价变化。
“氧化”与“还原”是一对矛盾,既是相反的,又是同时相互依存的,是不可分割的。
[学与问]化合反应、分解反应、置换反应与氧化还原反应的交叉分类示意图:
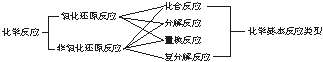
[布置作业]
1.教材P33 4、5
●板书设计
一、氧化还原反应概念的辨析
1.氧化反应(被氧化)
2.还原反应(被还原)
3.氧化还原反应
4.氧化剂
5.还原剂
二、氧化还原反应的本质是电子转移;特征是化合价变化。“氧化”与“还原”是一对矛盾,既是相反的,又是同时相互依存的,是不可分割的。
●活动与探究
氧化还原反应在日常生活、工农业生产中都有广泛的应用,请调查列举在日常生活、工业、农业中运用的氧化还原反应的实例。
提示:日常生活中:煤、煤气、天然气的燃烧,酿酒,炒菜,食物的腐败,食物在人体中被消化,人和动物的呼吸等。
工业生产中:金属的冶炼、石油化工、合成氨工业、三酸二碱的生产、日用化工、电镀、干电池、蓄电池及尖端的空间技术上用的高能燃料电池等。
农业生产中:植物的光合作用、施入土壤中的肥料发生的变化、土壤结构中的许多物质发生的变化、农药的制取等。
●随堂练习
1.在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是_________,只有还原性的是_________,既有氧化性又有还原性的是___________________。
答案:Fe3+、Mg2+、H+ S2-、I- Fe2+、S
2.以下关于化学反应KClO3+6HCl====KCl+3Cl2+3H2O中,电子转移的方向和数目的叙述正确的是
A.由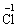
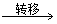
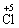 ,共6e-
,共6e-
B.由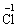
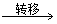
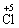 ,共5e-
,共5e-
C.由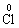
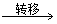
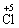 ,共6e-
,共6e-
D.由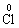
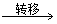
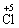 ,共5e-
,共5e-
答案:B
3.已知下列两氧化还原反应:O2+4HI====2I2+2H2O Na2S+I2====2NaI+S
试比较三种单质的氧化性强弱顺序___________________。
答案:O2>I2>S
4.单质X和Y相互反应生成X2+Y2-,现有下列叙述:①X被氧化 ②X是氧化剂 ③X具有氧化性 ④Y2-是还原产物 ⑤Y2-具有还原性 ⑥X2+具有氧化性 ⑦Y的氧化性比X2+氧化性强,其中正确的是
A.①②③④ B.①④⑤⑥⑦ C.②③④ D.①③④⑤
答案:B
5.在3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O的反应中,有6.4 g铜被氧化,参加反应的HNO3的质量是_________g,被还原的HNO3质量是_________g。
分析:铜和参加反应的HNO3的量的关系是:
3Cu ~ 8HNO3
3×64 8×63
6.4 g x x=16.8 g
铜和被还原的HNO3的量的关系是:
3Cu ~ 2HNO3
3×64 2×63
6.4 g y y=4.2 g
答案:16.8 4.2
●习题详解
1.C元素和Cu元素的化合价发生了变化。其中,C元素的化合价升高,从0价升到了+4价,Cu元素的化合价从+2降到了0。
2.C 因为,只有在C中氧元素的化合价发生了变化。
3.C B
4.电子转移;失去;得到。
5.详见活动与探究,辩证地认识氧化还原反应。
-
对氧化还原反应教学反思
对氧化还原反应的教学反思南沙中学冼瑞熔氧化还原反应理论是中学化学的重要理论如何才能使学生从初中对氧化还原反应的肤浅认识提升到构建氧…
-
《氧化还原反应》教学反思
氧化还原反应教学反思氧化还原反应是高中化学必修1第二章化学物质及其变化中的第三节有其重要的意义因为在中学阶段的基本概念基础理论知识…
-
《氧化还原反应》教学设计及反思
氧化还原反应教学设计昌吉州二中化学组吕玲英一教材分析11教材的地位与作用氧化还原反应是高中化学基本理论的重要内容之一本章内容是日常…
-
氧化还原反应教学反思
教学反思我选择的这节课属于化学基本概念的教学目的是让学生感知在学习过程中要正确恰当地看待概念的形成和发展教学过程以从学生已有的初中…
-
氧化还原反应教案及教学反思
第二章第三节氧化还原反应教案教材分析氧化还原反应是日常生活工农业生产和现代科技中经常遇到的一类重要的化学反应它贯穿中学化学学习的全…
-
幼儿园中班安全工作总结
启迪二班安全防护教育工作总结幼儿是安全活动的主人,掌握一定的自我安全保护的方法,是幼儿园安全教育的重点。因此,我们将安全教育同课程…
-
幼儿园“欢庆六一”活动总结
李东内幼儿园“欢庆六一”活动总结六一之前我们是忙碌的,六一过后我们是幸福的。是辛苦带来的幸福,是成功带来的幸福。我们在幸福中反思,…
-
大一下学期班级学习总结报告
20xx~20xx学年下半学期学习总结报告10031101班总体来说,在本班同学共同努力下,本班在20xx~20xx学年下学期中学…
-
品管部20xx年上半年工作总结暨下半年工作计划
转眼间上半年已经成为过去,品管部虽然是从3月份新成立的部门,但工作却是“丰富多彩、任重道远”。现将品管部上半年的工作做一个简单的总…
-
14李外河中心幼儿园庆六一活动总结
李外河中心幼儿园庆六一活动总结20xx、6、36月x日,孩子的节日,童心未泯,我们这帮大孩子也开开心心的过了一个节。。一、领导重视…