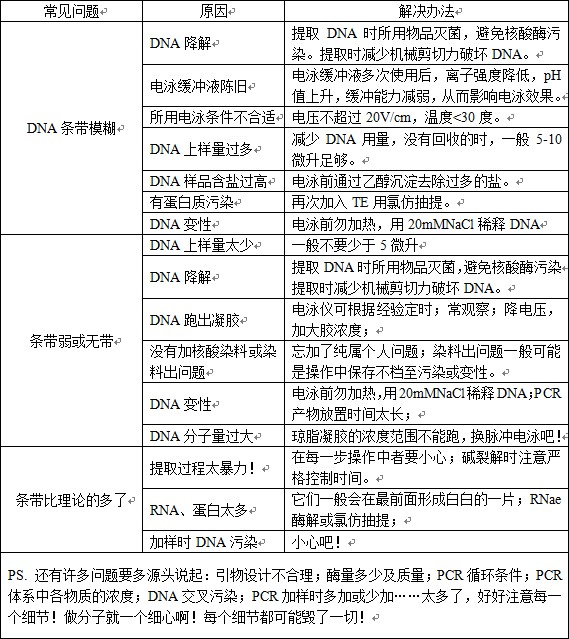
琼脂糖凝胶电泳实验技巧
琼脂糖凝胶电泳实验技巧
核酸分子是两性解离分子,在高于其等电点的电泳缓冲液(pH8.0-8.3)中,基其碱基不解离,而磷酸基团全部解离,核酸分子因而带负电荷,电泳时向正极迁移。琼脂糖主要多海洋植物琼脂中提取而来并经糖基化修饰,为一种聚合链线性分了,使用琼脂糖凝胶作为电泳支持介质,发挥分子筛功能,使得大小和构象不同的核酸分子的迁移率出现较大差异,从而达到分离的目的。琼脂糖凝胶电泳操作简单、快速、通过调整其使用浓度,使得分辨率达到大多实验的要求。因此成为分离、鉴定、纯化核酸分子的常用方法。
一、操作过程中要注意以下一些问题。
1、凝胶制作
1.1 凝胶浓度
凝胶的浓度据实验需要而变,一般在1.8%-2.0%之间,没有用完的凝胶可以再次融化,但随着融化次数的增加,水分丢失也越多,凝胶浓度则会越来越高,导致实验结果不稳定。补水办法:一是在容器上标记煮胶前的刻度,煮胶后补充水分到原刻度;二是在煮胶前称重,煮胶后补充水至原重量。粗略一点的办法是通过多次较恒定的煮胶条件得出一个经验补水值,以保证凝胶浓度基本维持在原浓度。如果条带要回收最好不要用回收胶。
1.2 梳板的选用
一般每个制胶模具均配有多个齿型不同的梳板。梳齿宽厚,形成的点样孔容积较大,用于DNA片段回收实验等;相反,梳齿窄而薄,形成的点样孔容积就较小,用于PCR产物、酶切产物鉴定等。回收的话还可以将几个齿用透明胶带粘起来,形成一个窄而长的大孔以加大点样量提高回收率。梳板的选择主要是看上样量的多少而定。一般来说,上样量小时尽量选择薄的梳板制胶,此时电泳条带致密清晰,便于结果分析。另外,每次制胶时都要注意梳齿与底板的距离至少要1mm,否则,拔梳板时易损坏凝胶孔底层,导致点样后样品渗漏。当然,点样孔的破坏还与拔梳板的时间和方法有关,一般凝胶需冷却30min以上方可拔出梳板,应急的情况下可以将成型的凝胶块入4度冰箱中冷却15min左右,拔梳板的方法是将制胶槽放置在电泳槽中的电泳缓冲液中,然后垂直向上慢慢用力,因为有液体的润滑作用,梳板易拔出且不易损坏点样孔。
2、点样
在样品加入上样缓冲液中含有甘油或蔗糖以增加密度,使样品沉入孔底;上样缓冲液中一般还含有两种指示剂,溴酚兰和二甲苯菁,用于指示样吕的迁移过程。上样缓冲液储存液一般为6倍(10倍),表示其浓度为工作浓度的六倍。使用时上样缓冲液应稀释到一倍浓度。点样方法是将移液枪基本垂直对准点样孔,用另一只手帮助固定移液枪下端,移液枪的枪头尖端进入点样孔即可将样品注入孔内。上样量的多少根据跑胶的目的而不同,一般直接跑DNA时量最少,跑一般的分子标记适中,回收时可以都加进去。最后根据扩增条带的大小点上适合的DNA Maker。
3、电泳
将电泳仪的正极与电泳槽的正极相连,负极与负极相连,每次电泳时都要检查一下电极方向,以免白干(新手来做时可能就有这样的情况发生)。核酸带负电荷,从负极向正极移动。电泳槽中电泳缓冲液与制胶用电泳缓冲液应相同,电泳缓冲液刚好浸过胶为好。电泳缓冲液浓度太大则电流加大,凝胶发热,易使DNA降解。电泳早所加电压一般不超过5v/cm(正负电极之间的距离,而不是凝胶的长度)。电泳时间一般为30-60min,根据实验需要也可作适当调整。电压增高,电泳时间缩短,核酸条带相对来说不够整齐,不够清晰;相反,电压降低,电泳时间较长,条带会相对的清晰。另外,如果电泳后样品泳支很慢或者没移动可能是由于挡板没有拿开。
附 EB作用原理:观察琼脂糖凝胶中DNA最常用的方法是利用荧光染料溴化乙锭进行染色,溴化乙锭含有一个可以嵌入DNA堆积碱基之间的一个三环平面基团。它与DNA的结合几乎没有碱基序列特异性。在高离子强度的饱和溶液中,大约每2.5个碱基插入一个溴化乙锭分子。当染料分子插入后,其平面基团与螺旋的轴线垂直并通过范德华力与上下碱基相互作用。这个基团的固定位置及其与碱基的密切接近,导致与DNA结合的染料呈现荧光,其荧光产率比游离溶液中染料有所增加。DNA吸收254nm处的紫外辐射并传递给染料,而被结合的染料本身吸收302nm和366nm的光辐射。这两种情况下,被吸收的能量在可见光谱红橙区的590nm处重新发射出来。由于溴化乙锭-DNA复合物的荧光产率比没有结合DNA的染料高出20-30倍,所以当凝胶中含有游离的溴化乙锭(0.5ug/ml)时,可以检测到少至10ng的NDA条带。
第二篇:实验三 DNA琼脂糖凝胶电泳
实验三 DNA琼脂糖凝胶电泳
一、实验目的:
掌握DNA电泳的技术方法,利用琼脂糖凝胶电泳检测DNA含量、分子量及分离不同大小的DNA片段。
二、实验原理:
电泳是指带电粒子在电场中向与其自身带相反电荷的电极移动的现象。在PH高于PI时,DNA分子带负电荷,在直流电场中DNA向正极泳动。不同的DNA分子因电荷数、构象不同在同一电泳系统中的泳动速度有差异,从而达到分离的目的。根据迁移率大小可测定DNA分子的大小。DNA迁移率与分子量的对数值成反比。
三、材料、试剂和仪器
实验一提取的DNA样品、 电泳缓冲液1×TAE、 电泳载样缓冲液0.25%溴酚蓝、 40%(w/v)蔗糖水、10mg/ml的溴化乙锭(EB)
四、实验步骤
(一)制胶
1. 称取0.4g琼脂糖置于三角瓶中,加入50ml 1×TAE电泳缓冲液。
2. 微波炉加热、煮沸、振摇,使琼脂糖全部熔化。
3. 将有机玻璃电泳槽洗净,两端分别用橡皮条紧密封住。将封好的胶槽置于水平支撑物上,插上样品梳子。梳子下缘应与胶槽底面保持1mm左右的间隙。
4. 待胶冷却至60℃左右时,在胶液中加入溴化乙锭(EB)2.5μl。将琼脂糖小心倒入胶槽内,使胶液形成均匀的胶层。
5. 待胶完全凝固后,小心向上方拔出梳子,避免前后左右摇晃,以防破坏胶面及加样孔。去掉制胶槽两边的橡皮条,小心将胶槽放入电泳槽中,样品孔在阴极端。
6. 向电泳槽内加入1×TAE电泳缓冲液至液面覆盖凝胶。
(二)上样电泳
1. 取4μl待测液与1μl载样液混匀,用移液枪小心加入样品槽中,每加完一个样品要更换一个枪头。
2. 加完样后,合上电泳槽盖,接通电源,控制电压60V-80V,电流40mA以上。
3. 当溴酚蓝条带移动到浸胶前言约2cm时,停止电泳。
(三)凝胶紫外观察
在波长为254nm的紫外灯下观察,凝胶成像系统中照相、保存。
五、注意事项
1. EB具有强诱变性,可致癌,必须带手套操作。
2. 制胶和加样时要防止产生气泡。
3. 凝胶方向要安放正确。
4. 电泳时确保电泳槽已接通,观察电极气泡。
-
琼脂糖凝胶电泳实验
琼脂糖凝胶电泳实验20xx1103094356来源生物秀评论0我要评论实验二琼脂糖凝胶电泳实验实验目的1学习琼脂糖凝胶电泳的基本原…
-
实验七 DNA的琼脂糖凝胶电泳
实验七DNA的琼脂糖凝胶电泳4学时实验目的琼脂糖凝胶电泳是常用的检测核酸的方法具有操作方便经济快速等优点本实验学习DNA琼脂糖凝胶…
-
质粒DNA的提取及其琼脂糖凝胶电泳实验报告及思考题
1实验目的1通过本次实验学习和掌握碱裂解法提取质粒2通过本次实验学习琼脂糖凝胶电泳检测DNA的方法和技术2实验材料及用品1实验仪器…
-
实验四 DNA的琼脂糖凝胶电泳
龙志敏20xx30220xx109制药一班实验四DNA的琼脂糖凝胶电泳一实验目的1掌握DNA琼脂糖凝胶电泳的原理和方法2学习凝胶成…
-
PCR反应及琼脂糖电泳实验报告
多聚酶链式反应PCR扩增DNA片段及琼脂糖凝胶电泳产物检测一实验目的1了解PCR技术的基本操作2理解PCR的原理3讨论PCR的应用…
-
琼脂糖凝胶电泳实验
琼脂糖凝胶电泳实验20xx1103094356来源生物秀评论0我要评论实验二琼脂糖凝胶电泳实验实验目的1学习琼脂糖凝胶电泳的基本原…
-
PCR反应及琼脂糖电泳实验报告
多聚酶链式反应PCR扩增DNA片段及琼脂糖凝胶电泳产物检测一实验目的1了解PCR技术的基本操作2理解PCR的原理3讨论PCR的应用…
-
实验七 DNA的琼脂糖凝胶电泳
实验七DNA的琼脂糖凝胶电泳4学时实验目的琼脂糖凝胶电泳是常用的检测核酸的方法具有操作方便经济快速等优点本实验学习DNA琼脂糖凝胶…
-
质粒DNA的提取及其琼脂糖凝胶电泳实验报告
一实验名称质粒DNA的提取与纯化DNA琼脂糖凝胶电泳二实验原理1质粒DNA的提取质粒是一类存在于几乎所有细菌等微生物中染色体之外细…
-
聚合酶链式反应和琼脂糖凝胶电泳 实验报告
实验三聚合酶链式反应PCR以及琼脂糖凝胶电泳实验目的1掌握PCR反应的原理及各反应成分的作用2熟悉PCR反应程序的设计规则3掌握引…