实验4 液体饱和蒸气压的测定
物理化学实验备课材料
实验4 液体饱和蒸气压的测定
一、基本介绍
压力是体系的一个重要参数,许多物质的物理化学性质,如熔点、沸点,以及吸附、溶解、扩散、化学平衡移动等物理化学过程都与压力有着密切的关系。压力测量是物理化学实验的主要操作技术之一,因此,体系压力的测量具有实用价值。
在一定温度下,与液体处于平衡状态时的蒸气压力,称为该温度下的饱和蒸气压。这里的平衡状态是指动态平衡。在某一温度下,被测液体处于密闭真空容器中,液体分子从表面逃速成蒸气,同时蒸气分子因碰撞而凝结成浓相。当两者的速率相等时,就达到了动态平衡,此时气相中蒸气密度不再改变,因而具有一定的饱和蒸气压。测定液体饱和蒸气压,可深入了解纯液体饱和蒸气压和温度的关系——克劳馅斯—克拉贝龙方程式,求算被被测液体在实验温度范围内的平均摩尔气化热与正常沸点。。
二、实验目的
1、明确液体饱和蒸气压的定义及气液平衡的概念,了解饱和蒸气压与温度的关系-即克-克方程。
2、测定水在不同外压下的沸点,计算测定温度范围内水的平均摩尔气化热及常压下的沸点。
3、掌握气压计的构造和使用方法。
三、实验原理
在一定温度下,液体与其蒸气达到气液平衡时蒸气的压力,称为液体的饱和蒸气压或称蒸气压。当温度升高时,液体的蒸气压也增大,当蒸气压等于外压时,液体就沸腾,此时的温度就是该压力下液体的沸点。
液体的蒸气压随热力学温度的变化关系可用克拉贝龙方程表示:
dP/dT = △Hv / [T(Vg - Vl)]
式中:△Hv:摩尔汽化热;
Vg:蒸气的摩尔体积;
Vl:液体的摩尔体积。
积分后可得:
lgp = A/T + B dT = △Hv / [T(Vg - Vl)]
式中:A = -△Hv/2.303R;B为积分常数。
由实验测定液体的一系列不同温度下的蒸气压数据,然后用lgp对1/T(或1000/T)作图,求出斜率A,再由A求出△Hv。
四.实验仪器及试剂
蒸气压测定装置一套;真空泵1台;气压计一个,调压变压器1台。
五、实验步骤
1、如图装好装置:
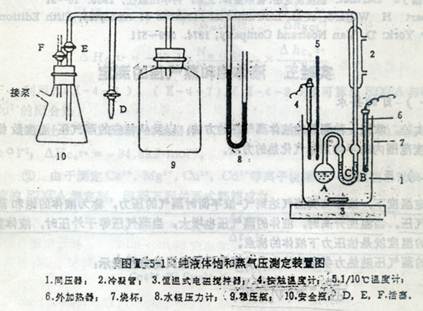
2、记录室内大气压,开启冷凝水。
3、检查系统是否漏气。
4、在60~80℃温度范围内测量纯苯的p-T数值:
打开恒温式电磁搅拌器,接触温度计调至60℃,接上外加热器加热。当接近60℃时,断开外加热器,使升温速度尽可能减慢,约每分钟不超过1℃,令同压器内液体苯与水浴温度尽可能接近平衡。
开启活塞E,关闭放空活塞F及开真空泵抽气,减压一段时间,让A球内液面上的空气被排干净。关闭活塞E,打开放空活塞F,停泵。这时A球内的蒸气通过U型管由C向B缓慢地冒泡,U型管液面B比C高。注意调节水浴温度使温度波动很小,并使温度转为稍有下降的趋势,仔渐调节D阀,放入少量空气,使由B管排出的气泡刚好停止放出,但U型管B端的液面仍比C端稍高。注意观察,待温度稍下降,使B端液面与C端齐高时,立即记录温度读数及水银压力计读数(温度读数要迅速,压力计读数可稍慢)。
再把温度升高,使浴温基本上稳定在第二个较高(约高3℃)的温度点上。重复上述操作,记录第二个温度、压力数据,直至苯在常压下的正常沸点为止,相隔约3℃测一个点,共约8~10个点数据。
六、数据记录

七、实验注意事项
1、真空泵在开泵前,必须观察袖标宙中油面的高低。若油面低于袖标直径的四分之三,不可启动。
2、开泵前,必须用手将主轮按箭头方向旋转数困,以排出泵中的存油,否则将喷泊闯车。
3、在开泵前,首先将三通活塞慢慢与系统接通,抽气的速度以气泡一个个逸出为宜,这样可以避免等位计内液体沸腾过剧,致使8管内的液体抽尽(完)。
4、等位计中液面间的空气必须排除干净 。
5、液体蒸气压与温度有关,故测定过程控温精度须在土O.1一土0.2K。 6
6、在升温时需随时注意调节活塞H使等位计月管液面保持等位,不发生沸腾,也不能使液体倒灌入4球内。
7、在停止实验时,应缓设地先将三通活塞打开.使系统通大气,再使油气泵通大气(防止系中的油倒灌),然后切断电源,最后关闭冷却水,使实验装置复原。
8、整个实验过程中,要严防空气倒灌,否则.实验要重做。为了防止空气倒灌,在每次读取平衡温度和平衡压力数据前,应先关闭活塞G.然后缓慢城压,使空气缓缓进入测量系统。
八、思考题:
1、 △Hv为什么是实验温度范围内的平均值?
在克拉贝龙方程dP/dT = △Hv / [T(Vg - Vl)]中,△Hv被认为是一个常数,所以积分后求出来的△Hv必然是在实验温度范围内的平均值,不然它在克拉贝龙方程中就不能算是一常数。
2、 △vapHm随温度升高而减小,试解释之。根据下式:
d(△vapHm)= [δ(△vapHm)/δT]pdT + [δ(△vapHm)/δP]TdP
推导出单组分系统两相平衡的相变焓(△vapHm)随温度变化的关系式,即Planck方程:
d(△vapHm)/dT = △Cp + △vapHm/T - △vapHm[δln△V/δT]p
(1)∵lgp = A/T + B = -△vapHm/2.303RT +B
∴△vapHm = -(lgp – B)*2.303RT
∴T↑,△vapHm↓
(2)∵d(△vapHm)= [δ(△vapHm)/δT]pdT + [δ(△vapHm)/δP]TdP
∴d(△vapHm)/dT = [δ(△vapHm)/δT]p + [δ(△vapHm)/δP]TdP/dT
= △Cp + [δ(△vapHm)/δP]T*△vapHm / [T△V]
= △Cp + △vapHm/T - △vapHm[δln△V/δT]p
九、预备实验数据处理:
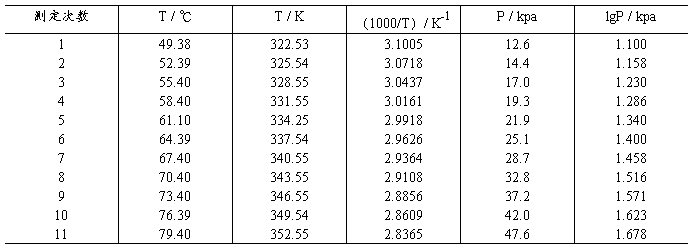
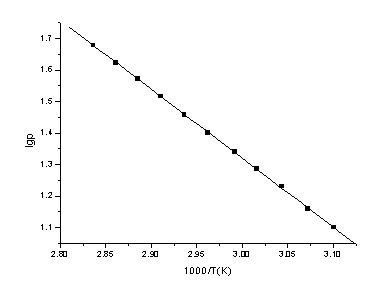
Linear Regression Y = 7.88156-2.18714 X
直线斜率A=-△Hv/2.303R, △Hv=41.86 kJ/mol
-
液体饱和蒸汽压的测定-实验报告
液体饱和蒸汽压的测定一实验目的1明确液体饱和蒸汽压的意义熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯克拉贝农方程2了解静态法测定…
-
4纯液体饱和蒸汽压的测定实验报告
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目纯液体饱和蒸气压的测定静态法实验类型验证设计综合实…
-
实验二 液体饱和蒸气压的测定实验报告
实验二液体饱和蒸气压的测定MeasurementofSaturatedVaporPressure王暮寒PB1020xx67中国科学…
-
液体饱和蒸汽压的测定 实验报告
宁波工程学院物理化学实验报告专业班级化工姓名序号同组姓名指导老师胡爱珠杨建平实验日期20xx年3月19日实验名称实验一液体饱和蒸汽…
-
饱和蒸汽压的测定实验报告
液体饱和蒸汽压的测定实验报告实验题目液体饱和蒸汽压的测定学院化学与化工学院专业生物工程年级112班学号1108110358学生姓名…
-
民办小学工作总结
莘源小学20xx-20xx学年第二学期工作总结本学期,我校始终坚持以邓小平理论、三个代表重要思想的旗帜为引领,认真学习贯彻党的十八…
-
爱心义卖活动总结1
物理与电信工程系团委会、学生会办公室青年志愿者服务中心“爱心义卖”活动总结当寒窗苦读十年的莘莘学子走进自己梦想的大学校门时,他们是…
-
XXX中学开展美化校园活动总结
XXXX中学开展“美化校园、清洁乡村”活动总结根据区、市、县关于“美丽广西、清洁乡村”动员会议及县教育局开展“美化校园、清洁乡村”…
-
优秀的班主任工作总结
记得在一本书上看到,老师分四种类型:智慧爱心型,爱心*劳型,*劳良心型,良心应付型。记得一个优秀班主任在做经验报告的时说::班主任…
-
20xx年退休人员社会化管理(退管)工作总结
主要事迹:20xx年,在区人力资源和社会保障局的正确领导下,我深入学习贯彻落实科学发展观,认真履行工作职责,积极推进退休人员社会化…