心血管活动的神经体液调节
心血管活动的神经体液调节
目的和原理 支配心脏的传出神经主要为心交感神经和心迷走神经,心交感神经兴奋可致心率加快,房室交界的传导加快,心房肌和心室肌的收缩能力加强,而心迷走神经兴奋可致心率减慢,心房肌收缩能力减弱,房室传导速度减慢。绝大多数血管平滑肌受自主神经支配,主要是交感缩血管神经纤维,兴奋时使血管收缩,外周阻力增加,同时由于容量血管收缩,静脉回流增加,心输血量亦增加。神经系统通过心血管反射(如压力感受性反射等)调节心血管的活动,改变心输出量和外周阻力,从而调节动脉血压。
心血管活动除受神经调节外,还受体液因素的调节,其中最主要的为肾上腺素和去甲肾上腺素。肾上腺素可与α和β两类肾上腺素能受体结合,使心率加快,收缩力加强,传导加快,心输出量增加。其对血管的作用取决于血管平滑肌上两类受体分布的情况。去甲肾上腺素主要激活α受体,使血管收缩,外周阻力增加,动脉血压升高,其对心脏作用远较肾上腺素为弱。
本实验通过动脉血压的变化来反映心血管活动变化,目的在于观察心血管活动的神经体液调节和学习哺乳类动物动脉血压的直接测量方法。
实验对象 家兔
实验器材和药品 MS-302微机系统,血压换能器,保护电极,兔手术台,哺乳动物手术器械一套,照明灯,铁支柱,双凹夹,动脉夹,三通管,塑料动脉插管,注射器(1毫升,5毫升,20毫升),黑线,白线,纱布,棉花,1%戊巴比妥钠,1∶1000肝素,1∶10000去甲肾上腺素,12.5单位/毫升肝素生理盐水,生理盐水。
实验步骤
一、手术准备
(一)麻醉并固定动物:用1%戊巴比妥钠按3.0~3.5ml/kg的剂量由耳缘静脉缓慢注入。动物麻醉后,仰卧固定于手术台上。
(二)分离颈部神经和血管:在气管右侧辨别并分离减压神经和迷走神经,减压神经最细,常与交感神经紧贴在一起。分别在各神经下方穿以不同颜色的丝线备用。分离时特别注意不要过度牵拉,并随时用生理盐水湿润,分离左侧颈总动脉在其下方穿两条线备用。
(三)插动脉插管和气管插管:静脉注入1000单位/公斤肝素以抗凝。在左侧颈总动脉插入已充满肝素生理盐水的动脉插管,用备好的结扎线固定。插好气管插管,保持呼吸通畅。
(基本操作步骤见后附录)
二、实验纪录装置
(一)、将压力换能器插头连到MS-302微机系统相应通道的插座(例如2通道记录时插入插座2)压力腔内充满液体,排除气泡经三通与动脉插管相连。
(二)、开机后自动启动MS-302系统。
(三)、选定“信号输入”为“压力”并自动调零,调零时应将左侧颈总动脉上的动脉夹保持加闭,并将压力换能器上的另一塑料导管的血管钳打开,使换能器的压力腔与大气相通,从而使输入为零。调零完毕后,用血管钳夹闭该塑料管,再将颈总动脉上的动脉夹放开,此时,动脉血压的变化就能通过压力换能器转变为电信号输入微机,并在微机的显示器上的相应通道显示出压力曲线。
(四)、根据换能器的灵敏度设定该通道的“增益选择”,一般设为8或4mv/cm档。
(五)、走纸速度设定“显速选择”,调整扫描速度,一般可采用25mm/s或10mm/s。
(六)、如果血压曲线没有显示在所选通道的正中位置,则选中“参数设置”,按“回车键”后选中“基线位移”,按“回车键”,选中相应通道后按“回车键”,用上下左右光标移动键调整血压曲线于该通道的正中位置。
(七)、调整“参数设置”中的“横向压缩”为1:5左右,使血压的二级波能清楚的显示出来。
(八)、选择“参数设置”中的“显示方式”,设置为“连续示波显示”。
(九)、待血压稳定后即可开始正常记录,按“Esc键”选“记录状态”,然后按“回车键”。选择“自己命名”,再按“回车键”,输入自己想好的一个文件名,按“回车键”,即可开始记录。记录中按“F2键”作必要的标记。
三、观察项目
(一)、正常血压曲线:观察血压的一级波和二级波,有时可见三级波。观察完毕后应打上标记,方法如下:按“F2键”,选择所用的通道,按上下光标键翻页,左右光标键选择所需的文字标记,如果标记内容中无所需文字标记,则按“Esc键”打上数字标记(微机会自动按顺序排列数码),并记住该数字标记实际代表的文字内容。
(二)、夹闭颈总动脉:用动脉夹夹闭右侧颈总动脉15秒,观察血压的变化,夹闭之前先按“F2键”,选择所用通道后按回车键,选择所需的文字标记,例如此时应选中“夹闭颈总动脉”,并在夹闭动脉的同时按“回车键”打上标记(以后打标记过程与此相同)。
(三)、电刺激减压神经:刺激之前先“设刺激器”,将“刺激方式”设为“连续刺激”,强度设为1v或1.5v,按“F5”给予刺激输出。将完整的减压神经搭在电极上刺激约15~20秒,并同时打上标记,观察血压的变化。再在神经中部做双结扎,在双结扎之间剪断神经,分别刺激其中枢端与外周端,观察血压变化,并在刺激同时打上标记。
(四)、电刺激迷走神经:结扎迷走神经,剪断其中枢端,电刺激其外周端,同时打上标记,并观察血压变化。
(五)、静脉注射去甲肾上腺素:由耳缘静脉注入1:10000的去甲肾上腺素0.3ml,同时打标记并观察血压变化。
(六)、放血、补液:从右侧颈总动脉插入放血管,将血放入烧杯中,并同时打标记,当动脉血压降至50mmHg左右时,迅速补充37oC生理盐水,同时打标记,并观察血压变化。
(七)、结束实验:按“Esc键”进入“监视状态”。
编辑、打印
一、实验结束后,进入“重显资料”状态,选择本次所做实验的文件名,按“回车键”,进入重显界面,则刚才所做实验图形可重新显示。
二、按“F4键”可进行重显状态下的“重显速度”和“横向压缩”的调整,“重显速度”选4或5级,“横向压缩”选1:4或1:5。
三、选“标记显示”,按上下左右光标移动键可逐个显示所打标记,以便剪辑。先显示第一个标记,当所需图形显示出来后,按空格键使走“纸”暂停,使图形停在一个合适的位置。
(四)、按“F7键”,出现一条剪辑线,按上下左右光标移动键(上下键为粗调,左右键为微调)将剪辑线移到所要选图形的开始位置,按“回车键”,确认起点;同样,按“F8”将另一剪辑线移到所要选图形的终止位置,按“回车键”,确认终点。即可剪辑下第一个标记处的有价值的图形。用同样的方法剪辑其他标记的有价值的图形。所有剪辑过的图形形成一个文件:“R-文件名”。
(五)、剪辑完毕后,按“Esc键”进入“监视状态”。
(六)、打印
1.在打印之前,首先进行屏幕颜色和图形颜色的设置,将所要打印的图形颜色设置为黄色或白色,将背景颜色设为蓝色或黑色,才能被打印出来。设置方法如下:选择“参数设置”,按“回车键”;选择“屏幕颜色”,可分别选择“1通道图形”、“2通道图形”、“3通道图形”、“背景颜色”、“方格背景”的子菜单,选择其中一项后,在子菜单后部显示一个色块,可用左右光标键选择所需色调,该项显示即改变为所选颜色,按“回车键”确认并退出。按同样的方法可改变其他通道的颜色和背景颜色。
2.选择“打印选择”,按“回车键”,子菜单区显示“1通道图形”、“2通道图形”、“3通道图形”、“数据打印”四项内容,可以反复按“回车键”来选择打印或不打印,选取后按“Esc键”退出。
3.进入“重显资料”,选择“R-文件名”,按“回车键”,待图形出现后,按“空格键”,屏幕冻结。打印机进纸联机后,按“F9键”即可打印。如一屏显示不完,可反复使用“空格键”,分屏打印,最终打印出全部实验数据图形。
课堂讨论
1.正常血压的一级波、二级波及三级波各有何特征?其形成机制何在?
2.夹闭一侧颈总动脉后血压发生什么变化?试述其机制。
3.刺激完整的减压神经及其中枢端和外周端,血压各有何种变化?为什么?
4.为何预先切断迷走神经,再刺激其外周端?
5.去甲肾上腺素和肾上腺素对心血管的作用有何不同?
附录
家兔颈部神经分离、动脉插管及气管插管。
(一)麻醉并固定动物 用1%戊巴比妥钠3.0~3.5ml/kg的剂量从耳缘静脉注入。待动物麻醉后,背位固定于手术台上。
(二)分离颈部神经和血管 剪去颈前部的毛,沿正中线作一个5~7厘米的皮肤切口。分离皮下组织和肌肉,暴露气管。于气管两侧找到颈总动脉、迷走神经、颈交感神经和减压神经。首先仔细识别并分离三条神经,其中迷走神经最粗,交感神经其次,减压神经最细,常与交感神经紧贴在一起。在减压神经及迷走神经下分别穿不同色的线备用。分离时切注意不要过度牵拉,并随时用生理盐水湿润。然后分离颈动脉,下穿两条线备用。
(三)插动脉插管 静脉注入1000单位/公斤肝素以抗血凝。在左侧颈总动脉的近心端夹一动脉夹阻断血流,并在动脉远心端距动脉夹约3厘米处结扎。 用小剪刀在结扎线的近心侧剪一以45°角斜向近心端的小口,向心脏方向插入动脉插管,用备好的线结扎固定。
(四)插气管插管 在气管下穿线,于甲状软骨下1~2个环状软骨间用粗剪刀剪开气管的一半,并向下方作一纵切口,使切口呈倒“T”形。插入气管插管,并用备好的线固定。(图1)

图1 气管切开术和气管插管法
注意事项
1.操作切忌粗暴,随时用生理溶液湿润组织以保持活性。
2.忌用金属器械触及、夹捏神经。
课堂讨论
1.如何判断麻醉效果的深度?
2.动脉麻醉过程中常会出现什么问题? 应如何处理?
3.处死动物的方法有哪些?
4.如何分离神经、血管? 注意事项有哪些?
第二篇:实验四 心血管活动的神经体液调节
[实验目的]
学习记录哺乳动物动脉血压的直接测定方法,并观察神经-体液因素对心血管活动的调节。
[实验原理]
在正常生理情况下,心血管活动受神经、体液和自身机制的调节。
心脏受交感神经和副交感神经的支配。心交感神经兴奋时,使心率加快、心肌收缩力加强,心内兴奋传导加快,心输出量增加、动脉血压升高。心迷走神经兴奋时,使心率减慢、心房肌收缩力减弱、房室传导减慢,从而使心输出量减少、动脉血压下降。在神经调节中以颈动脉窦-主动脉弓的减压反射尤为重要,当动脉血压升高时,压力感受器发放冲动增加,通过中枢反射性引起心率减慢、心肌收缩力减弱、心输出量下降、血管舒张和外周阻力降低,使血压降低。反之,当动脉压下降时,压力感受器发放冲动减少,神经调节过程又使血压回升。支配血管的交感缩血管神经兴奋时,使血管收缩、外周阻力增加、动脉血压升高。
家兔的压力感受器的传入神经在颈部从迷走神经分出,自成一支,称为减压神经,其传入冲动随血压变化而变化。
心血管活动还受肾上腺素和去甲肾上腺素等体液因素的调节。它们对心血管的作用既有共性,又有特殊性。关键取决于心、血管壁上哪一种受体占优势。肾上腺素对α与β受体均有激活作用,去甲肾上腺素主要激活α受体而对β受体作用很小,因而使外周阻力增加,动脉血压升高,但对心脏的作用要比肾上腺素弱。
[实验对象]
家兔。
[实验药品]
生理盐水,20%氨基甲酸乙脂(或3%戊巴比妥钠),肝素(500 U·ml-1),1: 10000肾上腺素,1: 10000去甲肾上腺素,1: 10000乙酰胆碱。
[仪器与器械]
计算机生物信号采集处理系统(或二道生理记录仪、刺激器),兔手术台,手术器械一套,气管插管,动脉夹,动脉套管、血压换能器,保护电极,棉线,纱布,棉球、注射器(50、10、2 ml),支架,双凹夹。 [实验方法与步骤]
1.实验准备:
(1)麻醉和固定:家兔称重后,耳缘静脉缓慢注射20%氨基甲酸乙酯(5 ml·kg-1)或3%戊巴比妥钠(1 ml·kg-1)进行麻醉。当动物四肢松软,呼吸变深变慢,角膜反射迟钝时,表明动物已被麻醉,即可停止注射。将麻醉的家兔仰卧位固定于兔手术台上。
图7.10-1 兔左侧内脏大神经的解剖位置
(2)分离颈部神经、血管和插气管插管 颈部剪毛,沿颈部正中线切开皮肤5~7 cm,用止血钳钝性分离皮下组织及浅层肌肉,暴露和分离气管;分离左、右两侧颈总动脉(左颈总动脉尽量分离长些,以做动脉插管用。当向头端追索到甲状软骨上缘,可见到左颈动脉分支为颈外和颈内动脉,在颈内动脉基部有一膨大处,为颈动脉窦。);分离右侧的迷走神经、交感神经和减压神经。在分离的气管、颈总动脉及神经下方各穿一不同颜色的线备用(见3.7.4)。并在减压神经下放一钩状记录电极,实验过程中将电极悬空(但不要拉得过紧)。将神经周围的皮肤提起做一皮兜,在神经表面滴上38℃液体石蜡,以防止神经干燥,并起到绝缘效果。
(3)进行气管插管(见3.7.4) 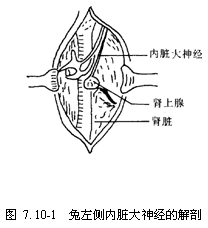
(4)分离内脏大神经(此步也可放在刺激内脏大神经前进行):将动物右侧卧位,在腰三角作一长4~5 cm的斜行切口,逐层分离至腹膜处,从左侧腹后壁(或沿腹中线切开皮肤)找到左肾,并将左肾向下推压,在其右上方可见一浅黄色黄豆粒大小的肾上腺。沿肾上腺上方可见内脏大神经(图7.10-1),小心分离主干,在其下方穿一丝线,并安放好保护电极备用。
(5)插动脉插管:做插管手术前经耳缘静脉注射肝素(500 U·(kg体重)-1),在左侧颈总动脉插入动脉插管(见3.7.4)。
2.连接实验装置:
(1)二道生理记录仪 将血压换能器固定在支架上,并与二道生理记录仪的血压放大器输入端相连。调整记录仪,对血压放大器定标。校正选择调至13.3 kPa(100 mmHg),灵敏度置于50,记录笔上移2 cm。
-
家兔动脉血压的神经体液调节实验报告
目的与要求1学习直接测定家兔动脉血压的急性实验的方法2观察神经体液因素对心血管活动的影响基本原理在正常人体内任何高等动物的动脉血压…
-
家兔动脉血压的神经与体液调节--浙中大机能学实验报告
浙江中医药大学实验报告日期20xx12地点机能学实验室15109家兔动脉血压的神经与体液调节摘要1目的动脉血压是循环功能的重要指标…
-
【实验报告】家兔动脉血压的神经体液调节 影响尿生成的因素
生理实验报告实验六家兔动脉血压的神经体液调节影响尿生成的因素实验目的1234间接观察心血管活动的神经体液性调节学习哺乳动物动脉血压…
-
实验十一 家兔动脉血压的神经、体液调节
生理学实验报告中山大学生命科学学院实验十一家兔动脉血压的神经体液调节介绍一123二实验目的学习家兔颈部手术与分离主动脉神经的方法学…
- 生理实验 心血管活动的神经体液调节
-
家兔动脉血压的神经体液调节实验报告
目的与要求1学习直接测定家兔动脉血压的急性实验的方法2观察神经体液因素对心血管活动的影响基本原理在正常人体内任何高等动物的动脉血压…
-
家兔动脉血压的神经与体液调节实验数据处理与分析
动物生理学实验报告实验五家兔动脉血压的神经与体液调节实验数据处理与分析1兔血压实验记录表动物生理学实验报告2兔血压实验图及分析步骤…
-
家兔动脉血压的神经与体液调节--浙中大机能学实验报告
浙江中医药大学实验报告日期20xx12地点机能学实验室15109家兔动脉血压的神经与体液调节摘要1目的动脉血压是循环功能的重要指标…
-
【实验报告】家兔动脉血压的神经体液调节 影响尿生成的因素
生理实验报告实验六家兔动脉血压的神经体液调节影响尿生成的因素实验目的1234间接观察心血管活动的神经体液性调节学习哺乳动物动脉血压…
-
【报告】实验6:家兔动脉血压的神经与体液调节
家兔动脉血压的神经与体液调节浙江中医药大学第一临床医学院摘要实验目的采用直接测量和记录动脉血压的急性实验方法观察神经和体液因素对动…