碱性磷酸酶米氏常数的测定
碱性磷酸酶米氏常数的测定
【实验目的】通过碱性磷酸酶(alkaline phosphatase,AKP)米氏常数的测定,了解其测定方法和意义。学会运用标准曲线测定酶的活性及观察抑制剂对酶促反应动力学的影响,加深对酶促反应动力学的理解。
【实验原理】本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。 酚在碱性条件下与4-氨基安替比林作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。根据吸光值的大小可以计算出酶的活性,也可以从标准曲线上查知酚的含量,进而算出酶活性的大小。
【实验步骤】1. 底物浓度对酶促反应速度的影响
(1) 取6支试管,作好标记。按下表操作:(未加抑制剂组)
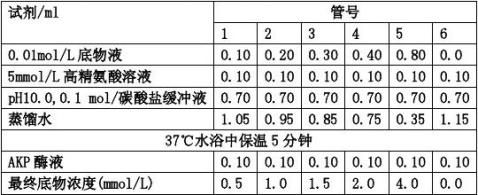
(2) 加入酶液(0.05μg/ml)后,各管混匀并立即记录时间,将上述各管置37℃水浴中准确保
温
15分钟。
(3) 保温结束,立即加碱性溶液1.1 ml终止反应。
(4) 各管分别加入0.3% 4-氨基安替比林1.0 ml,0.5%铁氰化钾2.0 ml,充分混匀,放置
10分钟,以6号空白管作对照,于510 nm波长处比色,根据酚标准曲线计算酶活性。
(5) 以各管基质浓度的倒数1/[S]为横坐标,以各管吸光度值的倒数或者以酶活性单位的倒
数为1/V做横坐标,作图求出Km值。
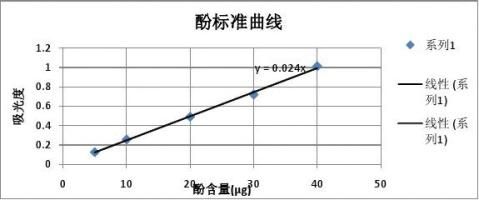
2.酚标准曲线的绘制
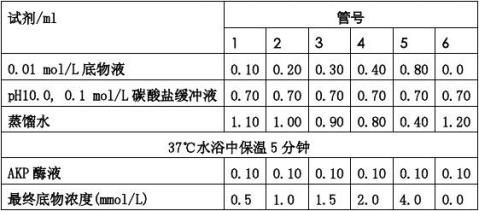
(1) 取洁净干燥试管6支,按下表依次加入试剂:
(2) 混匀后室温放置15分钟,于510 nm波长处比色。
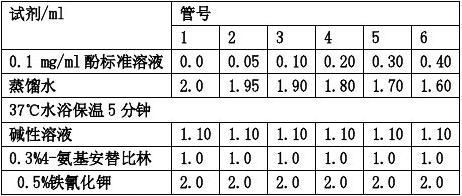
【实验结果与分析】 1.未加抑制剂组
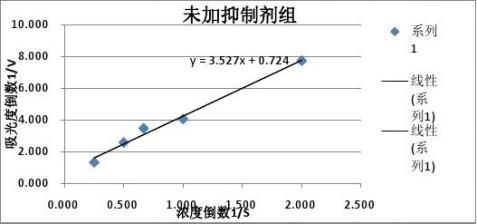
1????
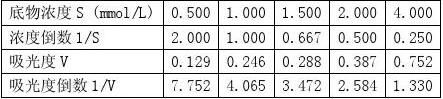
得到拟合直线方程:y=3.5275x+0.7246 根据
1?
=
??????
?+
?
1
可得到:
????=1/0.7246=1.382, ??=????*3.5275=4.871
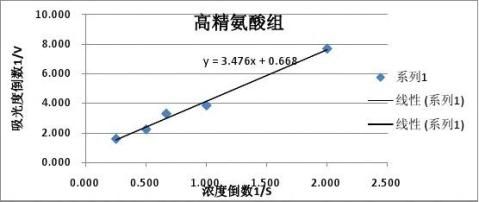
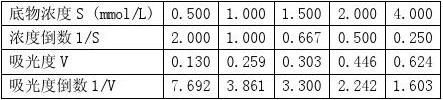
得到拟合直线方程:y = 3.4764x + 0.6688
根据1
?=??
?????+?11????可得到:
????=1/0.6688=1.495,
??=????*3.4764=5.198
3.酚标准曲线
分析:由上述图表来看,在加入高精氨酸抑制酶活性后,酶的Km值增大,Vm值也增大
【实验讨论】
1. 在实验过程中,滴加试剂和反应时间的控制一定要准确,以保证得到准确的实验结果。
2. Km值指最大反应速率一半时底物浓度,它只与酶的结构、反应物和环境有关,而与酶的
浓度没有关系;所以Km值可以表示酶与底物之间的亲和力,Km值越小,亲和力越高,越容易反应;反之,值越大,亲和力余地,越不易反应。
第二篇:米氏常数
米氏常数是酶的特征性常数,可用来表示酶和底物亲和力的大小。米氏常数与底物浓度和酶浓度无关,而受温度和pH值的影响,竞争性抑制剂米氏常数增大,最大反应速度不变;非竞争性抑制剂米氏常数不变,最大反应速度减小;反竞争性抑制剂米氏常数减小,最大反应速度减小。
Km:米氏常数,是研究酶促反应动力学最重要的常数。它的意义如下: 它的数值等于酶促反应达到其最大速度Vm一半时的底物浓度〔S〕,图示以及公式推导。 它可以表示E与S之间的亲和能力,Km值越大,亲和能力越强,反之亦然。 它可以确定一条代谢途径中的限速步骤:代谢途径是指由一系列彼此密切相关的生化反应组成的代谢过程,前面一步反应的产物正好是后面一步反应的底物,例如,EMP途径。限速步骤就是一条代谢途径中反应最慢的那一步,Km值最大的那一步反应就是,该酶也叫这条途径的关键酶。 它可以用来判断酶的最适底物,某些酶可以催化几种不同的生化反应,叫多功能酶,其中Km值最小的那个反应的底物就是酶的最适底物。 Km是一种酶的特征常数,只与酶的种类有关而与酶的浓度无关,与底物的浓度也无关,这一点与Vm是不同的,因此,我们可以通过Km值来鉴别酶的种类。但是它会随着反应条件(T、PH)的改变而改变。
米氏常数是酶的特征性常数,可用来表示酶和底物亲和力的大小。米氏常数与底物浓度和酶浓度无关,而受温度和pH值的影响,竞争性抑制剂米氏常数增大,最大反应速度不变;非竞争性抑制剂米氏常数不变,最大反应速度减小;反竞争性抑制剂米氏常数减小,最大反应速度减小。
Km:米氏常数,是研究酶促反应动力学最重要的常数。它的意义如下: 它的数值等于酶促反应达到其最大速度Vm一半时的底物浓度〔S〕,图示以及公式推导。 它可以表示E与S之间的亲和能力,Km值越大,亲和能力越强,反之亦然。 它可以确定一条代谢途径中的限速步骤:代谢途径是指由一系列彼此密切相关的生化反应组成的代谢过程,前面一步反应的产物正好是后面一步反应的底物,例如,EMP途径。限速步骤就是一条代谢途径中反应最慢的那一步,Km值最大的那一步反应就是,该酶也叫这条途径的关键酶。 它可以用来判断酶的最适底物,某些酶可以催化几种不同的生化反应,叫多功能酶,其中Km值最小的那个反应的底物就是酶的最适底物。 Km是一种酶的特征常数,只与酶的种类有关而与酶的浓度无关,与底物的浓度也无关,这一点与Vm是不同的,因此,我们可以通过Km值来鉴别酶的种类。但是它会随着反应条件(T、PH)的改变而改变。
Michaelis & Menten 于19xx年推导出了上述矩形双曲线的数学表达式,即米氏方程: ν= Vmax[S]/(Km+[S])。其中,Vmax为最大反应速度,Km为米氏常数。
传统上,米氏方程动力学描述的是分子数量为1015的集体分子的行为,米氏方程在单分子水平上也是有效的。
⑶Km和Vmax的意义:
①当ν=Vmax/2时,Km=[S]。因此,Km等于酶促反应速度达最大值一半时的底物浓度。
②当k-1>>k+2时,Km=k-1/k+1=Ks。因此,Km可以反映酶与底物亲和力的大小,即Km值越小,则酶与底物的亲和力越大;反之,则越小。
③Km可用于判断反应级数:当[S]<0.01Km时,ν=(Vmax/Km)[S],反应为一级反应,即反应速度与底物浓度成正比;当[S]>100Km时,ν=Vmax,反应为零级反应,即反应速度与底物浓度无关;当0.01Km<[S]<100Km时,反应处于零级反应和一级反应之间,为混合级反应。
④Km是酶的特征性常数:在一定条件下,某种酶的Km值是恒定的,因而可以通过测定不同酶(特别是一组同工酶)的Km值,来判断是否为不同的酶。
⑤Km可用来判断酶的最适底物:当酶有几种不同的底物存在时,Km值最小者,为该酶的最适底物。
⑥Km可用来确定酶活性测定时所需的底物浓度:当[S]=10Km时,ν=91%Vmax,为最合适的测定酶活性所需的底物浓度。
⑦Vmax可用于酶的转换数的计算:当酶的总浓度和最大速度已知时,可计算出酶的转换数,即单位时间内每个酶分子催化底物转变为产物的分子数。
⑷Km和Vmax的测定:主要采用Lineweaver-Burk双倒数作图法和Hanes作图法。
-
诚信考试动员大会 总结
山西农业大学信息学院农业与生命科学系学生会活动总结活动名称:诚信考试动员大会部门名称:科技部活动时间:20xx年x月x日诚信考试动…
-
质量检查总结
20xx.9.28(一)、钢筋工程1、加工厂在检查时主要对格栅拱架的细部尺寸进行了检查,结果如下:1)、花拱架连接钢板:(设计尺寸…
-
XX路改造工程工作总结
XX路改造是今年县委、县政府确立的三大城建重点工程之一,是人民群众期盼已久的“民心工程”,领导重视,社会瞩目。在县委、县政府的统一…
-
开展综治,维稳宣传月活动总结
宜工商南办?20xx?38号开展综治、维稳宣传月活动总结县综治委:按照南综治委[20xx]11号文件《关于开展社会治安综合治理、维…
-
学生会工作总结——
一转眼,加入到校学生会已经一年半了,而加入到社区服务部已经半年了。而在这和社区服务部20多个兄弟姐妹相处的半年里,我深深的感受了这…