盐酸溶液的配制与标定
实验五、盐酸溶液的配制与标定
一、实验目的
1、练习差减法称量;
2、学习酸式滴定管的使用
3、学习指示剂的原理和使用
4、学会盐酸配制和标定
二、实验原理
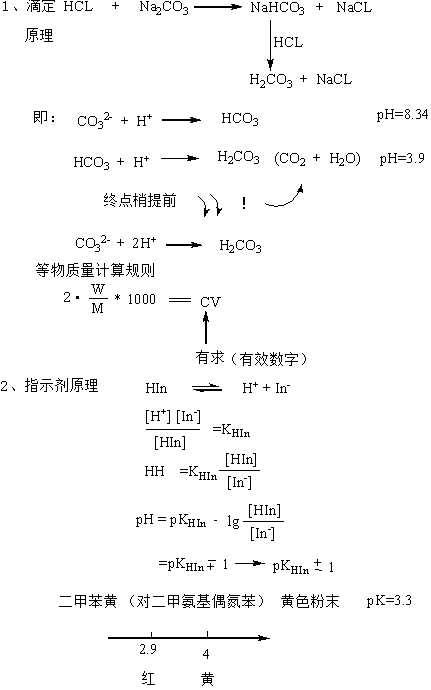
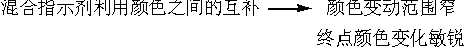

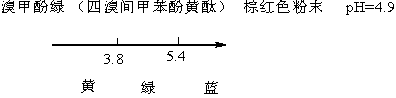
三、实验步骤
1、0.1mol/L盐酸溶液的配制
(1) 计算配制500ml0.1mol/L盐酸溶液所需浓盐酸的体积。
(2) 量取计算体积的浓盐酸,倒入盛有适量蒸馏水的试剂瓶中,加水稀释至500ml,摇匀。
2、盐酸溶液浓度的标定
(1) 差减法称取0.13—0.15g无水Na2CO3三份,称准至0.0001g。
(2) 加水50ml搅拌,使Na2CO3完全溶解。
(3) 加入9滴溴甲酚绿-二早基黃混合指示剂,用已读好读数的滴定管慢慢滴入待测盐酸溶液,当溶液由绿色变为亮黃色即为终点。
四、实验记录
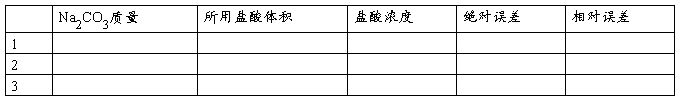
五、数据处理
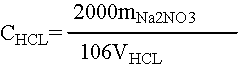
六、思考题
1、 滴定管内壁挂有液滴,可否对实验结果产生影响?
2、 NaOH溶液和HCl溶液能否做基准试剂?能否直接在容量瓶中配制0.1000mol/L的NaOH溶液?
HCl浓度的标定(开放实验)
——溶液的配制
一、实验目的
1、学习常用溶液的配制方法;
2、学习容量瓶和移液管的使用。
二、实验原理
(一)、一般溶液的配制
1、 直接水溶法
易溶不水解物:NaOH、H2C2O4、KNO3、NaCl等
托盘天平称重→ 烧杯,少量水溶解→ 量筒蒸馏水稀释。
2、 介质水溶法
易水解固体试剂:FeCl3、SbCl3、BiCl3等
托盘称重→烧杯→适量酸(碱)溶液→蒸馏水(量筒)稀释。
I2→烧杯+KI适量溶解后→稀释。
3、 稀释法
配稀酸如H2SO4、HNO3、HAC等
量筒称浓溶液→稀释相应浓度。
注:硫酸往水中到
保存:Sn2++Sn;Fe2++Fe
AgNO3 ,KMnO4 , KI放在棕色瓶中;HF→塑料瓶。
(二)、标准溶液的配制
已知准确浓度的溶液→标准溶液
配制:直接法
分析天平—精称基准溶液(可直接把标准溶液或可标定溶液浓度的物体,称量)→烧杯→适量去离子水溶解→转入容量瓶→稀至刻度。
三、实验内容
1、配制25cm3 、1mol/dm-3的NaOH溶液
M=39.9972≈40
40/1000×25=1g → 量筒25cm3水→直接水溶法
2、配制酸 → 稀释法
浓硫酸 密度1.84重量%:95-96% mol/L:18
浓盐酸 密度1.19重量%:38% mol/L:12
浓硝酸 密度1.4重量%: 65% mol/L:14
配制: 3 mol/dm-3的硫酸溶液100ml
16.7ml → 100ml 取浓硫酸6.67ml滴入13ml水中稀释到20ml
2 mol/dm-3 盐酸溶液:20ml
× 2 mol/dm-3 硝酸溶液:20ml
3、盐的配制
NaCl: M=58.443 配 20ml 0.1 mol/dm-3 ,0.12g →20ml水
FeSO4·7H2O:M=278.02 配 20ml 0.1 mol/dm-3 0.56g →20ml水+还原铁粉(或铁钉)
4、准确称取1.0210-1.0213 mol/dm-3 KHC8H4O4→溶于(烧杯)
少量水中→转入50ml容量瓶中。计算准确浓度。
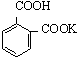 M=204.21, 浓度约0.1 mol/L
M=204.21, 浓度约0.1 mol/L
可用于标定碱←标准KHC8H4O4溶液
5、Na2B4O7溶液的配制
准称:0. 9530-0.9533mol/L Na2B4O7?10H2O→溶于(烧杯)少量水中→转入50ml容量瓶中→计算准确浓度,约0.05mol/L。
可用于滴定酸。
当然如果需要较精确的浓度值时,还需要用标准氢氧化钠进行滴定.
市面销售的品种的数据:
程度 密度(g/cm3) 质量分数(%) 摩尔浓度(mol/L)
饱和 1.30 45 16
浓盐酸 1.19 38 12
稀盐酸 1.10 20 6
稀盐酸 1.03 7 2
说明:6N=6 mol/L
浓盐酸约为35%到40%。
如果你所说的是浓度的话,配20%选40%的话 ,取10ml 配成20ml就可以了
第二篇:稀盐酸的配制和滴定实验
稀盐酸的配制和滴定实验
实验时间:2014.3.21 报告人:武伟
一、 实验目的
综合运用上几节课的知识,自己配制稀盐酸,并用滴定的方法确定其浓度。
二、 实验原理
1. 由于浓盐酸具有挥发性,所以实验室中浓盐酸的精确浓度就不得而知,故不可以采用稀释浓盐酸的方法来得到稀盐酸。要获得精确浓度的稀盐酸,要先将浓盐酸稀释至一个大致范围内,然后通过滴定的方法来确定稀盐酸的精确浓度。
2. 用未知浓度的盐酸去滴定已知浓度的碳酸钠溶液,碳酸钠吸水较慢,所以快速称量操作可以获得准确质量的碳酸钠。
3. 到达滴定终点时,溶液呈酸性,所以选择变色范围在pH 3.1-4.4的甲基橙作为指示剂,在整个滴定过程中,溶液颜色由黄色变为橙色。
三、 实验器材
锥形瓶3个,电子分析天平,大试剂瓶(1000 mL), 小量杯(10 mL),大量杯(500 mL),蒸馏水,滴定管
四、 实验内容
i. 配制稀盐酸
1. 取大试剂瓶(1000 mL), 小量杯(5 mL),大量杯(500 mL)各一个洗净,用蒸馏水润洗三次,大试剂瓶要倒转检漏。
2. 用量杯取500 mL蒸馏水,加入大约一半到大试剂瓶中。
3. 用拇指指甲指在小量杯的5 mL处,在通风柜中打开装有浓盐酸的试剂瓶,迅速将浓盐酸转移量杯中,看到液面在指甲处时即可。然后迅速将量杯中的浓盐酸倒入大试剂瓶中,并盖好浓盐酸的试剂瓶。
4. 将剩余的250 mL蒸馏水加入到试剂瓶中,盖好瓶盖,摇匀。
ii. 滴定稀盐酸
1. 用分析天平秤取0.2-0.3 g碳酸钠于锥形瓶中,共三份,用于三次滴定,标好每个锥形瓶中碳酸钠的质量。
2. 向每个锥形瓶中加入80 mL蒸馏水,摇晃使碳酸钠溶解。然后向每个锥形瓶中滴入两滴甲基橙。
3. 按照滴定的原理操作用配好的盐酸滴定碳酸钠溶液,到达滴定终点时溶液为橙色。
iii. 数据处理

五、 思考题
1. 0.07980的有效数字是几位?
四位
2. 标定盐酸除了用碳酸钠以外还可以用何种基准物质?为什么HCl和NaOH标准溶液配制后,一般要经过标定?
还可以用硼砂N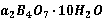 ;因为浓盐酸易挥发,NaOH易吸水,
;因为浓盐酸易挥发,NaOH易吸水,
3. 为什么可以用甲基橙做指示剂?能否改用酚酞做指示剂?
因为甲基橙的变色范围在酸性范围,在到达滴定终点的过程中,颜色由浅变深,易于观察;不可以用酚酞
4. 乘放碳酸钠的锥形瓶是否需要预先烘干?加入的水量是否需要准确?
不需要;不需要
5. 第一份滴定完成后,如滴定管中剩下的滴定溶液还足够做第二份滴定时,是否可以不在添加滴定溶液?为什么?
不可以,可能会使误差叠加
六、 心得体会
几乎每次做滴定实验都会有这么一个感觉,滴的时候吧心里老恐惧了,总觉得滴进去没反应,滴进去没反应,等一下它突然一下子就变了怎么办?那我岂不是要重新做?总想问问其它已经完成的小伙伴,哎,给我个模版啊,你滴了多少啊,好让自己心里有个数。但是,仔细想想,这样真的对自己好么,难道以后没有人做过的实验你就不做啦?探索科学的意义单单就是把别人走过的路再走一遍么?比起走过的路,我更觉得没走过的路才是有趣的路!你总要去走自己的路,承担这条路带给你的一切,或开心或痛苦。幸亏只是想问一下小伙伴,还没问,咱自己做呗,最多就是和郑帅哥呆到晚上,怕什么?于是就开始滴,说是会黄色变橙色,这还真难把握,不过自己慢慢做的时候会发现,快到终点时,你每滴一滴进去,刚滴到的地方就是红色的,你摇一下,混和均匀以后红色就会消失了,出现了这样的情况基本就是快到终点了,真是探索过才知道。滴定完成了,总想滴它个过量,看看过量的效果,还是很漂亮的溶液的嘛,再多加点甲基橙看看,嗯,更漂亮,哼,反正我完成实验了,随便玩,那一刻真是爽!
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
盐酸标准溶液的配制与标定
盐酸标准溶液的配制与标定一实验目的与要求1掌握用无水碳酸钠作基准物质标定盐酸溶液的原理和方法2正确判断甲基橙指示剂的滴定终点二实验…
-
盐酸标准溶液的配制与标定
一考核目的1学会直接法配制标准溶液的方法2学会盐酸溶液的标定方法3学会使用分析天平称取试样4练习容量瓶移液管滴定管的操作方法二实验…
-
盐酸和氢氧化钠标准溶液浓度的标定实验报告
盐酸和氢氧化钠标准溶液浓度的标定实验报告一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲酸氢钾的性质及应用3进一步…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
盐酸和氢氧化钠标准溶液浓度的标定实验报告
盐酸和氢氧化钠标准溶液浓度的标定实验报告一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲酸氢钾的性质及应用3进一步…
-
盐酸标准溶液的配制与标定
盐酸标准溶液的配制与标定一实验目的与要求1掌握用无水碳酸钠作基准物质标定盐酸溶液的原理和方法2正确判断甲基橙指示剂的滴定终点二实验…