过氧化氢的催化分解
过氧化氢的催化分解
一、实验原理
过氧化氢水溶液在室温下,没有催化剂存在时,分解反应进行得很慢,但在含有催化剂I–的中性溶液中,其分解速率大大加快,反应式为:2H2O2 == 2H2O + O2(g)
反应机理为: H2O2 + I–→ H2O + IO– k1 (慢) (1)
H2O2 + IO–→ H2O + O2(g) + I– k2 (快) (2)
整个分解反应的速率由慢反应(1)决定,速率方程为:
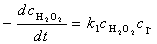
因反应(2)进行得很快且很完全,I–的浓度始终保持不变,故上式可写成:

式中, ,k为表观反应速率常数。将上式积分得
,k为表观反应速率常数。将上式积分得 
此式表明,反应速率与H2O2浓度的一次方成正比,故称为一级反应。将上式积分得:

式中c0、ct分别为反应物过氧化氢在起始时刻和t时刻的浓度。
反应半衰期为: 
设H2O2完全分解时放出O2的体积为V∞,反应t时放出O2的体积为V,
则c0∝V∞,c∝(V∞ – V),故 
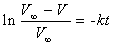

以ln(V∞ – V)对t作图应得一直线,从直线斜率(– k)即可求得H2O2分解反应的速率常数。故实验需测定反应不同时刻O2的体积V及H2O2完全分解时O2的体积V∞。V∞可用下法之一求出。
(a) 加热法 在测定若干个V数据后,将H2O2溶液加热至50~60℃约15min,可以认为H2O2已分解完全,待冷却至室温后,记下量气管的读数,即为V∞。
(b) 浓度标定法 用KMnO4标准溶液对H2O2原始浓度进行标定,O2近似按理想气体处理,则有

式中,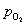 为O2的分压,是外界大气压与实验温度下水的饱和蒸气压之差。
为O2的分压,是外界大气压与实验温度下水的饱和蒸气压之差。
二、仪器和试剂
量气装置 1套(见图):恒温电磁搅拌器/量气管(含三通活塞和胶管)/水位瓶(以漏斗或量气管代替),秒表 1块,移液管(10mL,25mL)各 1支,容量瓶,锥形瓶,酸式滴定管;约H 2O2(3%),KI(0.2mol . dm –3),H2SO4(3mol . dm –3)。

三、实验步骤
1.按图所示安装好仪器装置,检查装置是否漏气(检查漏气时可观察量气管中液面是否随水位瓶下降而下降)。水位瓶中装入红色染料水,其水量要使水位瓶提起时,量气管和水位瓶中的水面能同时达到量气管的最高刻度处。
试漏。旋转活塞4使量气管与大气相通,举高水准瓶,使液体充满量气管。然后旋紧橡胶塞3,通过反复调整水准瓶和活塞到合适的位置,让反应体系和量气管相通而与大气隔绝的情况下,量气管内液面的位置在刻度1.00附近。读取量气管液面对应的读数。然后把水准瓶放在较低的位置,若量气管中的液面仅在初始有下降,而在随后2 min内保持不变,表示系统不漏气;否则应找出系统漏气的原因,并设法排除之。
注意:读取量气管读数时务必使水准瓶内液面和量气管内液面处于同一水平。
提示:系统漏气多发生在茄形瓶磨口塞处,可涂抹凡士林或真空脂。
3.用移液管(或滴定管)移取25 mL浓度约为3 %的H2O2溶液放入锥形瓶中,另外移入25 mL蒸馏水,加入磁搅拌子,用吸量管移取5mL 0.2 mol . dm –3 KI放入到小塑料盖内,再用镊子将其小心放入到盛有H2O2溶液的茄形瓶中,让盖子漂浮在液面上,不能让H2O2接触到K。
3.用手摇动茄形瓶,使塑料盖中的KI(s)与H2O2充分混合,记录反应起始时间,同时开启电磁搅拌开关,调节搅拌速度至中档。反应过程中不断调节水位瓶高低,保持水位瓶与量气管中水平面一致。量气管读数与零时刻读数之差即为等压下H2O2分解所放出O2的体积。量气管内O2体积以等时间间隔读取一次,若温度高,反应速率快,读取时间间隔宜以0.5 min;若温度低,反应慢,宜以1 min为准。最后都要测至量气管中O2的体积增加到50 mL为止。
4.改变KI或H2O2的浓度(也可改变反应温度),重复上述步骤,测定H2O2分解速率。
表1 浓度对反应速率的影响 室温_________

注:由于含有强电解质KI的水溶液的离子强度对反应速率的影响,若用不同的cKI作实验时,应外加第三组分(如KCl)以调节溶液的离子强度,使它们相同。
5.过氧化氢的准确浓度的标定。
(1)移取实验用约1mol . dm –3 H2O2 10 mL放入250 mL容量瓶中,用水稀释至刻度并摇匀。(2)移取25 mL稀释后的H2O2溶液放入锥形瓶中,加3 mol . dm –3 H2SO4 5 mL,用0.02mol . dm –3 KMnO4标准溶液滴定至淡红色为止,读取消耗KMnO4标准溶液的体积。重复三次,取平均值。
反应式为:5 H2O2 + 2 MnO4– + 6 H+ == 2 Mn2+ + 5 O2 + 8 H2O
根据滴定所用去的KMnO4标准溶液的体积即可求得H2O2的原始浓度,继而可求得V∞。
四、数据记录和处理
1.记录反应不同时刻t放出氧气的体积Vt,用浓度标定法求得V∞。
数据处理示例
T= K;气压 pa ;c (H2O2)=3%;c (KI) =0.2mol·L-1;V∞ = mL

2.以ln(V∞ – V)对t作图,从直线斜率(– k)求得H2O2分解反应的速率常数k。
3.动力学方程式的建立有微分法和积分法两种方法。
积分法:如本实验所示, ,若ln(V∞ – V)对t作图为直线即证明这是一级反应,由斜率求得k。
,若ln(V∞ – V)对t作图为直线即证明这是一级反应,由斜率求得k。
微分法:r= -dc/dt = kcα,这里r为反应速率,c为反应物H2O2的浓度,t为时间,α为反应级数。由此,lnr= lnk +αln c,以lnr 对lnc作图为直线,斜率为反应级数α,截距为ln k,即可求得反应速率系数k。
本实验令 ,即设催化剂KI反应级数为一级。如要验证反应对cKI确为一级反应,并求得该反应的速率系数 ,还必须以lnk 对lncI-作图。若得直线的斜率接近1,即证明此反应对cKI确为一级,并可求得k’值。
,即设催化剂KI反应级数为一级。如要验证反应对cKI确为一级反应,并求得该反应的速率系数 ,还必须以lnk 对lncI-作图。若得直线的斜率接近1,即证明此反应对cKI确为一级,并可求得k’值。
4.由不同浓度H2O2、KI所得的速率常数,讨论反应物、催化剂浓度(或温度)对反应速率的影响。
五、注意事项
1.除KI可作催化剂以外,其它的如Ag、MnO2、FeCl3、Fe2(SO4)3等也都是该分解反应的很好的催化剂。
2.系统不能漏气。
3.反应开始前,先开启搅拌器,再加入催化剂,注意顺序!加入催化剂要一次完成!
4.秒表读数必须连续,切不可中途停表。
5.搅拌速度要适中,每次实验的搅拌速度尽量保持一致;开始反应后,不能随意调节搅拌速度!
6.水位瓶移动不要太快,以免液面波动剧烈。
7.实验中V∞可用化学分析法测定。先在酸性溶液中用KMnO4标准溶液滴定求出过氧化氢的起始浓度,滴定反应为:
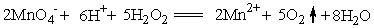
再求所用过氧化氢按式(C2-1)完全分解时产生O2的摩尔数,根据理想气体状态方程就可以计算出V∞,即
 (C2-8)
(C2-8)
式中:p大气为大气压, 为实验温度下水的饱和蒸汽压;T为实验温度;R为气体常数。
为实验温度下水的饱和蒸汽压;T为实验温度;R为气体常数。
严格地讲,用含水量气管测量气体体积时,都包含着水蒸气的分体积。若在某温度时,水蒸气已达饱和,则Vt应按下式计算:

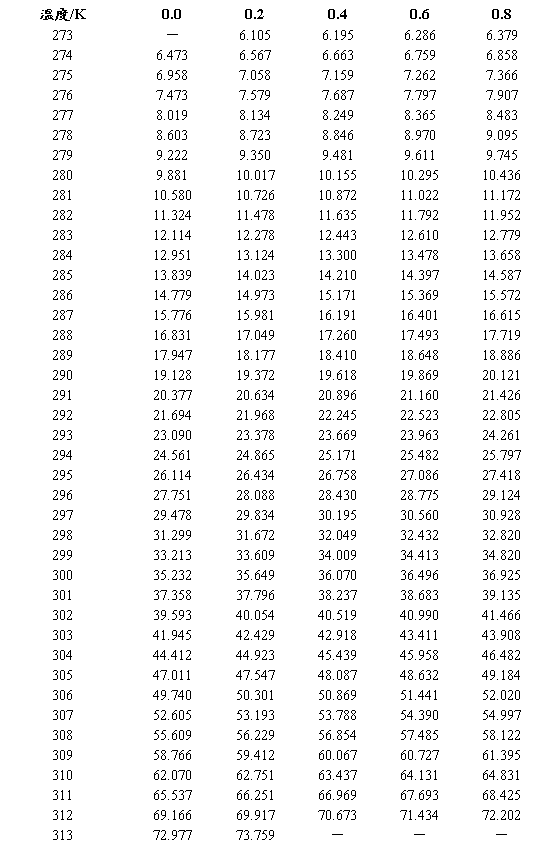
水的饱和蒸气压 (×102Pa,273.2~313.2K)
第二篇:过氧化氢催化分解制取氧气影响因素探讨
过氧化氢催化分解制取氧气影响因素探讨
1.催化剂种类及其状态、用量的影响
(1)用表面积为2.5cm2的瓷片(用规格统一的瓷质马赛克)4片分别蘸0.1mol/L的AgNO3、Fe2(SO4)3、CuSO4、KMnO4溶液在酒精灯焰上灼烧,干后待冷又蘸再灼烧,连续5次后可见到瓷片上分别留下一层银色、红棕色、灰黑、棕黑色物质。这实际上是以瓷片为载体在表面上生成一层作催化剂的物质(Ag、Fe2O3、CuO、MnO2),待用。
(2)把上述催化剂及2.5cm2的铜片(磨亮)共5种同时分别放入5mL3%H2O2溶液中,结果为:

可见,对H2O2催化分解最快的是MnO2,但它能与H2O2反应,随着MnO2的消耗催化效率逐渐下降;其次是Ag,虽然Ag也能与H2O2反应,但生成的Ag2O也是极好的催化剂,且不易脱落,催化分解彻底;其余几种催化效果、效率都不理想。
为进一步研究MnO2的催化情况,我做了如下实验:
①MnO2催化的制作。
a.取0.05g MnO2粉末。
b.把5gKMnO4分布于试管内壁加热一段时间后把渣倒出,试管内壁上留下一层稳固的棕黑色物质(MnO2),或直接取用KMnO4制取氧气实验留下的试管,用水洗去浮渣后可用。
c.取附有MnO2的灼烧瓷片(制法如上所述)。
d.用一片有机玻璃浸于0.1%KMnO4溶液中数天,待表面形成一层牢固的棕黑色层后取出可用。
②把这4种MnO2催化剂连载体分别放入5m15%H2O2溶液中,情况如下:

实验结果说明MnO2对过氧化氢的分解有极好的催化作用,但催化剂的制作途径不同,其催化的效率也不同,这主要是接触面大小不同所造成的。对MnO2来说以粉末状态的催化效率最高。
催化剂的用量对反应有否影响呢?为了探索这个问题,我做了这样一组实验:每次均用10mL30%H2O2溶液配制成10%溶液32mL,采用不同量的MnO2粉末作催化剂,测定各次收集500ml氧气的时间,结果如下:

结果表明:同一种催化剂的不同用量在一定范围内对反应速度是有影响的。
2.溶液浓度、操作情况的影响
为探讨不同浓度H2O2溶液在相同条件下催化分解的时间及反应情况,本人做了如下实验,每次均用5.0mL30%H2O2溶液(配制成不同浓度溶液)及0.20g MnO2粉末,在室温(20℃)下测定在试管中的反应时间,以导管在水中自冒泡至不再冒泡的时间为准,测定结果如下表:

把结果做成图象如下图所示。可见在相同条件下,溶液的浓度和操作情况对反应速度影响较大。后者则是在反应过程中振动反应器,由于振动时促使固液体充分混合,增大了接触面,从而使反应速度大大提高。如果收集气体l—2L并以1—2min为适度(在这样的时间段内人们可从容地操作),则从图象分析可知,当装置不动时可选取8.4%—11.4%的溶液,当装置可振动时可选取3.2%—5.8%的溶液。这并非绝对不变的,若出于一些反应的需要可视实际情况选用相应浓度的溶液,通常选用5%—10%溶液即可,在实际过程中用是否需要振荡及振荡次数、幅度大小来调节反应速度,使之符合人们的需要,这样做既简便又见效。

操作对反应的影响还包括:滴液速度(有些装置通过分液漏斗把H2O2溶液滴进盛有催化剂的反应器中),显然,滴液速度大小制约着H2O2参加反应的量,因而控制着反应速度;还有反应前有否对MnO2粉末作润湿处理,由于MnO2粉末润湿需要一定的时间,当它还没有润湿透彻就随反应的气流鼓起时会形成过多的泡沫,这会对实验带来麻烦,所以要加入少量水作润湿处理,以防产生过多的泡沫。
综上所述,常温常压下对H2O2催化分解的影响主要有三大因素:催化剂(包括种类、状态、用量三方面)溶液浓度和溶液与催化剂的接触面。因此在制取氧气过程中可以通过调节这些因素来控制反应速度。
(珠海市二中,广东珠海519000) 陈少康
-
过氧化氢的催化分解实验报告
过氧化氢的催化分解一实验目的1用静态法测定H2O2分解反应的速度常数和半衰期2熟悉一级反应特点了解反应物浓度温度催化剂等因素对一级…
-
过氧化氢的催化分解实验
过氧化氢的催化分解一实验目的1熟悉一级反应特点了解反应浓度温度和催化剂等因素对一级反应速度的影响2用静态法测H2O2分解反应的反应…
-
过氧化氢催化剂的研究 实验报告
过氧化氢催化剂的研究摘要过氧化氢是目前实验室制取氧气安全廉价的试剂由于过氧键的特殊性质有各种各样的催化剂可供选择本文就过氧化氢催化…
-
实验14 过氧化氢催化分解反应速率常数的测定
河北科技大学教案用纸第次课4学时第1页河北科技大学教案用纸实验14过氧化氢催化分解反应速率常数的测定一实验目的1测定过氧化氢催化分…
-
过氧化氢的催化分解
过氧化氢分解氧气成员罗玉洁何瑾徐丽胡艳骆磊申林一实验目的1掌握实验室用双氧水制备氧气的原理装置和操作2了解影响双氧水制备氧气反应速…
-
过氧化氢的催化分解实验报告
过氧化氢的催化分解一实验目的1用静态法测定H2O2分解反应的速度常数和半衰期2熟悉一级反应特点了解反应物浓度温度催化剂等因素对一级…
-
实验14 过氧化氢催化分解反应速率常数的测定
河北科技大学教案用纸第次课4学时第1页河北科技大学教案用纸实验14过氧化氢催化分解反应速率常数的测定一实验目的1测定过氧化氢催化分…
-
过氧化氢催化剂的研究 实验报告
过氧化氢催化剂的研究摘要过氧化氢是目前实验室制取氧气安全廉价的试剂由于过氧键的特殊性质有各种各样的催化剂可供选择本文就过氧化氢催化…
-
过氧化氢催化分解反应速率常数的测定
过氧化氢催化分解反应速率常数的测定标签化学实验报告过氧化氢反应速率常数教育分类药学资料一实验目的1了解过氧化氢催化分解反应速率常数…
-
探究不同催化剂对过氧化氢分解反应速率的影响 教案
课题探究不同催化剂对过氧化氢分解反应速率的影响一教材依据教材版本苏教版普通高中课程标准实验教科书实验化学选修课题名称42催化剂对过…
-
实验报告探究不同条件下过氧化氢的分解
实验比较过氧化氢在不同条件下的分解目的要求通过比较过氧化氢在不同条件下分解的快慢了解过氧化氢酶的作用和意义实验材料新鲜的质量分数为…