中考化学经典实验例析----过氧化氢的分解
中考经典实验例析------过氧化氢分解

VCM仿真实验——过氧化氢分解
过氧化氢制取氧气被称为“绿色制取氧气”的方法,在近年的中考中反复出现,仔细研究历年真题,探究考试的重点和方向,把握2010的中考出题方向。下面对过氧化氢的分解进行例析。
例1、(2008山东)如图所示,老师在演示用过氧化氢和二氧化锰制取氧气的实验中,收集完氧气后,反应还在继续进行。小明同学认为,这个装置的缺点是不能控制反应随时发生、随时停止,造成了药品的浪费。为了解决小明提出的问题,请你对原实验装置加以改进,或设计新的简易实验装置,以便有效地控制过氧化氢的分解反应。

友情提示:你可从下列用品中选取,也可自行选用其它仪器。

请你至少写出两种方案:
方案一: ;
方案二: .
答案:(1)将长颈漏斗改为分液漏斗
(2)将长颈漏斗改为注射器
(3)将长颈漏斗改用胶头滴管
(4)选用盛装二氧化锰的小布袋,将连在小袋子上的铁丝穿过橡皮塞并上下抽动。
(5)仿照启普发生器原理的简易实验装置等。
解析:要想控制反应则要控制双氧水与二氧化锰的接触。
例2、(08沈阳)在20##年沈阳市化学实验操作考查中,我们认真完成了用双氧水和二氧化锰制取氧气的实验,请据此实验回答下列问题。

(1)要检查A装置的气密性是否良好,通常是把导管口插入水中,然后双手紧握锥形瓶外壁,观察导管口是否有气泡产生。请你回答这种做法的依据是什么?(用微粒的观点解释) 。
(2)A装置内发生反应的化学方程式为 ,二氧化锰在该反应中做 剂。实验后回收二氧化锰的最佳方案是 。
(3)在实验过程中,某同学由于动作太慢,氧气还没有收集满,锥形瓶内的反应就已经停止(如图所示)。若想集满这瓶氧气,在不拆卸装置的前提下,请你帮他想出两种方法。
①
②
答案:(1)手握锥形瓶,使瓶内气体受热,微粒运动速率增大,间隔变大,气体体积膨胀,能从导管逸出
(2) 2H2O2 2H2O+O2↑ 催化 过滤
2H2O+O2↑ 催化 过滤
(3)①再加入适量的双氧水使反应继续进行
②从分液漏斗向锥形瓶内加水,将锥形瓶内的氧气压入集气瓶中
例3、(2008黄冈)根据下列实验装置图,回答问题:

写出标有序号的仪器的名称① 、② 。
用A、C组合,可以制取一种气体,其反应的化学方程式是 ;还可以制取 气体(填化学式),可用 或 装置收集(填符号)。
答案:(1)① 试管 ② 酒精灯
(2)2H2O2 2H2O+O2↑(或 Zn +H 2SO4 = ZnSO4 + H2↑);
2H2O+O2↑(或 Zn +H 2SO4 = ZnSO4 + H2↑);
H2(或O2 ); C,E (或C,D)
例4、(20##年武汉市中考)实验室有如图所示的仪器装置。某同学准备利用这些仪器装置及相关试剂制取氧气。下列有关说法正确的是( )

A.用高锰酸钾制氧气时需要二氧化锰作催化剂
B.用过氧化氢溶液制取氧气时可用Ⅱ作发生装置
C.可选用Ⅳ收集氧气
D.用Ⅴ收集氧气时,应从导管a通入氧气
答案:B
解析:用高锰酸钾制取氧气时无需催化剂;氧气的密度大于空气,不能用向下排空气法收集;用Ⅴ收集氧气,相当于排水法收集,由于水的密度大于氧气密度,故应从b端通入氧气,从a端排出水。显然A、C、D是错误的。
例5、(20##年南平市中考)结合以下实验室制取气体的常用装置回答问题:

(1)写出标号仪器的名称:① ;② 。
(2)实验室用过氧化氢溶液与二氧化锰固体混合制取氧气时,应选用发生装置是 (填序号,下同),收集装置是 ,反应的化学方程式为 。
(3)能用C装置收集的气体,必须具备的性质是 。
答案:(1)①试管 ②集气瓶
(2)B D(或E) 2H2O2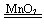 2H2O+O2↑
2H2O+O2↑
(3)密度比空气小且不与空气中的物质反应
例6、(2009·乐山)实验是学习化学的一个途径,请从下列仪器中选用适当的仪器用过氧化氢溶液和二氧化锰制取并收集氧气。
(1)仪器e的名称是 ;
(2)若用排空气法收集氧气,产生并收集气体应选用的仪器有(填代号) 。装入药品前必须进行的一步操作是 。
(3)写出此装置制备氧气的化学方程式 。
(4)检验氧气是否收集满的方法是 。

答案:(1)烧杯 (2)a、b、g 检查装置的气密性 (3)2H2O2 2H2O+O2↑
2H2O+O2↑
(4)用带火星的木条靠近瓶口,若木条复燃,则集满
例7、(20##年广州市中考)某同学设计了下表所示实验,探究金属铜对H2O2分解速率的影响。
回答下列问题:

(1)仪器①的名称是 ,仪器③的名称是 ;
(2)仪器②的实验目的是 ;
(3)根据上述实验,可得出的结论是 。
(4)如果用本实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是 。
A.称量实验前铜丝网的质量
B.将实验后的铜丝网干燥、称重
C.向仪器②中加入二氧化锰
D.将实验后的铜丝网插入AgNO3溶液中
答案:(1)试管 烧杯 (2)对比 (3)铜可以加快过氧化氢溶液分解的速率 (4)ABD
解析:本实验的目的是:探究金属铜对过氧化氢分解速率的影响,故需要对比放铜丝和不放铜丝时的现象,得出结论。如果要证明铜丝确实是过氧化氢分解的催化剂,则需要证明其在化学反应前后的质量和化学性质不变,上述实验方案中,A和B是证明质量不变,D是证明铜的化学性质不变,C则没有意义。
例8、(09烟台)小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。她设计并完成了下表所示的探究实验:

(1)请你帮小丽同学填写上表中未填完的空格。
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是 。
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是: ;
第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验。接下来的实验操作、现象和结论是: 。
答案:

(2)对比(或对照等);
(3)第一方面:比较MnO2在过氧化氢分解前后的质量。 第二方面:倾倒掉反应后的液体,向剩余的固体中重新加人过氧化氢溶液,有大量气泡产生,说明MnO2仍然能加快过氧化氢的分解速率(化学性质没变)
通过以上例题,大家可以发现,考察过氧化氢分解主要从仪器的选择、探究催化剂的影响、气体的收集等方面进行,考生要熟悉考试的重点知识,通过例题达到与一反三的效果。
第二篇:物化实验——过氧化氢分解
过氧化氢分解
一、目的
1.用测压法测定H2O2分解反应的速率常数和半衰期;
2.熟悉一级反应的特点,了解反应浓度、温度和催化剂等因素对一级反应速率的影响。
二、原理
1.凡是反应速率与反应物浓度的一次方成正比的反应为一级反应。H2O2的分解反应即属一级反应:

H2O2=1/2 O2+H2O
其反应速率方程可写为:

式中k为反应速率常数,cA,t为时间t时的反应物浓度,积分得

式中cA,0为反应开始时的初浓度。
以lncA,t 对时间t作图,可得一直线,其斜率为反应速率常数的负值-k,截距为ln cA,0。
当cA,t=0.5 cA,0 时,则t可用t1/2表示,即反应的半衰期。
t1/2= ln2/k
可见,在温度一定时,一级反应的半衰期与反应速率常数成正比,而与反应物的起始浓度无关。
 2. 化学反应速率取决于许多因素,例如反应物浓度和压力、温度、催化剂、溶剂、酸碱度、光化反应的光强度、多相反应的分散度以及搅拌强度、微波、超声波、磁场等都可能对反应产生影响。某些催化剂可以明显地加快反应速率,能加速分解H2O2的催化剂有Pt、Ag、MnO2、CuO(多相催化剂)、Cu2+、Fe3+、Mn2+、I- (均相催化剂)等。
2. 化学反应速率取决于许多因素,例如反应物浓度和压力、温度、催化剂、溶剂、酸碱度、光化反应的光强度、多相反应的分散度以及搅拌强度、微波、超声波、磁场等都可能对反应产生影响。某些催化剂可以明显地加快反应速率,能加速分解H2O2的催化剂有Pt、Ag、MnO2、CuO(多相催化剂)、Cu2+、Fe3+、Mn2+、I- (均相催化剂)等。
3.动力学研究常通过间接测定与反应物或产物浓度呈一定数学关系的物理量随反应时间的变化来考察反应的速率和机理。本实验采用测压法进行研究[1],装置如图1。(本次实验测定室温下的速率,未配套外循环恒温水浴装置)。使H2O2分解反应在一个体积固定的体系内进行,反应过程放出的O2将使系统内压强增加,通过与反应瓶相连的微压差测定仪跟踪压强增值随时间的变化研究反应的进程。
若p∞表示H2O2全部分解时体系的最终压强增加值;pt表示表示经反应时间t后体系的压强增加值,由于恒温条件下有 ∝(cA,0- cA,t)∝pt,
∝(cA,0- cA,t)∝pt, ∝cA,0 ∝p∞,则速率方程的积分式亦可表示为:
∝cA,0 ∝p∞,则速率方程的积分式亦可表示为:

以ln[(p∞-pt)/Pa]对 作图,由直线的斜率也可求得速率常数k。
作图,由直线的斜率也可求得速率常数k。
p∞可以采用以下两种方法求取:
(1)外推法,以1/t 为横坐标对pt作图,将直线段外推至1/t =0(即t为∞ ),截距即为p∞。该法须使反应接近完全方可相对准确的推出截距。
(2)加热法,即在测定若干pt后,将反应瓶置于50-60℃下约15min,促进H2O2快速完全分解,再冷却回原反应温度,记下的压强即为p∞。
也可以不测p∞,而用Guggenheim法数据法处理。公式推导如下:

以ln[(pt+Δ-pt)/Pa]对 作图,由直线的斜率也可求得速率常数k。Δ应取半衰期的2~3倍,因此应用该法的前提是反应须进行到接近完全。为了便于数据处理,一般取相同间隔的整数时间读数。
作图,由直线的斜率也可求得速率常数k。Δ应取半衰期的2~3倍,因此应用该法的前提是反应须进行到接近完全。为了便于数据处理,一般取相同间隔的整数时间读数。
4.实验内容的设计
O2是一种价廉的、强氧化性的绿色氧化剂,在纸浆氧漂、有机污水的湿法催化氧化处理(WAO,Catalytic Wet Oxidation)等领域中的应用[2,3]日益引起人们的重视。但常温附近O2起氧化作用的速率太慢,制约了它的实际应用。从催化原理来说,能显著促进H2O2分解的催化剂同样能促进逆反应O2生成H2O2速率的提高,继而提高O2的氧化作用速率。本实验任选一个实验条件,测定Cu2+、Fe3+对H2O2分解的催化活性及溶液的酸碱性对分解的影响,作为其应用的前期探索。
三、仪器和试剂
1.仪器:微压差测定仪,磁力搅拌器,250 mL锥形瓶(配单孔橡皮塞),50 mL量筒,1 mL吸量管5根,吸耳球,铁架台,铁夹,计时器(自备)。
2.试剂:0.5 mol/L 的Cu(NO3)2、0.5 mol/L Fe(NO3)3、3% H2O2、0.1mol/L的NaOH 、0.1 mol/L HCl。
四、实验步骤
取50 mL蒸馏水于洁净的锥形瓶中,加入1mL的催化剂(二选一),放入洁净的搅拌磁子,开启搅拌。加入0.5 mL酸或碱或不加(三选一)混匀。
关闭磁力搅拌!移取1 mL3% H2O2溶液,注入装有催化剂的锥形瓶中,塞紧瓶塞。将微压差测定仪置零,开启磁力搅拌器同时开始计时。过氧化氢分解放出的氧气使系统压力增高。每隔1min记录一次微压差测定仪显示的系统压力增加值,直至反应接近完全为止。
五、数据处理
 1.将所测数据填入表1。使用Excel或Origin7.0软件处理和作图。以ln[(pt+Δ-pt)/Pa]对
1.将所测数据填入表1。使用Excel或Origin7.0软件处理和作图。以ln[(pt+Δ-pt)/Pa]对 作图,求得速率常数k及线性相关系数。
作图,求得速率常数k及线性相关系数。
2.结论:(1) t1/2= ,
(2) 比较同学间的实验结果, 的催化分解活性更强;
(3)比较同学间的实验结果,在 性介质中的稳定性更强;
(4)比较同学间不同温度下的实验结果,在 条件下,
T1= K时,k1= ,
T2= K时,k2= ,
 活化能为 。
活化能为 。
六、注意事项
1.实验过程必须保证反应体系的密闭性;
2.实验过程必须避免外界气温的波动引起压强误差;
3.反应前的一系列操作 — 注入H2O2、加塞、微压差测定仪置零、启动磁力搅拌器、按下秒表计时,要迅速而有条理。
4.思考题参见“蔗糖水解实验”
七、参考文献
 1.罗澄源等编.《物理化学实验》(第三版).高等教育出版社,1989:130-132.
1.罗澄源等编.《物理化学实验》(第三版).高等教育出版社,1989:130-132.
2.卢义程,赵捷夫,陈玲.高浓度乳化废水处理中铜系催化剂催化活性比较.上海环境科学,2002;21(4):199-201.
3.李启良, 陈建林.催化氧化法处理有机废水催化剂的选择应用. 污染防治技,2003;16(2):34-36.
4.王岚岚.氧电极催化剂的组成对H2O2分解活性的研究.安徽工程科技学院学报,2003;18(2):12-15.
5.周 勇,鲍正荣,黄会林.CuO超细粉体对H2O2催化分解的探讨.四川理工学院学报(自然科学版),2005;18(1):101-104.
-
过氧化氢的催化分解实验报告
过氧化氢的催化分解一实验目的1用静态法测定H2O2分解反应的速度常数和半衰期2熟悉一级反应特点了解反应物浓度温度催化剂等因素对一级…
-
过氧化氢的催化分解实验
过氧化氢的催化分解一实验目的1熟悉一级反应特点了解反应浓度温度和催化剂等因素对一级反应速度的影响2用静态法测H2O2分解反应的反应…
-
过氧化氢催化剂的研究 实验报告
过氧化氢催化剂的研究摘要过氧化氢是目前实验室制取氧气安全廉价的试剂由于过氧键的特殊性质有各种各样的催化剂可供选择本文就过氧化氢催化…
-
实验14 过氧化氢催化分解反应速率常数的测定
河北科技大学教案用纸第次课4学时第1页河北科技大学教案用纸实验14过氧化氢催化分解反应速率常数的测定一实验目的1测定过氧化氢催化分…
-
过氧化氢的催化分解
过氧化氢分解氧气成员罗玉洁何瑾徐丽胡艳骆磊申林一实验目的1掌握实验室用双氧水制备氧气的原理装置和操作2了解影响双氧水制备氧气反应速…
-
过氧化氢的催化分解实验报告
过氧化氢的催化分解一实验目的1用静态法测定H2O2分解反应的速度常数和半衰期2熟悉一级反应特点了解反应物浓度温度催化剂等因素对一级…
-
实验14 过氧化氢催化分解反应速率常数的测定
河北科技大学教案用纸第次课4学时第1页河北科技大学教案用纸实验14过氧化氢催化分解反应速率常数的测定一实验目的1测定过氧化氢催化分…
-
过氧化氢催化剂的研究 实验报告
过氧化氢催化剂的研究摘要过氧化氢是目前实验室制取氧气安全廉价的试剂由于过氧键的特殊性质有各种各样的催化剂可供选择本文就过氧化氢催化…
-
过氧化氢催化分解反应速率常数的测定
过氧化氢催化分解反应速率常数的测定标签化学实验报告过氧化氢反应速率常数教育分类药学资料一实验目的1了解过氧化氢催化分解反应速率常数…
-
探究不同催化剂对过氧化氢分解反应速率的影响 教案
课题探究不同催化剂对过氧化氢分解反应速率的影响一教材依据教材版本苏教版普通高中课程标准实验教科书实验化学选修课题名称42催化剂对过…
-
实验报告探究不同条件下过氧化氢的分解
实验比较过氧化氢在不同条件下的分解目的要求通过比较过氧化氢在不同条件下分解的快慢了解过氧化氢酶的作用和意义实验材料新鲜的质量分数为…