邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁
一、实验目的
Ø 学习确定实验条件的方法,掌握邻二氮菲分光光度法测定微量铁的方法原理。
Ø 掌721握型分光光度计的正确使用方法,并了解此仪的主器要构造。
二、实验原理
在pH=2~9的溶液中,Fe2+与邻二氮菲(phen)生成稳定的桔红色配合物Fe(phen)32+:
 (橘红色)
(橘红色)
此配合物的lgK稳=21.3,摩尔吸光系数ε510 = 1.1×104 L·mol-1·cm-1,而Fe3+能与邻二氮菲生成3∶1配合物,呈淡蓝色,lgK稳=14.1。所以在加入显色剂之前,应用盐酸羟胺(NH2OH·HCl)将Fe3+还原为Fe2+,其反应式如下:
2Fe3++2NH2OH·HCl→2Fe2++N2+H2O+4H++2Cl-
测定时控制溶液的酸度为pH≈5较为适宜。用邻二氮菲可测定试样中铁的总量。
三、仪器及物品
721型分光光度计,1 cm吸收池,10 mL 吸量管,50 mL 比色管(或容量瓶);
1.0×10-3 mol·L-1 铁标准溶液,100ug·mL-1铁标准溶液,0.15%邻二氮菲水溶液,10%盐酸羟胺溶液(新配),1 mol·L-1乙酸钠溶液,6 mol·L-1 HCl(工业盐酸试样)。
四、实验过程
1、绘制吸收曲线,选择测量波长:用吸量管吸取2.00 mL1.0×10-3mol.L-1铁标准溶液,注入50 mL比色管中,加入1.00 mL 10%盐酸羟胺溶液,摇匀,加入2.00 mL0.15%邻二氮菲溶液,5.0 mL NaAc溶液,以水稀释至刻度。在光度计上用1 cm比色皿,蒸馏水为参比溶液,在440-560 nm间,每隔10 nm测量一次吸光度,绘制吸收曲线,选择测量的适宜波长。结果如图1所示,选择的测量波长为510nm。
2、显色条件的选择:
① 显色时间及有色溶液的稳定性:50 mL比色管中加2.00 mL1.0×10-3mol.L-1铁标准溶液,1.00 mL 10%盐酸羟胺溶液,加入2.00 mL0.15%邻二氮菲溶液,5.0 mL NaAc溶液,摇匀,以水稀释至刻度。分别在3、6、9min时测定溶液的吸光度,绘制吸收曲线,选择显色时间。结果如图2所示,显色时间确定在3min。
② 显色剂的用量:在6支50 mL比色管中,加2.00 mL1.0×10-3mol.L-1铁标准溶液和 1.00 mL 10%盐酸羟胺溶液,摇匀。分别加入0.10、0.50、1.00、2.00、3.00、4.00mL 0.15%邻二氮菲溶液,以水稀释至刻度。测定6瓶溶液的吸光度,绘制吸光度—试剂用量曲线,确定最佳显色剂用量。结果如图3所示,显色剂用量确定为2.00mL。
③  溶液pH值的确定:在8支50 mL比色管中,加2.00 mL1.0×10-3mol.L-1铁标准溶液和 1.00 mL 10%盐酸羟胺溶液,摇匀,放置3min,在加入2.00 mL0.15%邻二氮菲溶液,摇匀,然后分别加入0.0、0.2、0.5、1.0、1.5、2.0、2.5、3.0mL的1 mol·L-1乙酸钠溶液。然后测定吸光度,绘制A—v乙酸钠溶液图,选择最佳的乙酸钠溶液的用量。结果如图4所示,所选乙酸钠溶液用量为1.5mL以上。
溶液pH值的确定:在8支50 mL比色管中,加2.00 mL1.0×10-3mol.L-1铁标准溶液和 1.00 mL 10%盐酸羟胺溶液,摇匀,放置3min,在加入2.00 mL0.15%邻二氮菲溶液,摇匀,然后分别加入0.0、0.2、0.5、1.0、1.5、2.0、2.5、3.0mL的1 mol·L-1乙酸钠溶液。然后测定吸光度,绘制A—v乙酸钠溶液图,选择最佳的乙酸钠溶液的用量。结果如图4所示,所选乙酸钠溶液用量为1.5mL以上。
3、工业盐酸中铁含量的测定:
(1)标准曲线的制作: 在5支50 mL比色管中,分别加入0.0、0.6、0.8、1.0、1.2、1.4mL 100 ug/mL铁标准溶液,再加入1.00 mL10%盐酸羟胺溶液,2.00 mL0.15%邻二氮菲溶液和5.0 mL NaAc溶液,以水稀释至刻度,摇匀。
 (2)试样测定: 准确吸取2.0 mL工业盐酸,按标准曲线的操作步骤,测定其吸光度,平行测定三次。
(2)试样测定: 准确吸取2.0 mL工业盐酸,按标准曲线的操作步骤,测定其吸光度,平行测定三次。
五、数据处理
1、未知试剂的吸光度记录如下表:
2、由标准曲线得到的参数公式为:
Abs=0.00887+0.18745(c)
由公式计算得铁含量记录如下表:
换算成工业盐酸中铁的含量记录如
下表:

结果的平均值为:32.82ug/mL,相对标准偏差为:0.7%
六、结果反思
1、配制溶液时,各试剂加入的顺序不能变动,否则配成的溶液不变色或浓度不准确。
2、因为要配置的溶液很多,所以各比色管要编号,防止弄错。
3、测定吸光度时,比色皿的外表面要擦干净。
4、所得的标准曲线线性较好,结果的相对标准偏差较小。绘制标准曲线时,所得的6组数据中,舍去了与第5组的吸光度相同的第6组的数据。
第二篇:邻二氮菲分光光度法测定水中微量铁
邻二氮菲分光光度法测定微量铁
一、 实验目的
1、学会吸收曲线及标准曲线的绘制,了解分光光度法的基本原理。
2、掌握用邻二氮菲分光光度法测定微量铁的方法原理。
3、学会721型分光光度计的正确使用,了解其工作原理。
4、学会数据处理的基本方法。
5、掌握比色皿的正确使用。
二、 实验原理
根据朗伯-比耳定律:A=εbc,当入射光波长λ及光程b一定时,在一定浓度范围内,有色物质的吸光度A与该物质的浓度c成正比。只要绘出以吸光度A为纵坐标,浓度c为横坐标的标准曲线,测出试液的吸光度,就可以由标准曲线查得对应的浓度值,即未知样的含量。同时,还可应用相关的回归分析软件,将数据输入计算机,得到相应的分析结果。
用分光光度法测定试样中的微量铁,可选用显色剂邻二氮菲(又称邻菲罗啉),邻二氮菲分光光度法是化工产品中测定微量铁的通用方法,在pH值为2-9的溶液中,邻二氮菲和二价铁离子结合生成红色配合物:
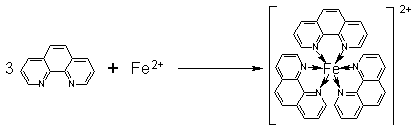
此配合物的lgK稳=21.3,摩尔吸光系数ε510 = 1.1×104 L·mol-1·cm-1,而Fe3+能与邻二氮菲生成3∶1配合物,呈淡蓝色,lgK稳=14.1。所以在加入显色剂之前,应用盐酸羟胺(NH2OH·HCl)将Fe3+还原为Fe2+,其反应式如下:
2Fe3+ + 2NH2OH·HCl → 2Fe2+ + N2 + H2O + 4H+ + 2Cl-
测定时酸度高,反应进行较慢;酸度太低,则离子易水解。本实验采用HAc-NaAc缓冲溶液控制溶液pH≈5.0,使显色反应进行完全。
为判断待测溶液中铁元素含量,需首先绘制标准曲线,根据标准曲线中不同浓度铁离子引起的吸光度的变化,对应实测样品引起的吸光度,计算样品中铁离子浓度。
本方法的选择性很高,相当于含铁量40倍的Sn2+、Al3+、Ca2+、Mg2+、Zn2+、SiO32-;20倍的Cr3+、Mn2+、VO3-、PO43-;5倍的Co2+、Ni2+、Cu2+-等离子不干扰测定。但Bi3+、Cd2+、Hg2+、Zn2+、Ag+等离子与邻二氮菲作用生成沉淀干扰测定。
三、 实验仪器与试剂:
721型分光光度计、酸度计、50ml比色管、吸量管(1mL、2mL、5mL、10 mL)、比色皿、洗耳球。
1.1×10-3mol·L-1铁标准溶液、100ug·ml-1铁标准溶液、盐酸、盐酸羟胺、醋酸钠、0.15%邻二氮菲水溶液。
四、 实验步骤
(一)准备工作
打开仪器电源开关,预热,调解仪器。
(二)测量工作(以通过空白溶液的透射光强度为I0,通过待测液的透射光
强度为I,由仪器给出透射比T,再由T值算出吸光度A值)
1、吸收曲线的绘制和测量波长的选择
用吸量管吸取2.00 mL1.0×10-3mol.L-1标准溶液,注入50 mL比色管中,加入1.00 mL 10%盐酸羟胺溶液,摇匀,加入2.00 mL0.15%邻二氮菲溶液,5.0 mL NaAc溶液,以水稀释至刻度。在光度计上用1 cm比色皿,采用试剂溶液为参比溶液,在440-560 nm间,每隔10 nm测量一次吸光度,以波长为横坐标,吸光度为纵坐标,绘制吸收曲线,选择测量的适宜波长。一般选用最大吸收波长λmax为测定波长。
2、显色剂条件的选择(显色剂用量)
在6支比色管中,各加入2.00mL 1.0×10-3mol·L-1铁标准溶液和1.00mL 10%盐酸羟胺溶液,摇匀。分别加入0.10,0.50,1.00,2.00 ,3.00及4.00mL 0.15%
邻二氮菲溶液,5.0 mL NaAc溶液,以水稀释至刻度,摇匀。在光度计上用1cm
比色皿,采用试剂溶液为参比溶液,测吸光度。以邻二氮菲体积为横坐标,吸光
度为纵坐标,绘制吸光度-试剂用量曲线,从而确定最佳显色剂用量。
3、溶液pH的确定
取8支50 mL比色管,各加入2mL 1.00×10-3mol/L-1的标准铁溶液和1 mL 10%的盐酸羟胺溶液,摇匀。放置2 min,再加入特定体积(2中探究出的最适量)0.15% L邻二氮菲,摇匀,分别加入0.0、0.20、0.50、1.00、1.50、2.00、3.0 0 mL 0.15%的NaAc溶液,用蒸馏水稀释至刻度,摇匀。
在光度计上,用1cm的比色皿,选择适宜(由“1”所决定的)波长,以蒸馏水为参比,分别测其吸光度。在坐标纸上以加入的NaAc溶液体积数为横坐标,相应的吸光度为纵坐标,绘制A—pH曲线,确定测定过程中pH范围。
4、显色时间及有色溶液的稳定性
用吸量管吸取 2mL 1.00×10-3mol/L-1的标准铁溶液于50 mL比色管中,加入1 mL 10%的盐酸羟胺溶液,摇匀(原则上每加入一种试剂后都要摇匀)。再加入2 mL邻二氮菲溶液,加入特定体积的(3中探究出的)NaAc溶液,以水稀释至刻度,摇匀。在光度计上,用1 mL的比色皿,以蒸馏水为参比溶液,放置,每两分钟测一次,在510nm之间测定吸光度。以时间为横坐标,吸光度为纵坐标,绘制A-t吸收曲线,选择测量的最适时间。
5、标准曲线的制作
在6个50 mL的容量瓶中,用10 mL吸量管分别加入0.00、0.20、0.40、0.60、0.80、1.00 mL 100μg·mL-1铁标准溶液,各加入1 mL 10%盐酸羟胺,摇匀(原则上每加入一种试剂都要摇匀)。再加入2 mL 0.15%的邻二氮菲溶液和特定体积 1mol·L-1NaAc溶液,以蒸馏水稀释至刻度,摇匀。放置一段时间(4中探究出的时间)。以试剂空白为参比,在510nm或所波长下,用1cm的比色皿,测定各溶液的吸光度。绘制标准曲线。
6、试液含铁量的测定
准确吸取适量试液(如水样或工业盐酸、石灰石样品制备液等)代替标准溶液,其他步骤同上,平行三次测定其吸光度。记录计算机显示的含铁量,计算试液中铁的含量(以mg·L-1表示)。
五、 数据处理
1、邻二氮菲-Fe2+吸收曲线的绘制
(1)数据纪录
不同波长吸光度

(2)作吸收曲线图

由图可知,最大吸收波长λmax= 510nm
2、显色剂用量的测定
(1)显色剂用量与吸光度的关系
邻二氮菲用量曲线:(λ=510 nm)

据上面数据,作得标准曲线图如下:

由图可知,显色剂最佳用量为1.00 mL 0.15%邻二氮菲溶液。
(2)溶液pH与吸光度的关系

据上面数据,作得标准曲线图如下:

由图可知,NaAc最佳用量为1.00 mL。
(3)显色时间及有色溶液的稳定性


结论:放置12分钟后铁离子与邻二氮菲基本完全结合。
2、工业盐酸中铁含量的测定
(1)标准曲线的制作
试液中铁含量与吸光度的关系


试液含铁量的测定

数据分析:本次测量的结果的偏离平均值较小,实验测量结果的可信度高。
六、实验注意事项
1、不能颠倒各种试剂的加入顺序。
2、读数据时要注意A和T所对应的数据。透射比与吸光度的关系为:A=log(I0/I)= log(1/T);测定条件指:测定波长和参比溶液的选择。
3、最佳波长选择好后不要再改变。
4、每次测定前要注意调满刻度。
七、思考题
1、邻二氮菲分光光度法测定微量铁时为何要加入盐酸羟胺溶液?
答:工业盐酸中含有Fe2+和Fe3+,其中Fe2+与邻二氮菲(phen)能生成稳定的桔红色配合物[Fe(phen)3]2+此配合物的lgK稳=21.3,摩尔吸光系数ε510 =1.1×104L·mol-1·cm-1,而Fe3+能与邻二氮菲生成3∶1配合物,呈淡蓝色,lgK稳=14.1。所以在加入显色剂之前,应用盐酸羟胺(NH2OH·HCl)将Fe3+还原为Fe2+,然后,进行铁的总量的测定 。
2、参比溶液的作用是什么?在本实验中可否用蒸馏水作参比?
答:参比溶液的作用是扣除背景干扰,不能用蒸馏水作参比,因为蒸馏水成分与试液成分相差太远,只有参比和试液成分尽可能相近,测量的误差才会越小。
3、邻二氮菲与铁的显色反应,其主要条件有哪些?
答:邻二氮菲与铁的显色反应,其主要条件有:酸度一般(pH=5~6)、温度、 邻二氮菲的用量,显色时间等。
八、实验总结
通过本实验,学习了确定实验条件的方法,再次熟悉了可见分光光度法的测量原理和实验操作步骤,掌握了邻二氮菲分光光度法测定微量铁的方法原理以及掌握721型分光光度计的使用方法。
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁20xx级医学检验3组吴茳铃20xx221885实验目的和要求1掌握紫外可见分光光度计的基本操作…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁一实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法3…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁实验目的和要求1掌握紫外可见分光光度计的基本操作2掌握邻二氮菲分光光度法测定微量铁的原理和方法3…
-
邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理2掌握TU19xx分光光度…
-
邻二氮菲分光光度法测定水中微量铁
邻二氮菲分光光度法测定微量铁一实验目的1学会吸收曲线及标准曲线的绘制了解分光光度法的基本原理2掌握用邻二氮菲分光光度法测定微量铁的…