滴定分析及自来水中碱度测定
实验报告
课程名称:水分析化学 实验项目名称:滴定分析及自来水中碱度测定
作实验日期:20##年11月16日 指导老师课程名称:水分析化学
学生姓名: 学号 成绩:
一、实验目的及原理
1.1 实验目的
1.1.1 滴定分析操作的实验目的
通过HCl和NOH溶液的配制和标定,掌握容量分析仪器的用法和滴定操作技术,并学会滴定终点的判断。
1.1.2 自来水中碱度测定的目的
通过实验掌握水中碱度测定的方法,进一步掌握滴定终点的判断。
1.2实验原理
1.2.1滴定分析操作原理
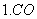 32-+H+= HCO3- HCO32-+H+=H2CO3
32-+H+= HCO3- HCO32-+H+=H2CO3
2.NaOH+HCl=NaCl+H2O
1.2.2自来水中碱度测定的原理
采用连续滴定法测定水中碱度。首先以酚酞为指示剂,用盐酸标准溶液滴定,使溶液由红色变无色(如无色则无需滴定),盐酸用量Pml,接着以甲基橙为指示剂,继续用上述盐酸滴定,使溶液由橙黄色变为红色,盐酸用量Mml. 当P>M,则有OH— 、CO32-;当P<M.则有CO32-、HCO3-;当P>0,M=0,只有OH-;当P=0,M>0只有HCO3-。根据盐酸用量及浓度求碱度。
二、实验方法
2.1主要器材和试剂
2.1.1主要器材
25ml酸式滴定管一个
25ml碱式滴定管一个
25ml移液管一个
2.1.2主要试剂
NaOH(AR) HCl(AR) NaCO3(AR) 甲基橙
蒸馏水 自来水
2.2主要实验步骤
2.2.1酸碱滴定
1.称取无水碳酸钠W(0.01~0.05g)
2.将上述碳酸钠置于锥形瓶中加入25ml蒸馏水使其充分溶解,加1~2滴酚酞,用待标定HCl滴定,记录所需盐酸用量VHCl(ml)。由CHCl=W/(VHCl×53)×1000
得盐酸的浓度。
3.用上述盐酸溶液25ml,标定NaOH溶液,记录所消耗NaOH的体积VNaOH (ml).由
CNaOH=CHClVHCl/VNaOH 得氢氧化钠的浓度。
2.2.2自来水中碱度的测定
1.取自来水25ml(2份)加入锥形瓶中,加入酚酞1~2滴。
2.用0.0532mol/L的盐酸滴定至无色,记录用量P,加入甲基橙1~2滴。
3.用上述HCl继续滴加至溶液变红色,记录用量M.得
HCO3-碱度(CaO计,mg/L)=C×(P+M)×28.04×1000/V
HCO3-碱度(CaCO3计,mg/L)=C×(P+M)×50.05×1000/V
三、结果分析
3.1酸碱滴定结果分析
如表1 所示
表1 酸碱滴定结果

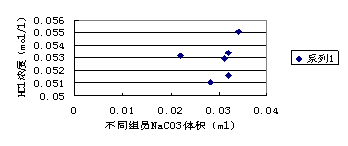
图1 盐酸滴定碳酸钠的结果分析
3.2自来水中碱度测定结果分析
表1 自来水碱度测定的结果

第二篇:实验一 酸碱滴定法测定自来水碱度(学生用)
实验一 酸碱滴定法测定自来水碱度
目的和要求
掌握容量分析操作技术,酸碱滴定原理、注意事项和测定结果的计算;熟悉碱度和酸度的概念、分类和表示方法,熟悉每一试剂的作用;了解水的碱度和酸度测定的意义,能根据测定结果判断碱度的组成。
方法原理
以酚酞为指示剂,用盐酸标准溶液滴定至水样红色刚好消失,记录此时盐酸标准溶液耗量为V1。再以甲基橙为指示剂,用盐酸标准溶液滴定至水样由黄色刚好变为橙红色,记录此时盐酸标准溶液耗量为V2。用V2计算水样的酚酞碱度,用V1+V2计算水样的总碱度。并可根据V1、V2消耗量判断碱度的组成。
仪器与试剂
①25ml酸式滴定管,250ml锥形瓶
②0.1mol/L盐酸标准溶液:量取9ml浓盐酸,用新煮沸冷却的蒸馏水稀释至1000ml。标定盐酸溶液的浓度:将优级纯无水碳酸钠于180℃烘烤2h后在干燥器中冷却,然后准确称取0.1~0.15g于250ml三角瓶中,加100ml新煮沸冷却的蒸馏水,即0.1g无水碳酸钠/100ml。3滴甲基橙指示剂,用配制好的盐酸溶液滴定至橙色。记录盐酸用量V0,用下式计算其浓度。
C=m*1000/V0*50
③5g/L酚酞指示剂:将0.5g酚酞溶于50ml 95%乙醇,加50ml水,滴加0.1mol/L NaOH至微红色。
④0.1mol/L NaOH:称取0.4g氢氧化钠定溶于100mL即可。
⑤0.5g/L甲基橙指示剂:将0.5g甲基橙溶于1000ml水中。
操作步骤
1、吸取100.00ml水样于250ml三角瓶中,加4滴酚酞指示剂,直至呈红色,立即用盐酸溶液滴定至红色刚好消失,记录盐酸用量V1。
2、再向瓶中加3滴甲基橙指示剂,用盐酸溶液滴定至橙色,盐酸用量记为V2。
3、计算
(1)总碱度(CaCO3,mg/L)=(V1+V2)*C*50*1000/100
(2) 酚酞碱度(CaCO3,mg/L)=V1*C*50*100/100
4、判断碱度的组成 如果V1>V2,碱度由碳酸盐和氢氧化物组成;如果V1<V2,碱度由碳酸盐和重碳酸盐组成;如果V1=V2,碱度由碳酸盐组成;V1=0,碱度只有重碳酸盐;V2=0,碱度只有氢氧化物。
注意事项
1、测定时应一式3份作平行测定,计算其算术平均值。每一份测定结果的绝对值不应大于该算术平均值的5%。结果以算术平均值修约至小数点后一位。
2、水样应采集在聚乙烯瓶或玻璃瓶内,样品应充满并盖紧。水样采集后应及时进行测定,否则应低温保存。
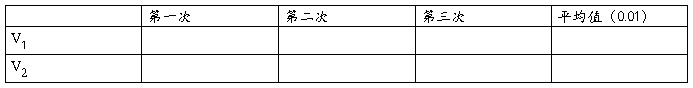
计算总碱度、酚酞碱度,并判断碱度的组成。
-
酒店前台工作总结范文
过去的20xx年是充实忙碌而又快乐的一年。在这新年到来之际,回首来时的路,在来到我们x酒店的差不多5个月里,作为一名刚入职的员工,…
-
大学学生会干事工作总结范文
随着时间的步伐,不知不觉中我已经走进了大学校园一年了,往事悠悠,对于那些蹉跎的岁月,我虽无法释怀,然而我们可以托起自己梦想,畅想未…
-
防砂式无间隙密封抽油泵研制成果总结
现在我国各油田使用的抽油泵柱塞和泵筒间多以间隙密封为主。为解决泵的防砂问题,多在柱塞上加工环形切槽,为方便检修泵时冲砂,安装可拆出…
-
总结及感想
湖北制药厂产品分析总结湖北广仁、武汉长江巨龙、湖北武当三个厂家,湖北广仁的产品在安徽华源最多,大概25个产品、据王总说一年可销26…
-
四年级数学第二学期教学工作总结
(20xx—20xx)林楚云一学期来,我自始至终以认真、严谨的治学态度,勤恳、坚持不懈的精神从事教学工作。作为数学教师,我能认真制…