1乙酸乙酯皂化反应试题
实验一 乙酸乙酯皂化反应
简答题
1. 在乙酸乙酯皂化反应中,为什么所配NaOH和乙酸乙酯必须是稀溶液?
2. 为何乙酸乙酯皂化反应实验要在恒温条件下进行,且氢氧化钠和乙酸乙酯溶液在混合前
还要预先恒温?
3. 电导池常数如何校正?
4. 为什么乙酸乙酯皂化反应可用电导结果测其不同时刻的浓度变化?测定时对反应液
的浓度有什么要求?为什么?
5. 在乙酸乙酯皂化反应中,若反应起始时间计时不准,对反应速度常数K有何影响?
为什么?
6. 乙酸乙脂皂化反应中,反应起始时间必须是绝对时间吗?为什么?
7. 对乙酸乙酯皂化反应,当a=b时,有x=K(G0 -Gt ),c=K(G0 -G∞)。若[NaOH]≠[酯]
时应怎样计算x和c值?
8. 某人使用电导率仪时,为快而保险起见老在最大量程处测定,这样做行吗?为什么?测量
水的电导率时,能否选用仪器上ms.cm-1量程来测量,为什么?
9. 电导率测量中,由于恒温槽性能不佳,温度逐渐升高,由此导致不同浓度时的Kc 值将发
生什么变化?
10. 在乙酸乙酯造化反应实验过程中,我们先校正电极常数,后测定水以及溶液的电导率,
页 第 1
请叙述原因、操作过程以及目的?
11. 在乙酸乙酯皀化实验中为什么由0.0100mol·dm-3的NaOH溶液测得的电导率可以认为是κ0?
12.在乙酸乙酯皀化实验中为什么由0.0100mol·dm-3的CH3COONa溶液测得的电导率可以认为是κ∞?
13.在乙酸乙酯皀化实验中如果NaOH和乙酸乙酯溶液为浓溶液时,能否用此法求k值,为什么?
14. 乙酸乙酯皂化反应实验中,乙酸乙酯溶液应在使用前现配,目的是什么?
15. 乙酸乙酯皂化反应实验中,反应体系的电导率随温度变化情况如何?
16.在乙酸乙酯皀化实验中铂电极的电极常数是如何确定的?
17、在乙酸乙酯皀化实验中电导率仪面板上温度补偿旋钮有何用途?怎样使用?
18. 乙酸乙酯皂化反应是通过利用测定反应体系在不同时刻的电导或者电导率来跟踪产物和反应物浓度的变化,试问,溶液的电导或者电导率和反应物或者产物的浓度之间是什么样的关系?
19.在乙酸乙酯皀化实验中,电导率仪上纯水电阻率旋有1-18MΩ-cm档位,本实验选择哪
个位置?
20.在乙酸乙酯皀化实验中,测定活化能Ea,选择?T= T2- T1在多大范围较好?为什么?
21.在乙酸乙酯皀化实验中,铂电极的电极常数与哪些因素有关?
页 第 2
22.在乙酸乙酯皀化实验中,电导率仪面板上有哪几个量程按钮?
23.在乙酸乙酯皀化实验中铂电极的电极常数有何用途?
24. 在乙酸乙酯皂化反应中,溶液的电导值怎样变化?为什么?
25. 乙酸乙酯皂化反应中,若反应起始时间计时不准,对反应速度常数K有何影响?为什么?
26. 在乙酸乙酯皂化反应中,如何由不同温度下反应的速率常数求该反应的活化能?
27. 反应分子数和与反应级数是两个完全不同的概念,反应级数只能通过实验来确定。试问如何从实验结果来验证乙酸乙酯皂化反应为二级反应?
28. 在乙酸乙酯皂化反应中,如果两种反应物氢氧化钠和乙酸乙酯溶液起始浓度不相等,试
问应怎样计算速率常数k的值?
29. 在乙酸乙酯皂化反应中,通过图解法求反应的速率常数,试问是利用哪些数据进行作
图?
30. 在乙酸乙酯皂化反应中,如果两种反应物浓度相同,反应的速率方程是什么?
页 第 3
第二篇:乙酸乙酯皂化反应实验报告
乙酸乙酯皂化反应速度常相数的测定
一、实验目的
1.通过电导法测定乙酸乙酯皂化反应速度常数。
2.求反应的活化能。
3.进一步理解二级反应的特点。
4.掌握电导仪的使用方法。
二、基本原理
乙酸乙酯的皂化反应是一个典型的二级反应:
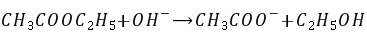 设在时间
设在时间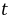 时生成浓度为
时生成浓度为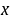 ,则该反应的动力学方程式为
,则该反应的动力学方程式为
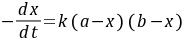 (8-1)
(8-1)
式中,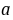 ,
,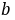 分别为乙酸乙酯和碱的起始浓度,k为反应速率常数,若a=b,则(8-1)式变为
分别为乙酸乙酯和碱的起始浓度,k为反应速率常数,若a=b,则(8-1)式变为
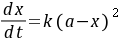 (8-2)
(8-2)
积分上式得: 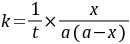 (8-3)
(8-3)
由实验测的不同t时的x值,则可根据式(8-3)计算出不同t时的k值。如果k值为常数,就可证明反应是二级的。通常是作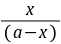 对t图,如果所的是直线,也可证明反应是二级反应,并可从直线的斜率求出k值。
对t图,如果所的是直线,也可证明反应是二级反应,并可从直线的斜率求出k值。
不同时间下生成物的浓度可用化学分析法测定,也可用物理化学分析法测定。本实验用电导法测定x值,测定的根据是:
(1)溶液中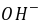 离子的电导率比离子(即
离子的电导率比离子(即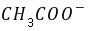 )的电导率要大很多。因此,随着反应的进行,
)的电导率要大很多。因此,随着反应的进行,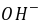 离子的浓度不断降低,溶液的电导率就随着下降。
离子的浓度不断降低,溶液的电导率就随着下降。
(2)在稀溶液中,每种强电解质的电导率与其浓度成正比,而且溶液的总电导率就等于组成溶液的电解质的电导率之和。
依据上述两点,对乙酸乙酯皂化反应来说,反映物和生成物只有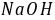 和
和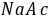 是强电解质,乙酸乙酯和乙醇不具有明显的导电性,它们的浓度变化不至于影响电导率的数值。如果是在稀溶液下进行反应,则
是强电解质,乙酸乙酯和乙醇不具有明显的导电性,它们的浓度变化不至于影响电导率的数值。如果是在稀溶液下进行反应,则
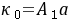
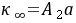
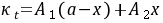 式中:
式中: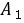 ,
,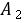 是与温度、溶剂、电解质
是与温度、溶剂、电解质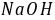 和
和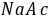 的性质有关的比例常数;
的性质有关的比例常数;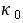 ,
,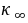 分别为反应开始和终了是溶液的总电导率;
分别为反应开始和终了是溶液的总电导率;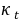 为时间t时溶液的总电导率。由此三式可以得到:
为时间t时溶液的总电导率。由此三式可以得到:
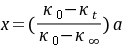 (8-4)
(8-4)
若乙酸乙酯与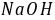 的起始浓度相等,将(8-4)式代入(8-3)式得:
的起始浓度相等,将(8-4)式代入(8-3)式得:
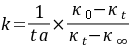 (8-5)
(8-5)
由上式变换为:
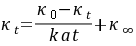 (8-6)
(8-6)
作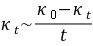 图,由直线的斜率可求k值,即
图,由直线的斜率可求k值,即
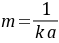 ,
, 由(8-3)式可知,本反应的半衰期为:
由(8-3)式可知,本反应的半衰期为:
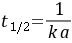 (8-7)
(8-7)
可见,两反应物起始浓度相同的二级反应,其半衰期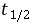 与起始浓度成反比,由(8-7)式可知,此处
与起始浓度成反比,由(8-7)式可知,此处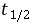 亦即作图所得直线之斜率。
亦即作图所得直线之斜率。
若由实验求得两个不同温度下的速度常数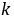 ,则可利用公式(8-8)计算出反应的活化能
,则可利用公式(8-8)计算出反应的活化能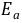 。
。
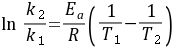 (8-8)
(8-8)
三、仪器和试剂

四、操作步骤
1.准确配制0.02 的
的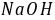 溶液和
溶液和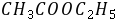 溶液。调节恒温槽温度至25℃,调试好电导仪。将电导池(如图8-1)及0.02
溶液。调节恒温槽温度至25℃,调试好电导仪。将电导池(如图8-1)及0.02 的
的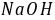 溶液和
溶液和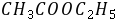 溶液浸入恒温槽中恒温待用。
溶液浸入恒温槽中恒温待用。
2.分别取适量0.01 的
的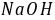 溶液和
溶液和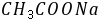 溶液注入干燥的比色管中,插入电极,溶液面必须浸没铂黑电极,置于恒温槽中恒温15分钟,待其恒温后测其电导,分别为
溶液注入干燥的比色管中,插入电极,溶液面必须浸没铂黑电极,置于恒温槽中恒温15分钟,待其恒温后测其电导,分别为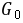 和
和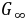 值,记下数据。
值,记下数据。
3.取20 0.02
0.02 的
的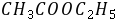 溶液和20
溶液和20 0.02
0.02 的
的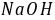 溶液,分别注入双叉管的两个叉管中(注意勿使二溶液混合),插入电极并置于恒温槽中恒温10分钟。然后摇动双叉管,使两种溶液均匀混合并导入装有电极一侧的叉管之中,同时开动停表,作为反应的起始时间。从计时开始,在第5、10、15、20、25、30、40、50、60分钟各测一次电导值。
溶液,分别注入双叉管的两个叉管中(注意勿使二溶液混合),插入电极并置于恒温槽中恒温10分钟。然后摇动双叉管,使两种溶液均匀混合并导入装有电极一侧的叉管之中,同时开动停表,作为反应的起始时间。从计时开始,在第5、10、15、20、25、30、40、50、60分钟各测一次电导值。
4.在30℃下按上述三步骤进行实验。
五、数据记录和处理
将测得数据记录于下表:
室温:18.6℃ 大气压:721.5 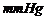
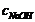 =0.01
=0.01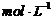
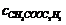 =0.02
=0.02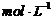
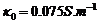

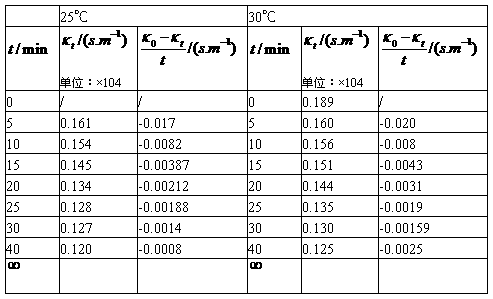
说明:其中温度为30℃时的实验数据为我小组所测,25℃时的数据是参考其他小组多得。
1.利用表中数据以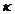 对
对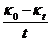 作图求两温度下的
作图求两温度下的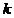 。
。
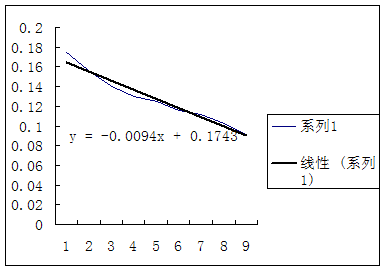
25℃时的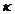 —
— 图
图
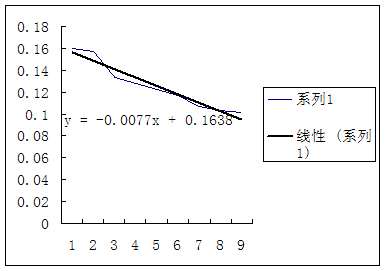
30℃时的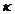 —
—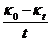 图
图
2.利用所作之图求两温度下的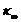 ,并与测量所得之
,并与测量所得之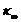 进行比较。
进行比较。
25℃:测量的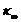 =0.1964
=0.1964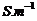 作图所得
作图所得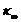 =0.1743
=0.1743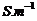
30℃:测量的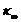 =0.1850
=0.1850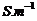 作图所得
作图所得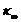 =0.1638
=0.1638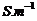
可以看出作图所求的两温度下的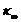 比测量值小一些,说明可能是测量时间太短,反应不完全所造成的,再就是可能数据处理存在着误差,使得结果偏小。
比测量值小一些,说明可能是测量时间太短,反应不完全所造成的,再就是可能数据处理存在着误差,使得结果偏小。
3.求此反应在25℃和35℃时的半衰期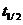 值。
值。
由图象法可以求出半衰期分别为:25℃: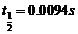 30℃:
30℃: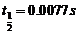
4.计算此反应的活化能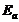 。
。
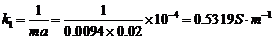
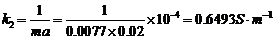
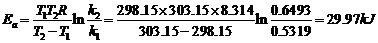
六、注意事项
1.注意每次测量之前都应该校正。
2.选择合适的量程,使得读取的数值在10~100之间。
3.进行实验时,溶液面必须浸没电极,实验完毕,一定要用蒸馏水把电极冲洗干净并放入去离子水中。
七、思考题
1.为什么以0.01 的
的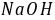 溶液和0.01
溶液和0.01 的
的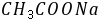 溶液测得的电导,就可以认为是
溶液测得的电导,就可以认为是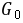 和
和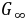 。
。
答:因为它们是强电解质,在稀溶液中,每种强电解质的电导率与其浓度成正比,而且溶液的总电导率就等于组成溶液的电解质的电导率之和。
2.为什么本实验要在恒温条件下进行?而且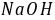 溶液和
溶液和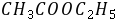 溶液在混合前还要预先恒温?
溶液在混合前还要预先恒温?
答:不同温度条件下所得速率常数不一样。保证温度的均一性,使得所测速率常数更加准确。
3.如何从实验结果来验证乙酸乙酯皂化反应为二级反应?
答: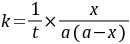 (8-3)
(8-3)
由实验测的不同t时的x值,则可根据式(8-3)计算出不同t时的k值。如果k值为常数,就可证明反应是二级的。通常是作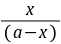 对t图,如果所的是直线,也可证明反应是二级反应,并可从直线的斜率求出k值。
对t图,如果所的是直线,也可证明反应是二级反应,并可从直线的斜率求出k值。
-
物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告乙酸乙酯皂化反应动力学1目的1了解二级反应的特点2用电导法测定乙酸乙酯皂化反应的速率常数3用不同温度下的反应速率常…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
乙酸乙酯皂化反应速率常数的测定的实验报告
实验七乙酸乙酯皂化反应速率常数的测定日期20xx0618来源作者字体大中小乙酸乙酯皂化反应速率常数的测定一目的及要求1测定皂化反应…
-
物理化学实验报告-乙酸乙酯皂化反应动力学研究
乙酸乙酯皂化反应动力学研究摘要本实验通过乙酸乙酯的皂化反应来研究化学反应动力学的规律实验通过电导法测定乙酸乙酯的皂化反应体系中的电…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应实验报告
乙酸乙酯皂化反应速度常相数的测定一、实验目的1.通过电导法测定乙酸乙酯皂化反应速度常数。2.求反应的活化能。3.进一步理解二级反应…
-
物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告乙酸乙酯皂化反应动力学1目的1了解二级反应的特点2用电导法测定乙酸乙酯皂化反应的速率常数3用不同温度下的反应速率常…
-
,乙酸乙酯皂化反应速率常数的测定
学号20xx14370135基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学师范班班级03组号实验人姓名xxx同…