实验三、质粒DNA的提取
实验三、质粒DNA的提取和电泳
一、实验目的
学习和掌握碱裂解法提取质粒;学习和掌握琼脂糖凝胶电泳检测质粒DNA的方法和技术。
二、实验原理
碱裂解法提取质粒是根据共价闭合环状质粒DNA与线性染色体DNA在拓扑学上的差异来分离它们。在pH值介于12.0~12.5这个狭窄的范围内,线性的DNA双螺旋结构解开而被变性,尽管在这样的条件下,共价闭环质粒DNA的氢键会被断裂,但两条互补链彼此相互缠绕,仍会紧密地结合在一起。当加入pH4.8的乙酸钾高盐缓冲液恢复pH 至中性时,共价闭合环状的质粒DNA的两条互补链仍保持在一起,因此复性迅速而准确,而线性的染色体DNA的两条互补链彼此已完全分开,复性就不会那木迅速而准确,它们缠绕形成网状结构,通过离心,染色体DNA与不稳定的大分子RNA,蛋白质-SDS复合物等一起沉淀下来而被除去。
DNA分子在琼脂糖凝胶中泳动时有电荷效应和分子筛效应。DNA分子在高于等电点的pH溶液中带负电荷在电场中向正极移动。由于糖-磷酸骨架在结构上的重复性质,相同数量的双链DNA几乎具有等量的净电荷,因此他们能以相同的速度向正极方向移动。在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应,即DNA分子本身的大小和构型。具有不同的相对分子质量的DNA片段泳动速度不一样,可进行分离。DNA分子的迁移速度与相对分子质量对数值成反比关系。凝胶电泳不仅可以分离不同相对分子质量的DNA, 也可以分离相对分子质量相同,但构型不同的DNA分子。如上次实验提取的pUC19质粒,有3种构型:超螺旋的共价闭合环状质粒DNA(covalently closed circular DNA,简称
CCCDNA);开环质粒DNA,即共价闭合环状质粒DNA 1条链断裂,(open circular DNA, 简称OCDNA);线状质粒DNA ,即共价闭合环状质粒DNA 2条链发生断裂,(linear DNA,简称L DNA)。这3种构型的质粒DNA分子在凝胶电泳中的迁移率不同。因此电泳后呈3条带,超螺旋质粒DNA泳动最快,其次为线状DNA和开环质粒DNA。
三、主要试剂
1. 溶液Ⅰ
50 mmol/L 葡萄糖
25 mmol/L 三羟甲基氨基甲烷(Tris)Tris.HCl(pH 8.0)
10 mmol/L 乙二胺四乙酸Na(EDTA)(pH 8.0)
2. 溶液 Ⅱ
0.2mol/L NaOH(临用前用10mol/L NaOH 母液稀释), 1% SDS,用前等体积混合(新鲜配制)
3. 溶液 Ⅲ
5 mol/L 乙酸钾 60 ml
冰乙酸 11.5 ml
水 28.5 ml
4. 70%乙醇(放-20℃冰箱中,用后即放回)
5. RNaseA
将RNA酶溶于10 mmol/L Tris.HCl(pH7.5)、15 mmol/L NaCl中,配成
10 mg/ml的浓度,于100℃加热15min,缓慢冷却至室温,保存于-20℃。
7. LB+Amp培养基:LB液体培养基内加入100ug/mL的氨苄青霉素。注意Amp遇高温
分解,待培养基温度低于60℃时加入。
8. 50 x TAE:
Tris 242g
冰乙酸 57.1ml
0.5 mol/L EDTA 100 ml
pH 8.0
9. 1%琼脂糖凝胶:
称0.3g琼脂糖,放入250 mL三角瓶内,加入30 mL 1×TAE电泳缓冲液,加热煮沸等其冷至60℃左右,倒入封好的电泳板上。
10. 10X Loading buffer
四、仪器耗材
恒温摇床、冷冻离心机、移液枪一套、制冰机、三角瓶、Eppendorf管、试管、培养皿、试剂瓶、超净工作台、电泳仪、电泳槽、凝胶成像仪、微波炉。
五、实验步骤
(一)细菌的培养
将含有pUC19质粒的大肠杆菌,在LB+Amp100培养基平皿上划线,获得单菌落。(37℃培养过夜)
(二) 质粒提取
1. 将2 mL含Amp(100ug/mL)的LB液体培养基加入试管中,接入上述的含pUC19质
粒的大肠杆菌(单菌落),37℃振荡培养过夜。
2. 取培养物倒入1.5 mL微量离心管中,4000 r/min 离心2 min。
3. 倒出培养液,使细胞沉淀尽可能干燥。
4. 将细菌沉淀悬浮于100 uL溶液Ⅰ中,充分振荡混匀,室温放置5-10 min。
5. 加200 uL溶液 Ⅱ(新鲜配制),盖紧管口,颠倒混匀内容物(勿剧烈震荡),将离心管
放冰上5 min 。
6. 加入150 uL溶液 Ⅲ(冰上预冷),盖紧管口,颠倒数次使混匀。冰上放置
5 min 。
7. 12000 r/min ,离心15 min ,将上清转至另一离心管中。
8. 向上清中加入等体积酚:氯仿:异戊醇(25:24:1),反复混匀,10000 r/min,离心10 min,
将上清转移到另一离心管中。
9. 向上清加入2倍体积乙醇,混匀后,室温放置15~20min。12000r/min离心
10 min。倒去上清液,把离心管倒扣在吸水纸上,吸干液体。
10. 用500 μL 70% 乙醇洗涤质粒DNA沉淀,振荡并离心,倒去上清液,真空抽干或空气
中干燥。
11. 加入适量(30 μL)的TE其中含有20 ug/ml的RNA酶,使DNA完全溶解,
-20℃保存。
(三)琼脂糖电泳检测
将样品5uL与上样缓冲液0.5 uL混合,用移液枪将该混合样品加入样品孔(记录点样顺序及点样量)。同时加入DNA marker。120v电泳大约20-30min。
六、作业
1、分析电泳图谱。
2、提取过程中,加入酚:氯仿:异戊醇的目的是什么?
3、如果一个DNA 酶解液在电泳后发现DNA 未被切动,你认为可能是什么原因?
第二篇:实验一 质粒DNA提取纯化、DNA电泳检测
实验一 质粒DNA提取纯化、DNA电泳检测
一、实验目的
1.掌握质粒DNA的制备的原理和方法
2.了解质粒琼脂糖凝胶电泳分离
二、实验原理
1.质粒DNA的制备方法
质粒(Plasmid)是独立存在于染色体外、能自主复制并能稳定遗传的一种环状双链DNA分子,分布于细菌、放线菌、真菌以及一些动植物细胞中,但在细菌细胞中含量最多。细菌质粒大小介于1~200Kb之间,是应用最多的质粒类群,在细菌细胞内它们利用宿主细胞的复制机构合成质粒自身的DNA。
质粒DNA的制备包括3个步骤:①培养细菌,使质粒DNA大量扩增;②收集和裂解细菌;③分离和纯化质粒DNA。主要方法包括:碱裂解法:0.2molNaOH+1%SDS;煮沸裂解法:沸水煮沸40秒;SDS裂解法:10%SDS,一般用于质粒大量提取。在实际操作中可以根据宿主菌株类型、质粒分子大小、碱基组成和结构等特点以及质粒DNA的用途进行选择。本实验选择碱裂解法提取质粒DNA。
2.碱裂解法
质粒DNA 具特定的形态结构,在特殊的环境条件下,如加热、极端pH值、有机溶剂、尿素、酰胺试剂等会导致质粒DNA变性,去除变性条件又可以使DNA复性。
碱裂解法根据共价闭合环状质粒DNA和线性染色体DNA在拓扑学上的差异来分离质粒DNA。SDS是一种阴离子表面活性剂,它既能裂解细菌细胞,又能使细菌蛋白质变性。SDS处理细菌细胞后会导致细菌细胞壁破裂,从而使质粒DNA及细菌基因组DNA从细胞中同时释放出来。细菌环状基因组DNA在操作过程中会断裂成线状DNA分子,在pH值介于12.0~12.5这个狭窄的范围内,线性的DNA双螺旋结构解开而被变性,尽管在这样的条件下,共价闭环质粒DNA的氢键会被断裂,但两条互补链彼此相互盘绕结合在一起。当加入pH4.8乙酸钾缓冲液时,pH恢复至中性,因为共价闭合环状的质粒DNA的两条互补链仍保持在一起,因此复性迅速而准确,而线性的染色体DNA的两条互补链彼此已完全分开,复性就不会那么迅速而准确,它们相互缠绕形成不溶性网状结构,而复性的质粒DNA恢复原来构型,保持可溶性状态。通过离心,就可去除染色体DNA和蛋白质-SDS复合物等物质,最后用酚氯仿抽提纯化上清液中的质粒DNA,乙醇或异丙醇沉淀就可得到纯的质粒DNA,之后可再用超离心、电泳、离子交换柱层析等方法进一步纯化质粒。
3.质粒琼脂糖凝胶电泳分离
琼脂糖凝胶电泳技术(agarose gel electrophoresis)是分离、鉴定和提纯DNA片断的有效方法。琼脂糖凝胶可分辩0.1~6.0kb的双链DNA片段。DNA分子在琼脂糖凝胶中泳动时有电荷效应和分子筛效应。DNA分子的高于等电点的pH溶液中带负电荷,在电场中向正极移动。由于糖-磷酸骨架在结构上的重复性质,相同数量的双链DNA几乎具有等量的静电荷,因此它们能以同样的速度向正极方向移动。在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应,即DNA分子本身的大小和构型。具有不同的相对分子质量的DNA片段泳动速度不一样,可进行分离。DNA分子的迁移速度与相对分子质量的对数值成反比关系。凝胶电泳不仅可分离不同相对分子质量的DNA,也可以分离相对分子质量相同,但构型不同的DNA分子,如pUC19质粒,有3种构型:超螺旋的共价闭合环状质粒DNA(covalently closed circular DNA, cccDNA);开环质粒DNA,即共价闭合环状质粒DNA 1条链断裂(open circular DNA , OCDNA)和线状质粒DNA,即共价闭合环状质粒DNA2条链发生断裂(linear DNA, LDNA)。这3种构型的质粒DNA分子在凝胶电泳中的迁移速度不同。因此电泳后呈3条带,超螺旋质粒DNA泳动最快,其次为线状DNA,最慢的为开环质粒DNA。
三、仪器及试剂
1.仪器及耗材:冷冻离心机、微量移液器、1.5ml EP管、枪头、凝胶槽、电泳仪等。
2.试剂及配制:
溶液Ⅰ(GET缓冲液):25 mmol/LTris-HCl(pH8.0),10 mmol/L EDTA,50 mmol/L葡萄糖,pH8.0
溶液II(变性液):200 mmol/L NaOH,1% SDS
配制:1 ml
10% SDS 50 μl
1N NaOH 200 μl
取以上溶液,用灭菌去离子水定容至1ml,充分混匀,现用现配。
溶液 III (醋酸钾液):3 mol/L 醋酸钾(KAc)缓冲液,pH 5.6。 5 mol/L 冰醋酸
配制:100 ml
醋酸钾 29.4g
冰醋酸 11.5 ml
加入60 ml去离子水后搅拌溶解。待醋酸钾溶解后,再加去离子水将溶液定容至100 ml。高温高压灭菌后,4℃保存。
其它试剂:TE(pH8.0)、饱和酚、酚/氯仿(25:24)、无水乙醇、70%乙醇、电泳缓冲液、6×上样缓冲液
四、实验步骤
1.接种细菌于LB液体培养基中,37℃培养过夜(E coli. Top10, pUC19质粒);
2.取细菌悬液1mL于1.5mLEP管中,4000 rpm/min,离心2min;
3.弃上清,加入100μl溶液Ⅰ;
4.加入200μl溶液II ,颠倒混匀,静置2min;
5.加入150μl溶液III,颠倒混匀,静置5min;
6.4℃,12000 rpm/min,离心10min;
7.取400μl上清移入另一EP管,加等体积饱和酚,振荡混匀,12000 rpm/min,离心10min;
8.取约300μl上层水相移入另一EP管,加等体积酚/氯仿,振荡混匀,12000 rpm/min,离心10min;
9.取200μl上层水相移入另一EP管,加2倍体积无水乙醇,混匀置-20℃1.5小时,沉淀DNA;
10.12000 rpm/min,离心10min,弃上清,加入1mL70%乙醇洗涤DNA沉淀,小心吸弃乙醇;
11.开盖放置5 min干燥DNA,加入15μl TE溶解DNA;
12.加入3μl 6×上样缓冲液,混匀,18μl分两次上样于1%琼脂糖凝胶电泳;
13.上样9μl DNA marker。
14.150V, 60min,紫外灯下观察结果。
五、结果与讨论
1.质粒电泳结果
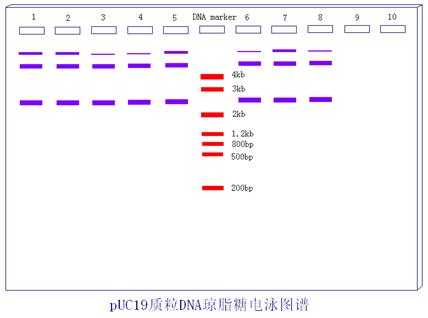
质粒DNA在含有溴化乙锭的琼脂糖凝胶电泳中,被染成橘黄色。如下图所示,质粒DNA可以观察到3条带,电泳速度最慢的条带显色最浅。质粒DNA有3种构型,即共价闭合环状质粒(cccDNA)、开环质粒 (OCDNA)和线状质粒DNA (LDNA)。在凝胶电泳中的迁移速度不同。因此电泳后呈3条带,超螺旋质粒DNA泳动最快,其次为线状DNA,最慢的为开环质粒DNA。本次实验的结果中的三条带,也可推测为:超螺旋质粒DNA、线状DNA和开环质粒DNA。
2.细菌基因组DNA与质粒DNA分离注意事项
 在加入细菌裂解液后,需要颠倒混匀,细菌环状基因组DNA在操作过程中会断裂成线状DNA分子。这时应当上下颠倒轻轻混匀,以避免产生小分子量的基因组DNA片断,最后污染提取的质粒DNA。
在加入细菌裂解液后,需要颠倒混匀,细菌环状基因组DNA在操作过程中会断裂成线状DNA分子。这时应当上下颠倒轻轻混匀,以避免产生小分子量的基因组DNA片断,最后污染提取的质粒DNA。
3.溴酚蓝指示剂
上样缓冲液中含有溴酚蓝(Bromophenol blue,别名四溴苯酚磺酞,最大吸收波长422nm),以0.25%溴酚蓝作为电泳指示剂。溴酚蓝结构式如右图,分子式C19H10Br4O5S,分子量669.96,氨基酸的平均分子量110 Da,每对核苷酸的平均分子量是659Da,电泳时溴酚蓝会跑在前面,在到达凝胶底部3/4位置时,即可停止电泳,进行结果观察。
-
质粒DNA的提取及其琼脂糖凝胶电泳实验报告及思考题
1实验目的1通过本次实验学习和掌握碱裂解法提取质粒2通过本次实验学习琼脂糖凝胶电泳检测DNA的方法和技术2实验材料及用品1实验仪器…
-
质粒DNA抽提实验报告
质粒DNA抽提实验报告一实验目的1掌握碱裂解法小量快速提取质粒DNA的方法提取的质粒DNA可直接用于酶切PCR扩增等2学习利用水平…
-
实验一、质粒DNA的提取及检测实验报告
实验一质粒DNA的提取及检测实验目的1掌握碱裂解法提取质粒的原理和步骤2掌握琼脂糖凝胶电泳检测DNA的方法和技术3学会PCR操作的…
-
质粒DNA的提取实验报告
质粒DNA的提取一实验方法碱裂解法抽提质粒DNA二实验原理基于质粒DNA与染色体DNA变性与复性的差异三实验步骤1质粒提取1100…
-
质粒的提取酶切 实验报告
实验一质粒的提取酶切实验目的掌握质粒小量快速提取法用琼脂糖凝胶电泳法鉴定其纯度实验原理质粒是一种染色体外的稳定遗传因子大小在120…
-
重组质粒实验报告
重组质粒的构建转化筛选和鉴定实验目的学习在实现DNA体外重组过程中正确选择合适的载体和限制性内切酶并能对限制性核酸内切酶对载体和目…
-
质粒DNA的提取及其琼脂糖凝胶电泳实验报告
一实验名称质粒DNA的提取与纯化DNA琼脂糖凝胶电泳二实验原理1质粒DNA的提取质粒是一类存在于几乎所有细菌等微生物中染色体之外细…
-
质粒DNA抽提实验报告
质粒DNA抽提实验报告一实验目的1掌握碱裂解法小量快速提取质粒DNA的方法提取的质粒DNA可直接用于酶切PCR扩增等2学习利用水平…
-
质粒DNA的提取及其琼脂糖凝胶电泳实验报告及思考题
1实验目的1通过本次实验学习和掌握碱裂解法提取质粒2通过本次实验学习琼脂糖凝胶电泳检测DNA的方法和技术2实验材料及用品1实验仪器…
-
质粒的提取酶切 实验报告
实验一质粒的提取酶切实验目的掌握质粒小量快速提取法用琼脂糖凝胶电泳法鉴定其纯度实验原理质粒是一种染色体外的稳定遗传因子大小在120…