电导率的测定及其应用
电导率的测定及其应用
摘 要:根据电导率与溶液浓度,电解质的解离度及解离常数的关系,我们可以根据已测定的电导率来进行计算。
关键词:电导率,摩尔电导率,解离度,解离平衡常数。
0.引言
导体有两类,一类为金属导体,电流的载体是电子,电子流动的反方向即电流方向。另一类导体为电解质,电流的载体为离子,在一定得电场推动下,正离子向负极,负离子向正极迁移,电流的方向与正离子迁移方向一致。
因为不同种类,不同浓度的电解质溶液的电导率各不相同,电导率值遇浓度密切相关。
因此测量溶液电导率将给我们电解质溶液的很多的信息。
本实验是电导率测定的一系列应用。共包含四个方面:一,测定电解质溶液的摩尔电导率,从而计算电离度和电离平衡常数;二,测定强电解质溶液的摩尔电导率,由外推法求其
无限稀释摩尔电导率;三,测定难溶物的电导率,进而求其溶解平衡常数;四,在本实验的基础上,练习生产生活实际,自己设计一个实验,我选择的是“电导率法检验葡萄酒的冷稳定性”。
通过本次试验,将加深我们对电导率部分相关概念知识的理解,同时能让我们掌握电导率仪的使用方法,以及外推法等常用数据处理方法。另外还能培养我们的动手操作能力,以及发散思维和创新能力。
1.材料与方法
实验一
实验一所需仪器药品:DDS-11A型电导率仪一台,恒温槽一套,100mL,200ML锥形瓶各两个,25mL移液管3支,0.1mol/L标准醋酸溶液
实验一的方法:
1. 用25mL移液管取50Ml0.1mol/L醋酸标准溶液放入恒温槽内的100mL锥形瓶中,恒温15min,测定溶液的电导率;
2. 用吸取醋酸的移液管从已测溶液中吸出25mL溶液弃去。用另一支移液管取25mL电导水注入已吸出溶液的100mL锥形瓶中,同法测定其电导率,如此稀释四次测定其电导率。
3. 倒去所测醋酸溶液,洗净锥形瓶,并用电导水清洗,浸泡电极数分钟,然后取50mL电导水测其电导。
实验完毕,关上电源,倒掉蒸馏瓶中的电导水,取出电极,拆卸装置。
实验二
实验二所需仪器药品:恒温槽一套;DDS-11A型电导率仪一台;25mL移液管两支;125mL锥形瓶2个;0.1mol/L标准KCL溶液。
实验二步骤:
1. 调整恒温槽温度在25.0摄氏度。
2. 在锥形瓶中,用25mL移液管加入50ml0.1mol/L标准KCL溶液,插入电极,然后置于恒温水浴中。等15—20min至温度恒定后,测其电导率k,至三次读数接近为止。
3. 用吸取KCL溶液的移液管从电导池中吸取25ml溶液弃去,用吸取的移液管25ml电导水注入电导池中,混合均匀,等温度恒定后测定其电导率k,如此稀释四次,分别测其电导率k..
实验三
把约2gBaSO4 放入250mL的三角锥瓶中,倒入约20mL电导水,加热至沸腾,静置片刻,倒去清液,重复上述操作三次,以出去可溶性杂质,然后倒入30mL电导水,加热至沸腾,静置片刻,趁热倒入一干净试管中,然后置于恒温槽中恒温15min后测量其电导率。
实验四
1.1试验材料
1.1.1葡萄酒样品
酒样l:冷冻前赤霞珠干红葡萄酒酒样;
酒样2:与酒样l同批赤霞珠干红葡萄酒在一4.5℃条件下保温7d后过滤酒样;
酒样3:贵人香干白葡萄酒成品酒样。
1.1.2试剂
酒石酸氢钾。
1.1.3检验器材
电导仪、磁力搅拌器、温度计、恒温水浴锅。
1.2方法
(1)取1 OOmL酒样,搅拌状态下,在6~24.5℃区间内每隔0.5℃测量其电导率并作“温度一电导率” 曲线。
(2)将上述酒样冷却到5℃ ,搅拌状态下加入约1g酒石酸氢钾粉末。搅拌状态下, 在6~24.5℃区间内每隔0.5℃测量其电导率,并在(1)步骤的同一坐标系中作“温度一电导率” 曲线。
同时对所有酒样做冷冻试验。
2 结果与讨论
实验一数据处理:
1. 计算各浓度的醋酸的电导率。醋酸的电导率甚小,其值等于所测溶液的电导率溶液的电导率减去同温度电导水的电导率。
2. 计算醋酸在各浓度下的摩尔电导率和电离度。已知25摄氏度时的无限稀释摩尔电导率为0.03907 k/10-4s﹒m-1.

2. 从各电离度计算电离平衡常数,并求其平均值。

电导水电导率

实验二数据处理
1. 计算各浓度溶液的电导率。
2. 以KCL溶液的摩尔电导率对浓度的开方作图,外推求极限稀释摩尔电导率。
3. 写出KCL溶液的摩尔电导率与浓度的关系式。


实验三数据处理:
BaSO4饱和溶液的电导率

根据公式解的 Ksp=0.0344
3 结 语
通过电导率的测定,进行了以上的四个试验,既有比较简单的,与书本联系紧密的实验,也有联系生产实践的试验。
实验表明:对电解质溶液而言,其电导率与电解质的浓度c有关。对于强电解质,溶液较稀时电导率近似与浓度成正比;随着浓度的增大,因离子间的相互作用,电导率的增加逐渐缓慢浓度很大时电导率经一极大值,然后逐渐下降。对于弱电解质溶液,起电导作用的只是解离了的那部分离子,故当浓度从小的到大时,虽然单位体积中的弱电解质的量增加了,但因解离度减小了,故离子的数量增加不多,故弱电解质的电导率很小。
随着计算机工程技术的发展,将来电导率仪必然会和计算机联系的更加紧密,本次的实验四就是一个尝试,所以未来电导率在检测等方面将会显现出更加重要的作用。
第二篇:电导的测定及其应用 (2)
 宁 波 工 程 学 院
宁 波 工 程 学 院
物理化学实验报告
专业班级 化工6班 姓名 何洋 序号 25号
同组姓名 罗淞,叶建伟 指导老师 胡爱珠 实验日期 2013.4.18
实验名称 实验五 电导的测定及其应用
一、实验目的
1. 测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率;
2. 用电导率测量醋酸在水溶液中的解离平衡常数;
3. 掌握恒温水槽及电导率仪的使用方法。
二、实验原理
1.电解质溶液的电导能力通常用电导G来表示,它的单位是西门子,用符号S表示,若将某电解质溶液放入两平行电极之间,设电极间距离为l ,电极面积为A,则电导为:
G=KA / l (2.5.1)
式 (2.5.1) 中,K为该电解质溶液的电导率,其物理意义:在两平行而相距1m,面积均为1 m2的两电极间,电解质溶液的电导称为该溶液的电导率,其单位以SI制表示为S/m;(l/A)为电导池常数,以Kcell表示,单位为m-1。
由于电极的l和A不易精确测量,因此在实验中是用一种已知电导率值的溶液先求出电导池常数Kcell, 然后把欲测溶液放入该电导池测出其电导值,再根据 (2.5.1) 式求出其电导率。
在讨论电解质溶液的导电能力时常用摩尔电导率(Λm)这个物理量。它是指把含有1mol电解质的溶液置于相距为1m的两平行板电极之间的电导。以Λm 表示,其单位以SI单位制表示为S·m2/mol-1。
摩尔电导率与电导率的关系:
Λm = K / C (2.5.2)
式(2.5.2)中,C为该溶液浓度,其单位以SI单位制表示为mol · m-3。
2. Λm 总是随着溶液的浓度的降低而增大的。对强电解质稀溶液而言,其变化规律可用科尔劳施经验公式表示:
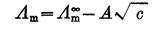 (2.5.3)
(2.5.3)
式(2.5.3)中, 是溶液在无限稀释时的极限摩尔电导率。对特定的电解质和溶剂来说,在一定温度下,A是一个常数。所以,将
是溶液在无限稀释时的极限摩尔电导率。对特定的电解质和溶剂来说,在一定温度下,A是一个常数。所以,将 对
对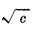 作图得到的直线外推至C=0处,可求得
作图得到的直线外推至C=0处,可求得 。
。
3. 对于弱电解质溶液来说,其 无法利用上式通过实验直接测定。但我们知道,在其无限稀释溶液中,弱电解质的a=1,每种离子对电解质的摩尔电导率都有一定的贡献,是独立移动的,不受其他离子的影响,对电解质MV+AV-来说,即:
无法利用上式通过实验直接测定。但我们知道,在其无限稀释溶液中,弱电解质的a=1,每种离子对电解质的摩尔电导率都有一定的贡献,是独立移动的,不受其他离子的影响,对电解质MV+AV-来说,即:
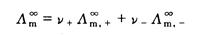 (2.5.4)
(2.5.4)
式(2.5.4)中, 、
、 分别表示正、负离子的无限稀释摩尔电导率。它与温度及离子的本性有关。
分别表示正、负离子的无限稀释摩尔电导率。它与温度及离子的本性有关。
在弱电解质的稀薄溶液中,离子的浓度很低,离子间的相互作用可以忽略,可以认为在它浓度C时的解离度a等于它的摩尔电导率 与其无限稀释摩尔电导率之比,即:
与其无限稀释摩尔电导率之比,即:
a= /
/ (2.5.5)
(2.5.5)
把(2.5.4)代入(2.5.1)式可得:
 (2.5.6)
(2.5.6)
以C Λm 对 1/Λm 作图,根据其斜率求得K 。
三、实验仪器、试剂
仪器:梅特勒326电导率仪1台;电导电极1只;量杯(50ml)2只;移液管(25ml)9只;洗瓶1只;洗耳球1只
试剂:10.00(mol/m3)KCl溶液; 100.0(mol/m3)HAc溶液;电导水
四、实验步骤
1、打开电导率仪开关,预热5min。
2、KCl溶液电导率测定:
⑴用移液管准确移取10.00(mol·m-3)KCl溶液25.00 ml于洁净、干燥的量杯中,测定其电导率3次,取平均值。
⑵再用移液管准确移取25.00 ml电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
⑶用移液管准确移出25.00 ml上述量杯中的溶液,弃去;再准确移入25.00 ml电导水,只于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
⑷重复⑶的步骤2次。
⑸倾去电导池中的KCl溶液,用电导水洗净量杯和电极,量杯放回烘箱,电极用滤纸吸干
3、HAc溶液和电导水的电导率测定:
⑴用移液管准确移入100.0(mol·m-3)HAc溶液25.00 ml,置于洁净、干燥的量杯中,测定其电导率3次,取平均值。
⑵再用移液管移入25.00 ml已恒温的电导水,置于量杯中,搅拌均匀后,测定其电导率3次,取平均值。
⑶用移液管准确移出25.00 ml上述量杯中的溶液,弃去;再移入25.00 ml电导水,搅拌均匀,测定其电导率3次,取平均值。
⑷再用移液管准确移入25.00 ml电导水,置于量杯中,搅拌均匀,测定其电导率3次,取平均值。
⑸倾去电导池中的HAc溶液,用电导水洗净量杯和电极;然后注入电导水,测定电导水的电导率3次,取平均值。
⑹倾去电导池中的电导水,量杯放回烘箱,电极用滤纸吸干,关闭电源。
五、数据记录与处理
1.数据记录:
大气压:101.58,KPa; 室温: 20.3℃; 实验温度: 20.3℃;
已知数据:25℃下10.00(mol·m-3)KCl溶液电导率 = 0.1413 S·m-1;25℃时无限稀的HAc水溶液的摩尔电导率 = 0.03907(S·m2·mol -1)
(1)测定KCl溶液的电导率

(2)测定HAc溶液的电导率
该条件下电导水的电导率 k(H2O)/ (S·m-1):6.02S·m-1

(2)HAc溶液的各组数据

以CΛm对1/Λm作图应该得到一直线,其直线的斜率为(Λ∞m2) KθCθ,如知道Λ∞m值,就可算出Kθ,并与上述结果进行比较。

得到直线的斜率为4.955×10-5,所以(Λ∞m)2 KθCθ=4.955×10-5,
又 Λ∞m=3.907×10-2(S·m2·mol-1),Cθ=1mol/L;
所以Kθ=4.955×10-5/((3.907×10-2)2×1×1000)=3.246×10-5
相对误差=|3.246×10-5-3.411×10-5|/3.246×10-5×100%=5.08%
六、结果与讨论
1.电解质溶液导电主要与电解质的性质,溶剂的性质,测量环境的温度有关,所以测电导是要恒温。而电导池常数是一个不随温度变化的物理量,因此可以直接在不同的温度下使用。
误差分析:1、移液过程中可能有液体滴落,导致浓度偏小,数据不真实。
2、测电导率之前没有充分搅匀液体,导致数据不准。
3、加水稀释溶液时也可能存在加的量的多少的问题,导致数据不准。
七、思考题
如果配制HAc溶液的水不纯,将对结果产生什么影响?偏小
会使HAc溶液的实际浓度偏大,测得的Kθ 偏小。
-
电导的测定及其应用实验报告
电导的测定及其应用一、实验目的1、测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率。2、用电导法测量醋酸在水溶液中的解离平衡常…
-
电导的测定及应用实验报告
实验名称一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电…
-
电导的测定及其应用实验报告
001520015000148YAxisTitle00146001440014200140XAxisTitle根据截距即为得154…
-
电导的测定及其应用实验报告wqf
宁波工程学院物理化学实验报告专业班级姓名序号同组姓名指导老师实验日期3月31号实验名称实验五电导的测定及其应用一实验目的1测量KC…
-
电导的测定及其应用实验报告
电导的测定及其应用一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒…
-
电导的测定及应用实验报告
实验名称一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电…
-
电导的测定及其应用实验报告wqf
宁波工程学院物理化学实验报告专业班级姓名序号同组姓名指导老师实验日期3月31号实验名称实验五电导的测定及其应用一实验目的1测量KC…
-
电导的测定及其应用实验报告
电导的测定及其应用一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒…
-
物化实验报告5-电导的测定及其应用
一实验目的1测量KCl水溶液的电导率求它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电导率仪的使…
-
电导的测定及其应用实验报告
电导的测定及其应用一、实验目的1、测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率。2、用电导法测量醋酸在水溶液中的解离平衡常…