硫酸铵肥料中含氮量的测定
硫酸铵肥料中含氮量的测定
实验三 硫酸铵肥料中含氮量的测定(甲醛法)(4学时)
一、实验目的
1.熟悉NaOH标准溶液的配制和标定方法;
2.了解铵盐含氮量的测定可选用哪些方法?铵盐等弱酸为什么要用甲醛处理?
3.掌握甲醛法测定铵态氮的原理和方法。
4.进一步训练滴定操作技术,从严考核滴定结果,其相对误差不大于±0.3% 。
二、实验原理
铵盐是常见的无机化肥,是强酸弱碱盐,可用酸碱滴定法测定其含量,但由于NH4+的酸性太弱(Ka=5.6×10-10),直接用NaOH标准溶液滴定有困难,生产和实验室中广泛采用甲醛法测定铵盐中的含氮量。
甲醛法是基于甲醛与一定量铵盐作用,生成相当量的酸(H+)和六次甲基四铵盐(Ka=7.1×10-6)反应如下:
4NH4+ + 6HCHO = (CH2)6N4H+ + 6H2O + 3H+

所生成的H+和六次甲基四胺盐,可以酚酞为指示剂,用NaOH标准溶液滴定。再按下式计算含量。
式中MN—氮原子的摩尔质量(14.01 g/mol)。
三、主要试剂
1. 0.1 mol/L NaOH溶液 2. 0.2%酚酞溶液
3. 0.2%甲基红指示剂 4. 甲醛溶液1:1
四、实验步骤:
1. NaOH的标定(同实验二)
2. 甲醛溶液的处理:甲醛中常含有微量甲酸是由甲醛受空气氧化所致,应除去,否则产生正误差。处理方法如下:取原装甲醛(1)(40%)的上层清液于烧杯中,用水稀释一倍,加入1~2滴0.2%酚酞指示剂,用0.1 mol/LNaOH 溶液中和至甲醛溶液呈淡红色。
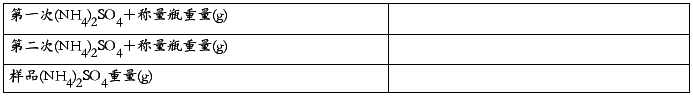
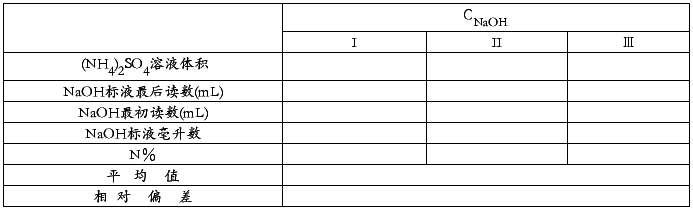
3. 试样中含氮量的测定: 准确称取0.4~0.5 g的NH4Cl或1.6~1.8 g左右的(NH4)2SO4于烧杯中,用适量蒸馏水溶解, 然后定量地移至250 mL容量瓶中,最后用蒸馏水稀释至刻度,摇匀。 用移液管移取试液25 mL于锥形瓶中,加1~2滴甲基红指示剂, 溶液呈红色,用0.1 mol/L NaOH溶液中和至红色转为金黄色,然后加入8 mL已中和的1:1甲醛溶液,再加入1~2滴酚酞指示剂摇匀,静置一分钟后,用0.1 mol/L NaOH 标准溶液滴定至溶液淡红色持续半分钟不褪,即为终点(2)。记录读数,平行做2~3次。根据NaOH 标准溶液的浓度和滴定消耗的体积,计算试样中氮的含量。
四、实验数据记录
称量记录
NaOH标准溶液滴定(NH4)2SO4
(1)、甲醛常以白色聚合状态存在,称为多聚甲醛。甲醛溶液中含有少量多聚甲酸不影响滴定。
(2)、由于溶液中已经有甲基红,再用酚酞为指示剂,存在两种变色不同的指示剂,用NaOH滴定时,溶液颜色是由红转变为浅黄色(pH约为6.2),再转变为淡红色(pH约为8.2)。终点为甲基红的黄色和酚酞红色的混合色。
第二篇:化肥中含氮量的测定
硫酸铵中含氮量的测定
一、实验目的
1.学会用甲醛法测定氮含量,掌握间接滴定的原理。
2.学会NH4+的强化,掌握试样消化操作。
3.掌握容量瓶、移液管的正确操作。
4.进一步熟悉分析天平的使用。
二、实验原理
常用的含氮化肥有NH4Cl、(NH4)2SO4、NH4NO3、NH4HCO3和尿素等,其中NH4Cl、(NH4)2SO4和NH4NO3是强酸弱碱盐。由于NH4+的酸性太弱(Ka=5.6×10-10),因此不能直接用NaOH标准溶液滴定,但用甲醛法可以间接测定其含量。(NH4)2SO4通过处理也可以用甲醛法测定其含氮量。甲醛与NH4+作用,生成质子化的六次甲基四胺(Ka=7.1×10-6)和H+,其反应如下:
4NH4+ + 6HCHO = (CH2)6N4H+ + 3H+ + 6H2O
所生成的H+和(CH2)6N4H+可用NaOH标准溶液滴定,采用酚酞作指示剂。 标定NaOH标准溶液的基准物质为邻苯二甲酸氢钾,其反应为:
COOHCOOK+NaOHCOONa
COOK+H2O
化学计量点时,溶液呈弱碱性(pH=9.20),可选用酚酞作指示剂。
三、仪器与试剂
容量瓶(250mL)、移液管(25mL)、锥形瓶(250mL)、碱式滴定管(50mL)、洗耳球、分析天平
氢氧化钠、邻苯二甲酸氢钾、硫酸铵、甲基红指示剂(0.2%水溶液)、酚酞(0.2%乙醇溶液)、甲醛溶液(1:1)
四、实验步骤
1.0.1mol·L-1NaOH标准溶液的配制及标定
1
用台秤迅速称取1g NaOH固体于100mL小烧杯中,加约30mL无CO2的去离子水溶解,然后转移至容量瓶中,用去离子水稀释至250mL,摇匀后,用橡皮塞塞紧。洗净碱式滴定管,检查不漏水后,用所配制的NaOH溶液润洗2~3次,每次用量5~10mL,然后将碱液装入滴定管中至“0”刻度线上,排除管尖的气泡,调整液面至0.00刻度或零点稍下处,静置1min后,精确读取滴定管内液面位置,并记录在报告本上。
用差减法准确称取0.4~0.6g已烘干的邻苯二甲酸氢钾两份,分别放入两个已编号的250mL锥形瓶中,加20~30mL水溶解(若不溶可稍加热,冷却后),加入1~2滴酚酞指示剂,用0.1mol·L-1 NaOH溶液滴定至呈微红色,半分钟不褪色,即为终点,计算NaOH标准溶液的浓度。
2.(NH4)2SO4中氮含量的测定
准确称取1.6~2.0g(NH4)2SO4试样于小烧杯中,用少量蒸馏水溶解,然后完全转移至250mL容量瓶中,用水稀释至刻度,摇匀。
用移液管移取25.00mL上述试液于250mL锥形瓶中,加水20mL,加1~2滴甲基红指示剂,溶液呈黄色;然后加入10mL已中和的1∶1甲醛溶液和1~2滴酚酞指示剂,摇匀,静置2min后,用0.1mol·L-1NaOH标准溶液滴定至溶液呈淡红色,持续半分钟不褪色即为终点,记下读数,计算试样中氮的百分含量,以N%表示。平行测定两次,要求相对平均偏差不大于5%。
思考题
1.尿素为有机碱,为什么不能用标准酸溶液直接滴定?尿素经消化转为NH4+,为什么不能用NaOH溶液直接滴定?
2.中和甲醛和尿素消化液中的游离酸时,分别选用何种指示剂?为什么这样选择?
2
-
硫酸铵中含氮量的测定
实验六硫酸铵中含氮量的测定甲醛法一实验目的1了解酸碱滴定法的应用掌握甲醛法测定铵盐中氮含量的原理和方法2熟悉容量瓶移液管的使用方法…
-
硫酸铵含氮量的测定实验报告
硫酸铵含氮量的测定甲醛法一实验目的1了解酸碱滴定法的应用掌握甲醛法测定铵盐中氮含量的原理和方法2熟悉容量瓶移液管的使用方法和滴定操…
-
硫酸铵中氮含量的测定
铵盐中氮含量的测定实验日期实验目的掌握用甲醛法测定铵盐中氮的原理和方法熟练滴定操作和滴定终点的判断一方法原理铵盐是常见的无机化肥是…
-
(化学用)实验三 硫酸铵肥料中含氮量的测定
实验三硫酸铵肥料中含氮量的测定甲醛法实验目的1了解弱酸强化的基本原理2掌握甲醛法测定氨态氮的原理和操作方法3熟练掌握酸碱指示剂的选…
-
实验三 硫酸铵肥料中含氮量的测定
实验三硫酸铵肥料中含氮量的测定甲醛法实验目的1了解弱酸强化的基本原理2掌握甲醛法测定氨态氮的原理和操作方法3熟练掌握酸碱指示剂的选…
-
实验七 铵盐中氮含量的测定(甲醛法)
实验七硫酸铵中含氮量的测定一摘要通过二目的要求1学会用酸碱滴定法间接测定氮肥中氮的含量2进一步掌握天平移液管的使用三实验原理氨态氮…
-
01实验1 铵盐中氮含量的测定(甲醛法)
实验一铵盐中氮含量的测定甲醛法实验日期实验目的掌握用甲醛法测定铵盐中氮的原理和方法熟练滴定操作和滴定终点的判断一方法原理铵盐是常见…
-
硫酸铵含氮量的测定实验报告
硫酸铵含氮量的测定甲醛法一实验目的1了解酸碱滴定法的应用掌握甲醛法测定铵盐中氮含量的原理和方法2熟悉容量瓶移液管的使用方法和滴定操…
-
硫酸铵中氮含量的测定
铵盐中氮含量的测定实验日期实验目的掌握用甲醛法测定铵盐中氮的原理和方法熟练滴定操作和滴定终点的判断一方法原理铵盐是常见的无机化肥是…
-
实验四 铵盐中含氮量的测定(甲醛法)
实验四铵盐中氮含量的测定甲醛法重点容量瓶的使用NaOH标液的配制和标定甲醛法测定氨态氮的原理和操作方法试验结果的记录和铵盐的含氮量…