碱金属及其化合物的性质实验报告
碱金属及其化合物的性质实验报告
实验者: 实验日期:
实验目的:通过亲自做钠及化合物性质的实验,加强对碱金属及其化合物的性质的认识。
实验器材:试管、试管夹、烧杯、胶头滴管、铁架台、酒精灯、药匙、滤纸、
粗玻璃管,带导管的橡皮塞、铂丝、蓝色钴玻璃、水槽、镊子、蒸发皿、火柴、小刀
实验药品:钠、Na2O2、Na2CO3、NaHCO3、CuSO4溶液、 KCl溶液、稀盐酸、酚酞试液、澄清的石灰水。
实验步骤:
1、钠的性质

2、过氧化钠的性质
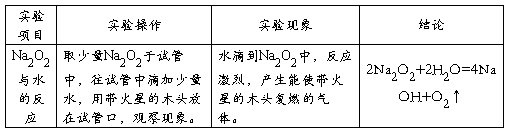
3、Na2CO3与NaHCO3的性质
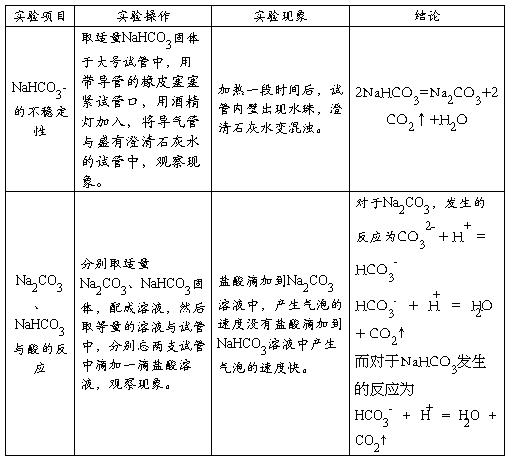
4、用焰色反应检验Na+、K+、Cu2+

实验讨论:
1、在NaHCO3加热分解的实验时,为什么要先将导管移出烧杯,然后再熄灭酒精灯?
答:这样做主要是防止倒流。
2、做好焰色反应的关键是什么?
答:关键是将铂丝灼烧至无色。
[注意事项]:
1、不要用手直接接触金属钠
2、实验中所取钠块不得超过黄豆粒大小
第二篇:新编实验报告4(人教版高一)-碱金属单质及化合物的性质
高中化学实验四 碱金属单质及化合物的性质
【实验目的】
1、认识金属钠的物理性质,探究钠与氧气、水反应。
2、了解过氧化钠的物理性质,探究过氧化钠与水、二氧化碳的反应。
3、实验碳酸钠与碳酸氢钠的重要性质。
4、掌握焰色反应的实验操作。
【实验器具】
仪器:玻璃片、小刀、滤纸、镊子、坩埚盖、大烧杯、酒精灯、铁架台(带铁夹)、试管、火柴、铂丝(或光洁无锈铁丝)、酒精灯、蓝色钴玻璃(检验钾时用)
试剂:金属钠、过氧化钠、水、酚酞溶液、碳酸钠、碳酸氢钠、稀盐酸、氯化钠溶液、氯化钾溶液、胆矾粉末。
【实验探究过程与结论】
一、探究钠与过氧化钠的性质

二、探究碳酸钠和碳酸氢钠的性质
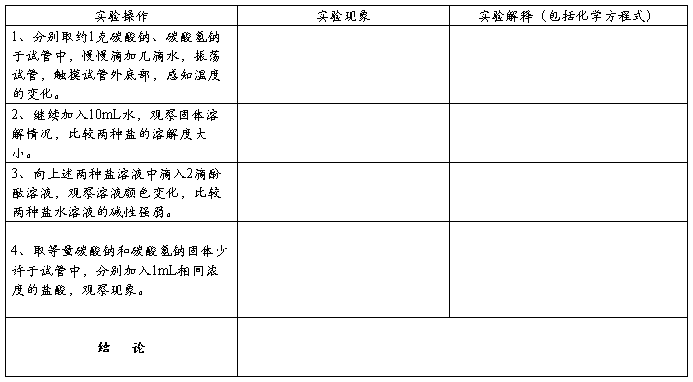
三、焰色反应
1、实验操作
(1)将铂丝用稀盐酸清洗干净,再在无色火焰上灼烧至无色;
(2)蘸取试样(固体也可以直接蘸取)在无色火焰上灼烧,观察火焰颜色,从而判断试样中所含元素种类。
(3)将铂丝再用稀盐酸清洗干净,即可继续做新的实验。
注意:若检验钾元素要透过蓝色钴玻璃观察。因为多数情况下钾离子溶液中常含有钠离子,而钠元素的焰色反应为很浓的黄色,掩盖了钾元素很浅的紫色,导致无法判断)。
2、实验结果
钠元素的焰色为 ,钾元素的焰色为 ,铜元素的焰色为 。
【实验练习】
1.钠着火时,采用哪种来灭火方式最好…………………………………………………( )
A、水 B、煤油 C、泡沫灭火器 D、砂子
2.少量NaOH最好贮存在…………………………………………………………………( )
A、敞口塑料瓶中 B、玻璃塞的棕色瓶中
C、橡胶塞的广口瓶中 D、铁制容器中
3.下列关系正确的是………………………………………………………………………( )
A、还原性:Na>K B、离子半径:Na+>K+
C、热稳定性:Na2CO3>NaHCO3 D、熔点:Na<K
4.下列叙述中不正确的是…………………………………………………………………( )
A、钠在反应TiCl4+4Na=Ti+4NaCl中作还原剂
B、NaOH应密封保存,以防分解变质
C、金属锂不能保存在煤油中
D、盛放KOH溶液的试剂瓶不能用玻璃塞
5.将6g钠和3.2g硫粉迅速混合,放在石棉网上加热,反应后所得固体物质的成分是( )
A、Na2O和S B、Na2O和Na2O2 C、Na2O和Na2S D、Na2O2和Na2S
6.在实验室里做钠跟水反应的实验时,用到的仪器是…………………………………( )
a.试管夹,b.镊子,c.小刀,d.冷凝管,e.滤纸,f.研钵,g.烧杯,h.坩埚,
i.石棉网,j.玻璃片,k.药匙,l.燃烧匙
A、abdi B、cefk C、fghl D、bcegj
7.从理论上讲,Li是很活泼的金属,与水反应应当很剧烈。但事实上反应却是开始较快,一会儿就迅速缓慢起来。其原因主要是…………………………………………………( )
A、Li的密度很小,浮在水面上 B、生成物LiOH溶解度较小,附着在Li表面
C、反应开始放热而使速率变慢 D、反应产物对此反应有催化作用
8.在一定温度下,向饱和烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温,下列说法正确的是…………………………………………………………………………( )
A、溶液中Na+浓度增大,有O2放出 B、溶液pH值不变,有H2放出
C、溶液中Na+数目减少,有O2放出 D、溶液pH值增大,有O2放出
9.下列对进行焰色反应的实验操作注意事项的说明,正确的是………………………( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先灼烧铂丝到火焰无色时,再蘸被检验物质
③每次实验后都要将铂丝蘸浓盐酸后灼烧至火焰无色为止
④实验时最好选择本身颜色较强的火焰
⑤没有铂丝可用无锈铁丝代替
A、仅③不正确 B、仅④不正确 C、④和⑤不正确 D、全部正确
10.Na2CO3是一种很重要的化学物质,某中学某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:
将50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
①将50mL NaOH溶液均分为两份,各25mL;
②用第一份25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③再小心煮沸溶液1~2分钟;
④在得到的溶液中加入另一份(25mL)NaOH溶液,使溶液充分混合。
问题:
I、在②中,刚通入CO2时发生的反应是 ;而后又发生反应 ;将以上两个反应分别改写成离子反应是 、 。
③中煮沸溶液的目的是 。
④中混合另一份NaOH溶液后发生的反应是 ,改写为离子方程式是 。
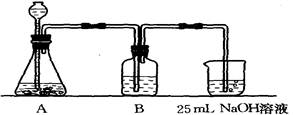 II、按该同学的设计,第②步实验装置如下:
II、按该同学的设计,第②步实验装置如下:
(1)装置A使用的试剂是 (固体)和 溶液;
(2)装置B使用的试剂最好是 (选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是 ,不选择其它三种试剂的原因是(简要文字说明) ;
(3)写出B中可能发生的离子方程式 ,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有 。
(4)有人认为实验步骤③、④顺序对调,即先混合、再煮沸更为合理,你认为对吗? 。为什么? 。
-
稀土有机配合物的制备和性能研究实验报告
稀土有机配合物的制备及性能测定一实验目的1了解稀土元素的基本知识2理解光致发光的基本原理3熟练掌握稀土盐和稀土有机配合物的制备方法…
-
稀土有机配合物的制备及性能测定实验报告
稀土有机配合物的制备及性能测定北京化工大学理学院姓名班级学号时间20xx5820xx521一实验目的1了解稀土元素的基本知识2理解…
-
铬,锰及其化合物的相关性质的实验报告
铬锰及其化合物的相关性质1了解铬和锰的各种常见化合物的生成和性质2掌握铬和锰各种氧化态之间的转化条件3了解铬和锰化合物的氧化还原性…
-
1_4370073_三草酸根合铁(III)的制备与性质和组成分析实验报告
化学综合设计性实验报告三草酸根合铁III的制备与性质和组成分析教学院化学与制药工程学院班级药剂0901班姓名黄启学号0924013…
-
钠及其化合物的性质实验报告
天水一中化学实验报告班级姓名同组人指导教师日期实验题目钠及其化合物的性质实验目的1通过钠及其化合物的性质实验加深对碱金属及其化合物…