四
附件四
关于江苏省卫生国际交流支撑计划申请材料的准备说明
1、江苏省卫生国际交流支撑计划申请表全部在线填写(), 不得手写(签名和单位意见除外)。栏目填写不全,须交资料不全的视为不合格材料,不予受理。
2、填表时,须按栏目要求如实填写,内容应准确、详尽。
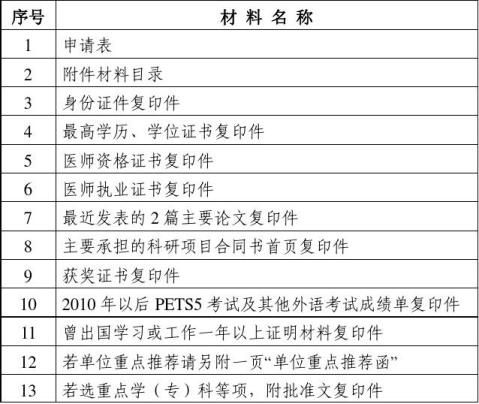
4、邀请来访申请请附被邀请人简历(详述其主要学术成果)。 注:申请表原件、复印件及所附证明材料均须使用A4规格的纸张,证明材料应放在申请表之后。申请表原件单独装订,申请表复印件连同证明材料均按上述顺序装订工整,不得特殊装订。
5、曾出国学习或工作一年以上证明材料,由驻外使(领)馆教育处(组)或所在单位人事部门出具。
6、“申请人保证”一栏,须由申请人本人签字方有效。
7、申请表中“同意”“不同意”选项,若不填,均视为不同意。
8、评审结束后,所有递交材料均不退还单位和本人,请自行留存底稿。
第二篇:选修四定时检测
选修四定时检测(时间:60分钟)
姓名 分数
一、单项选择题(每题6分,共42分)
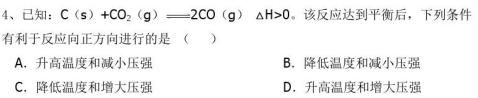
1、20xx年巴黎车展示上,世界各大汽车商纷纷推出环保动力小汽车,使用的新型环保电池为 ( )
A.氢氧燃料电池 B.锌锰电池 C.镍镉电池 D.铅蓄电池 2、下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液 C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液 3、判断下列离子方程式书写正确的是( ) A.石灰乳与盐酸混合:H++OH-=H2O
B.稀硫酸与氢氧化钡溶液混合:Ba2++OH-+H++SO42-= Ba SO4↓+ H2O C.用NaOH溶液吸收少量CO2:2OH-+CO2=CO32-+H2O
D.次氯酸钙溶液中通入过量SO2:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
5、A、B、C是三种金属,根据下列 ①、② 两个实验:
①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解;
②电解物质的量浓度相同的A、C混合盐溶液时,阴极上先析出C(使用惰性电极)。确定它们的还原性强弱顺序为
A、A>B>C B、B>C>A C、C>A>B D、B>A>C 6、为了得到比较纯净的物质,使用的方法恰当的是( )
A. 向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体 B. 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C. 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D. 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
7、下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) -B.0.1 mol/L NH4Cl溶液:c(NH+ )=c(Cl) 4C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) 二、非选择题(每空2分,共58分)
8、(12分)常温下,将0.002molNaOH和0.01molNH4Cl溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是 __________________、
_____________________ 、__________________________________。
(2)溶液中共有
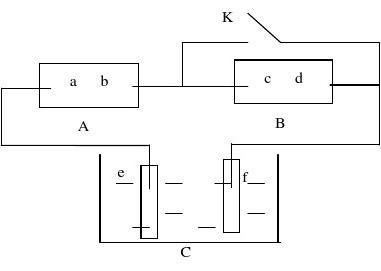
(3)物质的量之和为0.01mol的两种粒子是______、 9、(14分)下图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(1)电源A的a为 极。电极f的名称是 。
(2)滤纸B上C点的电极反应式为: , 滤纸B上发生的总反应方程式为: 。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上的电极反应式为: ; 电解槽中盛放的电镀液可以是 或 (只要求填两种电解质溶液)。
10、(16分)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒·夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g)?H >0 达到平衡时,c(A)=2mol/L, c(B)=7mol/L, c(C)=4mol/L。试确定B4C(g) 的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
A.充入惰性气体 B.加压 C.升温 D.使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。
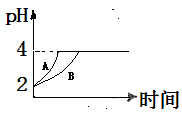
则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m(选填“<”、“=”、“>”)。 2
(3)氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有:①__________,② ,用离子方程式表示产生上述现象的原因 ;在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象,这种单质是 。
11、(16分)某课外活动小组同学用下图装置进行实验,试回答下列问题。
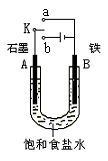
(1)若开始时开关K与a连接,则B极的电极反应为 。
(2)若开始时开关K与b连接,则B极的电极反应为 , 总反应的离子方程式为 。有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若在室温下B极产生2.24 L气体,则电解中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
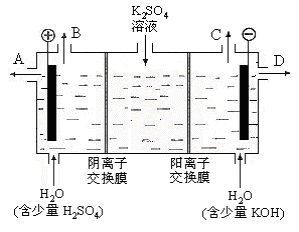
①该电解槽的阳极反应式为 。 ②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”) 导出。 ③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
-
20xx年12月四级考试作文总结
20xx年x月四级考试作文总结付力菘1.书信及记叙文Passage1求学信(将划线部分替换为括号内内容就成为求职信)DearSir…
-
cet四级作文练习
大学英语四级考试预测作文(20xx.06)预测1SalaryorInterest?1.有的人找工作的时候选择兴趣,有的选择工资2.…
-
英语四级写作常用短语总结7
英语四级写作常用短语总结(7)callfor叫(某人)来;要求,需要calloff取消callon/upon访问,拜访;号召,要求…
-
英语四级最常考的短语总结
英语四级最常考的短语总结1)atthethoughtof一想到2)asawhole(=ingeneral)就整体而论3)atwil…
-
20xx年河北省四级联考报考条件
20xx年河北省四级联考报考条件20xx年河北省四级联考考试公告职位表真题解析在线估分职位表下载笔试备考专题等考试信息详情点击:h…
-
西井镇妇联工作总结
西井镇妇联会前半年工作总结忙碌的日子总是过得飞快,转眼间半年又匆匆而过,我镇妇联在各级领导的指导和支持下,具体做了以下几方面工作:…
-
新港二小20xx年学校师德师风建设总结
新港二小20xx年学校师德师风建设总结为强化师德、铸造师魂。实现“德高为师、奉献为荣”。我校教师进行了认真的讨论,大家清楚而又深刻…
-
元旦登山比赛活动总结
“庆元旦”登山比赛总结一.活动背景及目的:为迎接元旦,喜迎新年,展望未来。在20xx年元旦之际,我们湖南大学外国语与国际教育学院0…
-
20xx年##支行案件防控工作总结-
##支行20xx年度案件防控工作总结根据陕西银监局《转发银监会案件稽查局关于做好20xx年案防稽查工作总结的通知》(陕银监办发【2…
-
工作总结20xx年工作总结(妇联)
教育资讯网**年工作总结和**年工作计划(妇联)**年,校妇委会在校党委的领导下,在各级妇联的关心指导下,以邓小平理论和“三个代表…