暑假化学社团活动资料
暑假化学社团活动资料
自制酸碱指示剂
背景
? 300多年前,英国年轻的科学家罗伯特·波义耳在化学实验中偶然捕捉到一种奇特的实验现象,科学家将花带到实验室,不小心将酸液见到花瓣上,花瓣变成了红色,科学家看到后,既新奇又兴奋,于是他又将其他酸的稀溶液滴到花瓣上,发现花瓣都变成了红色。
意义
? 酸碱指示剂在初中化学课本中就已经出现了,但是讲解的较为粗浅,而自制酸碱指示剂是许多人做过的事情,并且留下来大量的资料
? 通过亲身实践加深对指示剂的理解,同时验证前人留下的成果,并尝试发掘新的指示剂
目标
? 制出若干种酸碱指示剂,与资料中的比对是否一致
? 寻找身边新的植物指示剂
? 根据实验结果总结出效果较明显的酸碱指示剂
? 推荐辨别植物的方法
方法
? 文献研究法
? 在图书馆借阅相关书籍,上网检索酸碱指示剂相关文献,同时获取植物的相关信息,了解相关注意事项。
? 实验研究法
? 明确研究目标,设计合理的实验方案,获得实验数据,分析得出相关结论。
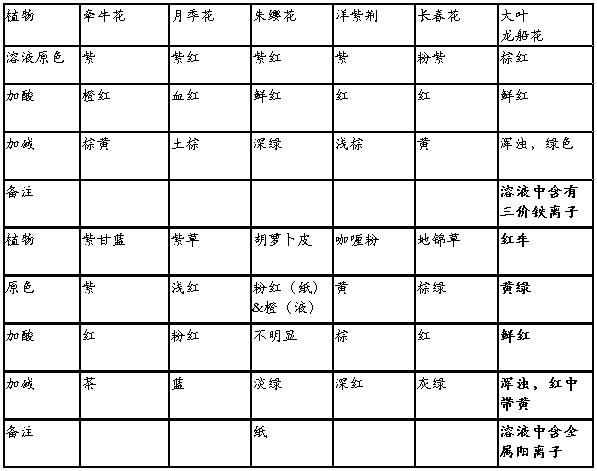
总结
? 植物推荐:
? 1.月季花,洋紫荆,朱缨花,长春花,紫草等较适合做酸碱指示剂,且通常加酸变红,加碱变绿或黄。
? 2.叶类植物因过程较繁杂,效果不明显,故不推荐
? 植物辨别方法
? 1.如有花瓣,通常为紫色或红色的适合做酸碱指示剂,采回后将花瓣捣烂榨汁即可使用
? 2.如无花瓣,枝干为红色,紫红色者也可用于实验,效果相对较好,但所需的量比花瓣类大(因汁液较少)
? 3其他类,条件所限,并没有得出可靠的相关结论,故在此不列入讨论
? 注意:上述材料均需现制现用,最多不得超过一天,否则效果不佳
? 植物辨别方法
? 1.如有花瓣,通常为紫色或红色的适合做酸碱指示剂,采回后将花瓣捣烂榨汁即可使用
? 2.如无花瓣,枝干为红色,紫红色者也可用于实验,效果相对较好,但所需的量比花瓣类大(因汁液较少)
? 3其他类,条件所限,并没有得出可靠的相关结论,故在此不列入讨论
? 注意:上述材料均需现制现用,最多不得超过一天,否则效果不佳
收获&感悟
? 加强了动手能力
? 加深了对指示剂的了解
? 增进了同学感情
? 丰富了课外知识
? 培养了学习化学的兴趣
? 感受并初步培养起探究精神
? 通过这次研究性学习,我们学会重视身边的每一样事物,无论它多么不起眼,它都会有闪光点,就像小杂草可以成为指示剂一样,再微小的东西也有成为“指示剂”的可能,而这一切都需要我们用心去体会,去发掘。
? 用心去看,下一秒就会出现的美好!
酸碱性质
一, 酸的通性。
1, 酸碱指示剂作用。酸可以使紫色的石蕊试液变红色,蓝色石蕊试纸变红色,无色酚酞试液不变色。
2, 酸可以与碱发生中和反应。(中和反应:酸碱互相交换成分,生成盐和水的反应(NaOH+HCl=H2O+NaCl)。联系————复分解反应:两种物质互相交换成分,生成另外两种物质的反应(Ca(OH)2+NaCO3=NaOH+CaCO3)。置换反应:一种单质和一种化合物反应,生成另一种化合物和另一种单质(Zn+HCl=H2+ZnCl2)。氧化还原反应:有氧气生成或者氧气生成的反应的反应(局限);有化合价升降的反应为氧化还原反应(H2+CuO=H2O+Cu)。化合反应:由两种或者两种以上的物质反应生成生成一种物质的反应(2H2+O2=2H2O)。分解反应:由一种物质反应生成两种或者两种以上的物质的反应(2KClO3=3O2+2KCl)。(基本反应类型型:化合反应,分解反应,置换反应,复分解反应。)
3, 与活泼金属反应产生氢气和相应的盐。金属活动顺序表:K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,H,Cu,Hg,Ag,Pt,Au.排在氢前面的可以从酸中置换出氢生成氢气。
4, 与碱性氧化物反应生成盐和水。H2SO4+CuO=H2O+CuSO4.(碱性氧化物的定义:能与酸反应生成盐和水的氧化物叫碱性氧化物。)
5, 与部分盐反应。主要就是与碳酸盐反应生成相应的盐二氧化碳和水。H2SO4+CaCO3=CO2+H2O+CaSO4
6, 几种重要的酸。1,盐酸
(1) 盐酸:是氯化氢溶于水以后形成的酸,浓盐酸具有挥发性,物理性质:无色或微黄色发烟液体,有刺鼻的酸味,(浓盐酸中溶质的质量分数一般为百分之36.)注意:区分雾与烟的区别。
(2) 与碱反应。用氢氧化铝治胃酸过多的基本原理。Al(OH)3+HCl=H2O+AlCl3
(3) 盐酸碱性氧化物反应。1,6HCl+ Fe2O3=2FeCl3+3H2O除铁锈的基本原理。2, 2HCl+ FeO=H2O+FeCl2. 3,CuO+2HCl=H2O+CuCl2(溶液淡蓝色,无水晶体为无色)。.总结:盐酸与金属氧化物反应,反应过程中各种元素的花和价保持不变。
(4) 属于一元强酸。
(5) 与金属反应。反应活性与金属活动性顺序相同。其中钾钙镁除外因为他们会直接与水反应。产生氢气快慢的顺序为:镁,铝,锌,铁;相同质量产出氢气的顺序为:铝,镁,铁,锌。注意:当可以生成多种价态的金属与盐酸反应时,生成的是低价的盐。例如:Fe+2HCl= H2+FeCl2不会生成FeCl3(。溶液为黄色)
(6) 可以使紫色的石蕊试液变红色,蓝色的石蕊试纸变红,无色酚酞不变色。
(7) 用途:重要的无机化工产品,广泛用于染料、医药、食品、印染、皮革、冶金等行业。 盐酸能用于制造氯化锌等氯化物(氯化锌是一种焊药),也能用于从矿石中提取镭、钒、钨、锰等金属,制成氯化物。 随着有机合成工业的发展,盐酸(包括氯化氢)的用途更广泛。如用于水解淀粉制葡萄糖,用于制造盐酸奎宁(治疗疟疾病)等多种有机药剂的盐酸盐等。 在进行焰色反应时,通常用稀盐酸洗铂丝(因为氯化物的溶沸点较低,燃烧后挥发快,对实验影响较小)。
2,硫酸,
(1),H2SO4,溶于水以后形成的酸,浓硫酸具有氧化性,脱水性(碳化反应),吸水性(干燥剂)。浓硫酸中溶质的质量分数为百分之98。物理性质:纯硫酸是一种无色无味油状液体。常用的浓硫酸中H2SO4的质量分数为98.3%,其密度为1.84g·cm-3其物.质的量浓度为18.4mol·L-1。硫酸是一种高沸点难挥发的强酸,易溶于水,能以任意比与水混溶。浓硫酸溶解时放出大量的热,因此浓硫酸稀释时应该“酸入水,沿器壁,慢慢倒,不断搅。” 若将浓硫酸中继续通入三氧化硫,则会产生"发烟"现象,这样超过98.3%的硫酸称为"发烟硫酸"
(2)稀硫酸的化学性质与盐酸基本相同,具备酸的通性。例如:CuO+H2SO4=CuSO4+H2O,其中硫酸铜溶液为蓝色,无水硫酸铜为白色,含结晶水的硫酸铜为谈蓝色。
(3)浓硫酸的吸水性,指的是浓硫酸可以将水分子吸收并结合成稳定的水合物,是其他物质保持干燥。此性质可以主要用来干燥酸性气体。属于物理性质。
(4)浓硫酸的脱水性: ,浓硫酸具有把物质按水分子中氢氧原子数的比(2∶1)夺取被脱水物中的氢原子和氧原子。
(5)浓硫酸的稀释,浓硫酸稀释时应该“酸入水,沿器壁,慢慢倒,不断搅拌,因为浓硫酸溶于水会放出大量的热。黑色面包反应,先是脱水反应后是氧化反应,2H2SO4+C=CO2︱+2SO2︱+2H2O
(6)强氧化性,铁和铝在冷的浓硫酸中会钝化生成致密氧化膜阻止浓硫酸进一步与它们反应,所以可以用铝罐或者铁罐运输浓硫酸。但加热情况下不尽能活泼金属反应还可以与不活泼金属反应。例如:Cu+H2SO4=CuO+H2O+SO2︱加热情况下.钝化属于化学反应。由于它的强氧化性,所以可以和部分非金属反应如,碳,硫,磷等反应自身被还原二氧化硫。还可以跟其他还原性物质反应如硫化氢等
(7).难挥发性(高沸点):制氯化氢、硝酸等(原理:利用难挥发性酸制易挥发性酸)如,用固体氯化钠与浓硫酸反应制取氯化氢气体
(8)用途:硫酸是基本化学工业中重要产品之一。它不仅作为许多化工产品的原料,制造火药,化肥,冶炼金属,精炼石油。
3,硝酸。
(1)物理性质:纯硝酸是无色、易挥发、刺激性气味的液体。常用浓硝酸质量分数约为69%,98%以上的硝酸叫“发烟”硝酸。
(2)硝酸在见光或受热时均易分解,且越浓越易分解,分解产生的NO2又溶于其中使之变黄色。(4HNO3 = 4NO2↑+O2↑+2H2O(与方程:4NO2+O2+2H2O=4HNO3进行对照)所以: 保存:棕色瓶,阴凉处。要点:越浓越易分解
(3)与石蕊试液反应是先出现红色,微热甚至不加热,红色会消失。分析:】①硝酸有酸的通性,能电离出H+。②硝酸具有强氧化性。
(4)强氧化性。所以常温硝酸也可以与铁铝发生钝化反应。加热时浓硝酸可与铁铝迅速反应。】HNO3+Cu,稀硝酸反应生成一氧化氮,浓硝酸生成二氧化氮。
(4),用途:用于有机合成, 还用作治疗药物(血管舒张剂)、炸药:
总结:①HNO3与金属反应时没有H2生成;通常浓HNO3被还原成NO2,稀HNO3被还原成NO。②反应中,HNO3只是部分被还原为NO2或NO,HNO3既表现了氧化性,又表现了酸性。③硝酸不论浓稀都有强氧化性。④硝酸与硫酸氧化性比较:浓稀硝酸在常温下就都能与铜反应;而浓硫酸还需加热,稀硫酸铜加热不反应;这说明氧化性硝酸比硫酸强。
二,1,碱的通性。
(1) 酸碱指示剂作用,碱可以使紫色的石蕊试液变蓝色,使无色的酚酞试液变红色。
(2) 与酸性氧化物反应生成盐和水。2NaOH+CO2=Na2CO3+H2O
(3) 与酸发生中和反应。2HCl+Ca(OH)2(白色)=CaCl2(白色)+H2O
(4) 与某些盐反应。3KOH+FeCl3=Fe(OH)3(红色)+3KCl,
2,、氢氧化钠(NaOH)
1、俗称:“火碱”、“烧碱”、“苛性钠”。从物质的俗称可看出NaOH是一种很“厉害”的碱,一种有强碱性和强腐蚀性的碱。
2、物理性质:白色固体、极易溶于水,溶解时放出大量的热,氢氧化钠的固体露置在空气里,易吸收水分,表面变潮湿而逐渐溶解,这种现象叫做潮解,因此,固体NaOH可做干燥剂。NaOH有强烈的腐蚀性,使用时要注意NaOH的水溶液有涩味和滑腻感(不要品尝或用手触摸)。
3、化学性质:
(1)氢氧化钠与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)氢氧化钠跟非金属氧化物反应
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O
2NaOH+SO3=Na2SO4+H2O在此类反应中,氧化物都变成相应的酸根,各元素的化合价都不变,可应用于实验或工业生产的尾气吸收中。
(3)氢氧化钠与酸的反应
NaOH+HCl=NaCl+H2O
NaOH+HNO3=NaNO3+H2O
2NaOH+H2SO4=Na2SO4+2H2O
(4)氢氧化钠与某些盐的反应。
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓(蓝色沉淀)
3NaOH+FeCl3=3NaCl+Fe(OH)3↓(红褐色沉淀)氢氧化钠与盐的反应,一般生成新盐和不溶于水的新碱。注意:NaOH必须密封保存。原因:空气中含水和CO2,如果将NaOH露置,①NaOH易潮解②NaOH易与CO2反应而变质。
4用途:被广泛地用于制肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。工业上用电解饱和食盐水来制取氢氧化钠。
二、氢氧化钙[Ca(OH)2]
1、俗称:熟石灰、消石灰、水溶液称石灰水。
2、制取方法:CaO+H2O=Ca(OH)2,反应放出大量的热可以使水沸腾。
生石灰 熟石灰
3、物理性质白色粉末,微溶于水,有腐蚀性。
4、化学性质
(1)与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)与非金属氧化物反应
CO2+Ca(OH)2=CaCO3↓+H2O
(3)与酸反应
2HCl+Ca(OH)2=CaCl2+2H2O此性质在农业上用于改良酸性土壤。
(4)与某些盐反应
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH由于Ca(OH)2的碱性不如NaOH强,所以此反应进行时溶液的pH值不断上升,工业用此反应来制取NaOH,称为“苛化制碱”法,分离NaOH和CaCO3可采用溶解、过滤、蒸发的方法。
5、用途工业用Ca(OH)2砌砖、抹墙,就是利用熟石灰能吸收空气中的CO2变成坚硬的CaCO3这一性质。熟石灰还可用来制造NaOH和漂白粉。农业上用熟石灰降低土壤酸性,和配制农药“波尔多液”(原料是熟石灰和硫酸铜)和石硫合剂(原料是熟石灰和硫)。
注意:不使用的Ca(OH)2要密封保存。原因跟氢氧化钠相似。另外,生石灰也要密封。
三、其它几种常见的碱:(氨水易挥发,且有刺激性气味)

四、碱的分类和命名
1、分类:因为碱的组成中都含OH-,所以不存在有氧无氧的问题。碱的分类只从电离出的OH-的个数入手,分为一元碱,二元碱和三元碱。
2、命名:碱的命名比较简单,根据它的组成——氢氧根离子和金属离子的名称,叫做“氢氧化某”就行了,如Mg(OH)2叫做氢氧化镁等。如果碱中的金属元素有可变化合价,命名时要把含高价金属离子的碱称为“氢氧化某”,把含低价金属离子的碱称为“氢氧化亚某”。例如,Fe(OH)3中铁元素的化合价是+3价,为高价,这种碱叫做“氢氧化铁”,Fe(OH)2中铁元素的化合价是+2价,为低价,这种碱叫做“氢氧化亚铁”。
第二篇:关于小学生社团活动的全套资料
娄丈子中心小学2012——2013学年度
社团活动组织机构及职责 组 长:耿 琪
职责:组建社团,制定实施方案,定时组织社团开展活动,进行活动评比及总结,进行资料收集与整理。
成 员: 领导:陈红、张生
职责:协助组长制定方案,审核社团成员,进行活动时的安全教育,提供活动的物质保证。
老师:各班班主任和社团辅导教师
职责:听从学校领导和社团组长的安排,积极组织学生参加各社团活动,对相关活动做好辅导;负责学生参加社团活动时的纪律和安全教育;及时推荐有特长的同学参加相关社团,并培养他们参加各种比赛的素养。
学生:各班少先队中队长
职责:听从班主任和相关辅导老师的指挥,协助相关教师搞好相关活动;负责相关班级学生纪律和安全的监督和提醒;及时协助老师上报资料。
娄丈子中心小学生社团活动方案
一、指导思想
进一步落实“培养有中国灵魂和世界眼光的现代人”的教育理念,切实推进现代人素质工程,塑造学生们的领袖气质、管理能力、创新精神,引导孩子们学会自主管理、自主发展、自主成功。
二、组建目的:
扩大学生的学习领域,满足学生学习的权利,提供多样的学习渠道,培养学生的交往能力合作精神,协助老师安排组织课余活动。
三、社团定义:
依据学校的课程规划实施的团体性、系统性的活动课程,由专业的老师指导,由学生自己组织定期和不定期的训练研习的学习团体。
四、社团内容:
社团活动包括艺术类、学科类、游戏类及其它类。
五、办团原则:
1、学校组织引导原则
2、专业教师指导原则
3、学生发展需求原则
4、学生全员参与原则
5、定期评比表彰原则
六、业务内容:
社团活动纳入学校的课程计划,其业务如下:拟定实施计划、自主训练计划、参与比赛活动、发布成果论文。
七、参加对象:
本校学生,自愿参加,并经过家长同意。
八、活动时间:
自习课、大课间、活动课。
九、申办办法:
1、本校学生申请——学校审核、审批——学校统一规划活动
2、每个学生社团至少5人,最多15人,特别优秀社团可逐级申请更多社
员。
十、推荐项目:
1、计算机社团 2、花样跳绳社团 3、古诗背诵社团
4、小作家社团 5、爱天文社团 6、戏曲表演社团
7、儿歌社团 8、小游戏社团 9、绘画社团
10、小主持人社团11、故事大王社团 12、花样篮球社团
12、羽毛球社团 13、航模社团 14、象棋社团
15、舞蹈社团 16、声乐社团 17、器乐社团
18、剪纸社团 19、书法社团 20、乒乓球社团
十一、评比表彰:
每学期学生社团要进行成果展示,由大队委具体负责组织评比,由大队部进行专业指导,评比位居后五位的下学期自动淘汰。
娄丈子中心小学社团活动报名表
社团名称:绘画社团 辅导教师: 20xx年9月
教师社团活动教研学习资料
组建小学生社团的意义
一、社团是小学生素质拓展的载体
参加小学生社团的是分散在学校校园中、具有共同爱好和特长的同学凝聚在一起而形成的,具有一种群体优势。在共同目标鼓舞下,大家能够集思广益,采集创新资源,互相鼓励,互相配合,充分发挥集体的智慧和力量,创造思想的财富。同时,丰富多彩的社团活动内容非常广泛,包括了许多学科的知识,充满了创新的活力,激发小学生不断去创新知识。
二、社团能增强小学生的社交能力
1、社团能提高小学生的交往能力和合作意识
小学生通过交往、沟通、交流情感,寻求理解,建立友谊,切磋学问。小学生的交往方式和交往能力直接影响他们的人际关系,影响他们的心理健康,影响他们的成长与发展,也影响学校教育目标的实现。而在社团组织中,由于参与的自由性,吸引了有共同志向和爱好的学生,打破了年级的界限,对小学生来说,社团提供了多角度、多侧面的信息来源,使成员之间能够相互取长补短、共同提高,并在交往中观察学习他人的交往方式,学习有效的沟通方法。 然而小学生仅有交往能力是远远不够的,还必须树立团队合作意识。因为团队合作能力是现代人事业成功的必要条件。群体动力学研究表明,民主式的群体气氛,使成员之间充满信任,不但能提高工作效率,激发成员的创造力,而且群体的内聚力能提高群体成员的士气,明确活动的目的,使大家自觉合作,努力完成群体目标。
2、社团能促进小学生的社会化进程
社会化,是指在特定的社会与文化环境中,个体通过与社会的交互作用,理解和认同社会规范和制度,培养自己的社会角色,树立正确的世界观、人生观和价值观,从而成为能够履行一定社会角色行为的社会人的过程。而社会化过程的中心环节是社会实践,社团组织正是为小学生的社会化提供了模拟的社会情景和实践平台,社团就像一个“微型社会”,迈进社团,犹如走进社会。他们还通过参与各种社团活动和校园文化建设,学生学会了承担责任,理解信誉,尊重承诺,协调人际关系,规范自己的行为,处理各种复杂的矛盾和困难等,为今后更好地适应社会做好了准备。
- 化学社团活动
-
化学社团活动计划
马头铺中学化学的奥秘社团活动计划很多中学生朋友感到化学是一门神秘的学科不知道学习化学有什么用处这主要是他们没有将化学与生活联系起来…
-
化学社团计划书
化学社团活动计划很多学生认为化学是一门神秘的学科不知道学习化学有什么作用这主要是他们没有将化学与生活联系起来造成只是单纯的学习而产…
-
化学兴趣小组活动计划,总结
化学兴趣小组活动总结爱因斯坦坦说过:“兴趣是最好的老师”。兴趣是学生形成自学能力、创造能力的源动力。我们化学兴趣活动的目标侧重于培…
-
化学社团活动计划
利辛高级中学万化社工作计划一指导思想为了响应学校的号召建设校园文化活跃学生课余生活促进中学生的全面发展并培养自觉主动的学习兴趣加强…
-
13-14学年度第一学期化学社团活动总结
“蓝眼泪”化学社团活动总结寒风吹在脸上像刀割一样,看看窗外光秃秃的树枝是凝冻的冰霜,突然感慨时间的无情,转眼间一个学期有悄然离去。…
-
化学兴趣小组活动计划,总结
化学兴趣小组活动总结爱因斯坦坦说过:“兴趣是最好的老师”。兴趣是学生形成自学能力、创造能力的源动力。我们化学兴趣活动的目标侧重于培…
-
20xx-20xx学年度化学兴趣小组活动计划
20xx20xx学年度化学兴趣小组活动计划一指导思想化学课外活动是化学教学的一个重要方面它既是化学课堂教学的补充也是课堂教学的延伸…
-
初中化学兴趣小组活动计划
初中化学兴趣小组活动计划一指导思想以科学发展观为指导全面贯彻党的教育方针围绕深入实施素质教育全面提高教育教学质量这一中心以加强和谐…
-
化学社团计划书
化学社团活动计划很多学生认为化学是一门神秘的学科不知道学习化学有什么作用这主要是他们没有将化学与生活联系起来造成只是单纯的学习而产…