《蓝色的树叶》教案设计王丽丽
第三届全国“教学中的互联网搜索”优秀教案
《蓝色的树叶》教案设计
黑龙江省齐齐哈尔市甘南县兴十四学校:王丽丽



第二篇:王丽丽教案
初三化学推断题专题教案(第一课时)
天义第三中学 王丽丽
一、教学目的要求
1、知识与技能
(1)进一步熟悉常见物质的化学性质。
(2)能熟练掌握酸、碱、盐的化学性质。
2、过程与方法
引导学生找出推断题中的突破口。
3、情感态度与价值观
培养学生的合作意识,以及勤于思考,严谨求实的科学态度。
二、教学重点和难点
重点:能综合运用所学过的知识解答化学推断题。
难点:找出推断题中的突破口。
三、教学过程
[创设情境]
化学与我们生活密切相关。在我们的日常生活中会遇到多种多样的化学问题。比如,我们家里的厨房就可以看成是一个家庭“实验室”。现在我提出一个厨房中的化学问题:你是怎样鉴别食盐和纯碱的呢?(学生回答:利用物理性质不同,尝味道;利用化学性质不同,加醋酸,观察有无气泡产生。)
总结:对于物质的判断,我们常用的方法很多。如利用物理性质不同,像观察颜色,闻气味,尝味道等方法。当然后两种一般不适合实验室来鉴别
物质。除此而外,就是利用物质间的反应现象来判断物质。如醋酸与纯碱的反应。这些方法,同样适合我们来解决一些其它化学问题如“物质的推断”,“物质的推断”也是我们中考化学中的一种常见题型,那么这种问题又有哪些类型?不同类型的试题又该如何解决呢?这节课我们来学习物质推断专题
(一)。
利用物质物理特性的不同,鉴别物质最为常用的是物质的颜色。(看大屏幕课件展示的物质的颜色)首先同学们先回忆一下咱们学过的有特殊颜色的物质:
1、白色沉淀不溶于稀硝酸:AgCl、BaSO4
2、白色沉淀溶于酸而且有大量气泡产生:BaCO3、CaCO3等
3、红褐色沉淀:Fe(OH)3
4、蓝色沉淀:Cu(OH)2
5、黑色固体:C、CuO、MnO2、Fe3O4、铁粉
6、红色固体:Fe2O3、Cu
溶液的颜色
1、蓝色溶液:含Cu2+的溶液,如CuSO4溶液,CuCl2溶液、Cu(NO3)2溶液。
2、浅绿色溶液:含Fe2+的溶液,如FeSO4溶液,FeCl2溶液、Fe(NO3)2溶液。
3、黄色溶液:含Fe3+的溶液,如Fe2(SO4)3溶液,FeCl3溶液、Fe(NO3)3溶液。
物质的颜色,常常可以作为我们解决推断问题的“突破口”。
在复杂的物质推断问题中,仅仅靠物理特性来区分物质是无法实现的。常常还需要利用这些物质化学性质的区别,通过这些物质发生化学反应现象的不同来进行物质的推断。
下面我们结合实例,给大家讲解此类问题的解决方法。
谈到方法,首先还得将推断命题按照题型分类。常见的题型包括如下四种:描述型、表格型、框图型、连线型。我们先来看第一种题型——“描述型”。
一、描述型推断题:
例1、某固体混合物可能由NaCl、NaNO3、Na2CO3、BaCl2、 CuSO4、Na2SO4中的一种或几种组成,现进行如下实验:(1)将混合物溶于水,得到白色沉淀和无色透明溶液;(2)向(1)中加入足量的稀硝酸,沉淀仅部分溶解;(3)将(2)过滤,往滤液中加入AgNO3溶液,又生成不溶于 稀HNO3的白色沉淀。通过上述实验确定:原混合物中一定有: ,可能有: ,一定没有 。
[学生讨论]
[教师引导]
一、由题目可以知道本题的突破口有三个:
(1)将混合物溶于水,得到白色沉淀和无色透明溶液,可知一定无CuSO4,可能有Na2CO3、BaCl2、Na2SO4中的两种或三种,但肯定要有BaCl2。
(2)加入足量的稀硝酸,沉淀仅部分溶解,说明沉淀物不唯一,可溶的为BaCO3,不溶的应为BaSO4。由此可知混合物中一定有Na2CO3、BaCl2、Na2SO4
三种物质。
(3)往滤液中加入AgNO3溶液,又生成不溶于 稀HNO3的白色沉淀,该沉淀是AgCl。此时,我们最容易误判成分中会有NaCl,其实由于BaCl2中有Cl-,所以,有无NaCl均可以产生AgCl沉淀。所以无法确定是否有NaCl。而NaNO3的存在与否,对实验现象无任何影响,所以也无法确定。结论为:可能含有NaCl和NaNO3。
二、固体成分的确定,与进行的三步实验所发生的现象关系密切。若实验(2)中产生的现象是沉淀全部溶解,那么固体成分又如何呢?
(1)(3)两步与上一问题相同,我们着重看第二步的实验现象。
(2)加入足量的稀硝酸,沉淀全部溶解,说明沉淀物一定只有BaCO3,一定没有BaSO4。据此可知,则混合物中一定有Na2CO3、BaCl2二种物质,且一定没有Na2SO4。
[学生练习]
练习1、有一包白色粉末,可能由氯化银、碳酸钠、硫酸铜、氯化钙、硫酸钠、硝酸钾某几种组成。为了鉴定其成分,实验如下:
(1)将少量粉末放入足量水中,搅拌得无色透明的溶液。
(2)向所得溶液中加入稀硝酸,有气体产生
(3)向溶液中滴加氯化钡溶液,有白色沉淀生成,加入足量稀硝酸,沉淀部分溶解。试根据以上现象推断该白色粉末中一定有 ;一定没有 ;可能含有 (填化学式)
[学生思考、回答]
[教师讲评]
[教师总结]例1与练习1的共同点:都是根据三个实验出现了三个实验现象进行物质成分的推断。不同点是:实验1的现象不同
得出方法:
物理特性不同
化学性质不同(反应现象)
对于酸碱盐的反应现象来说,最为常见的是沉淀或气体。 二、表格式推断题
例2、有A、B、C、D、E五瓶失去标签的无色溶液,它们分别是NaOH、HCI、BaCl2、MgSO4、K2CO3中的一种。为了鉴别,各取少量溶液两两混合实验结果如表一所示。表中“↓”表示生成难溶或微溶的沉淀;“↑”表示有气体产生;“-”表示观察不到明显的现象变化(本实验条件下,生成的微溶物均以沉淀形式出现)。表一:
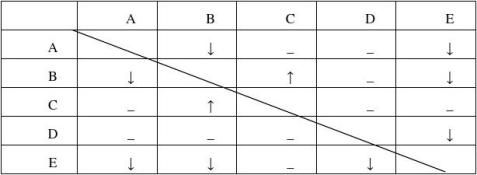
根据实验现象,可以判断A----E的物质名称是: A ___ B___ C___ D___ E____ 1、学生审题
2、教师引导:推断物质依据的就是物质两两混合产生现象如“↓”“↑”“—”
我们进行判断后如何进行记录实验现象
3、学生记录实验现象
NaOH — — ↓ —
HCl — — — ↑
BaCl2 — — ↓ ↓
MgSO4 ↓ — ↓ ↓
K2CO3 — ↑ ↓ ↓
4、教师巡视指导
5、学生回答、教师讲评。
与表格对应的现象是BaCl2有两个“↓”,K2CO3有两个“↓”,有一个“↑”,HCl有一个“↑”,NaOH有一个“↓”,MgSO4有三个“↓”,故A为BaCl2,B为K2CO3,C为HCl,D为NaOH,E为MgSO4。
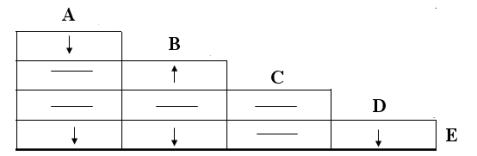
【变换表格样式】我们不难看出,上表中A、B、C、D、E五种物质俩俩混合的现象的表格中,反应现象的记录重复了一次。那么如果将重复记录的反应现象擦除,修改为为如下表格的话,问题又应该如何解决呢?
[学生思考、回答]
[教师讲评]
其实,每种物质与其他物质的反应现象,就在这种物质字母所在的行与列中。解决问题的方法也是相同的。
[学生练习]
练习2、现有稀盐酸、稀硫酸、氢氧化钡、碳酸钠4瓶失去标签的溶液,分别编号为A、B、C、D。每次取少量溶液两两混合,所观察到的现象记录在下表中(“—”表示无明显现象;“↓”表示有沉淀生成;“↑”表示有气体生成)。
由此推断4瓶溶液中的溶质的化学式分别为:
A.B.;C.;D. 写出上述实验过程的有关反应方程式:
[学生思考、回答]
[教师讲评] 利用化学性质最常用的是靠物质发生化学反应的现象来判断。如变色、沉淀和气体。
[总结归纳]
由于时间的原因,这节课我们先介绍这两个类型的推断题,剩下的两种
类型下节课再介绍。其实解推断题就好比是警察侦破案件,要紧抓蛛丝马迹,
并以此为突破口,顺藤摸瓜,最终推出答案。
在“突破口”中,我们推断出物质或者离子,然后对其进行“追踪”,追其来源和去向,从而达到推断物质的目的。对于猜想性的结论还要代入原题中验证,若“路”走的通则已经成功。
-
《蓝色的树叶》教学设计
蓝色的树叶教学设计马红梅一教材分析蓝色的树叶这篇课文给我们的启示是互相帮助不应成为一句口号在别人需要的时候伸出援助之手这是每个人的…
-
蓝色的树叶教学设计及反思
课题19蓝色的树叶本学期总第5657课时本单元第56课时课型新授主备人复备人授课日期1110教学目标知识与能力过程与方法情感态度价…
-
杨晓燕蓝色的树叶教学设计及反思
蓝色的树叶教学设计二年级杨晓燕20xx1124教学目标知识与能力1认识9个生字会写铅笔两个字2正确流利有感情地朗读课文过程与方法采…
-
蓝色的树叶教学设计
蓝色的树叶教学设计江口小学陈武荣设计理念语文课程标准就语文教学中素质教育的落实提出了知识与能力过程与方法情感态度与价值观的三维课程…
-
《蓝色的树叶》教案反思二上
蓝色的树叶教案及反思教学目标1掌握本课生字会认读铅盒皱等生字会写注课铅拿桌景等生字2正确流利地朗读课文在教师的指导下分角色朗读课文…
-
《蓝色的树叶》教学反思
蓝色的树叶教学反思蓝色的树叶是小学语文二年级上册的一篇课文这篇课文讲的是李丽向林园园借绿铅笔林园园没有借的一件事教学时既要让学生看…
-
蓝色的树叶教学反思
蓝色的树叶教学反思蓝色的树叶是小学语文二年级上册的一篇课文这篇课文讲的是李丽向林园园借绿铅笔可林园园舍不得借给她找了很多借口最后李…
-
19《蓝色的树叶》教学反思
19蓝色的树叶教学反思通关小学鲁宏萍蓝色的树叶这篇课文给我们的启示是互相帮助在别人需要的时候伸出援助之手这是每个人的一种责任一种行…
-
蓝色的树叶教学反思
蓝色的树叶教学反思蓝色的树叶教学反思看着课题想着讲过的课像散步在秋风过后的落叶小路上回头看着自己走过的路感慨万千讲课以前我把本课看…
-
蓝色的树叶教学反思
蓝色的树叶教学反思蓝色的树叶是小学语文二年级上册的一篇课文这篇课文讲的是李丽向林园园借绿铅笔林园园没有借的一件事教学时既要让学生看…
-
蓝色的树叶教学反思
蓝色的树叶教学设计江口小学陈武荣设计理念语文课程标准就语文教学中素质教育的落实提出了知识与能力过程与方法情感态度与价值观的三维课程…