原电池教学设计
第二节 化学能与电能
【教学目标】
1、〔知识与技能〕 让学生了解原电池的工作原理。
2、〔过程与方法〕 ①通过实验方式探究原电池工作原理,感
悟科学探究的过程和方法。
②培养实验中的观察能力,思考意识和应变能
力;培养语言智能。
3、〔情感态度与价值观〕通过化学知识与生活、生产相联系,让学
生感到化学就在身边,化学很有用,很亲
切;引导学生关注生活、生产中的化学。
【教学重点】了解原电池的工作原理。
【教学难点】原电池的工作原理。
【探究建议】实验探究 、问题解决。
【课时划分】一课时
【教学过程】
【展示图片】(实物展示各种电池)
【师】在平时用到的计算器、手机、MP5、电子表、笔记本电脑等都要用到电池,可以说现代生产、生活都离不开电池。
【问】哪位同学能说一下电池的能量转换呢?
【学生回答】
【导入课题】我们这节课来学习化学能转化为电能的装置 ---原电池。
【板书】一、原电池
【师】 在学习新知识的之前,同学们先对导学案上的预习成果进行
组内交流、讨论(限时2分钟)。然后回答以下问题:
【预习检测】
1.根据物理科电学知识,电流产生的原因 ,
电流的流动方向由电源的 极到 极,电子的流动方向由电源的
极到 极。
2.氧化还原反应的实质是: 。
3.电解质的概念是: 。 以下物质能导电的有 ,属于电解质的
是 。石墨、氯化钠固体、氯化钠溶液、铁、铜、蔗
糖固体、蔗糖溶液、稀硫酸。能导电的原因是 。
【学生活动】学生举牌抢答。
【创设情境】动画展示“病历档案”:同学们,面向我们的并不是一
位快乐的美眉!自从先后装上两颗假牙(分别是不锈钢和黄金假牙),
“笑笑”女士心情一直不爽----头痛、失眠、心情烦躁。
【问题导入】今天,我想请大家当一次医生,开个处方,让笑笑女士
笑起来。
【初步假设】想一想,病因估计处在哪里?(假牙)
【设计方案】是不是这样呢?让我们模拟口腔中的环境,把稀硫酸想
成口腔溶液----唾液,用Zn和Cu分别代表两颗不同的假牙----不锈钢
和黄金……通过实验来找病因!
【学生分组实验】(分9组实验)
【探究实验一】 把锌片和铜片平行插入稀硫酸溶液中(锌片和铜片
不接触),观察实验现象。
【探究实验二】 把锌片和铜片上端用导线连接起来放到稀硫酸溶液
中(锌片和铜片不接触),会出现什么现象?
【探究实验三】 把锌片和铜片用导线通过电流计连接起来放到稀硫
酸溶液中(锌片和铜片不接触),会出现什么现象?
【问题探究】1、把锌片和铜片平行插入稀硫酸溶液中(锌片和铜片
不接触),有何现象?写出有关反应方程式和离子方程
式?
2、把锌片和铜片上端用导线连接起来放到稀硫酸溶液
中(锌片和铜片不接触),有何现象?写出铜片和锌片
上的电极反应式以及电子由 流向 。
3、 把锌片和铜片用导线通过电流计连接起来放到稀硫
酸溶液中(锌片和铜片不接触),有何现象?从能量转
化角度,你能得出什么结论?
4.如何确定该电池的正负极?
【学生观察并回答】讨论结果采用竞赛抢答形式展示。
【多媒体展示】原电池工作原理flash动画模拟过程
【学生交流讨论,归纳小结】原电池工作原理:锌与稀硫酸发生氧化还原反应,锌失电子成Zn2+,电子从锌片经导线通过电流计流向铜片,H+从铜片上得电子被还原成H2,
【板书】1、把化学能转化成电能的装置叫原电池。
2、 Cu---Zn原电池的工作原理
锌片(负极):Zn- 2e-=Zn2+ (氧化反应)
铜片(正极):2H+ +2e-=H2 (还原反应)
总反应方程式:Zn+ 2H +=Zn2++H2
【解决问题】 通过实验,你认为笑笑女士的病因是什么?(两颗假
牙在口腔溶液中够成原电池,产生的电流刺激脑神经,使该女士头痛、失眠、心情烦躁)
【课堂检测】
【课堂小结】 原电池是将化学能转化为电能的装置。原理是利用自发进行的氧化还原反应,电子由负极流向正极,从而产生电流,将化学能转化为电能。
【思考题】 Cu—Zn原电池产生的是持续稳定的电流吗 ?
【自主发展作业】回家后利用家庭能够提供的一些材料创新设计各种电池。
【板书计划】
第二节 化学能与电能
一、原电池
1、原电池定义
把化学能转化成电能的装置叫做原电池。
2、原电池的工作原理
锌片(负极):Zn- 2e-=Zn2+ (氧化反应)
铜片(正极):2H+ +2e-=H2 (还原反应)
总反应方程式:Zn+ 2H +=Zn2++H2
【教学反思】
本节课一直是高一学生学习的难点,其理论比较抽象,而且要求学生动手实验。本节课我花了很长时间准备(备学生、备教材、备教法、理论联系实际备问题),上完本节课进下心来,细细回顾,特反思如下:
1、 “知识的检测””知识的探究” 采用学生分组讨论,学生抢答的形式,活跃了课堂气氛,激发学生学习积极性。
2、 巧用病例这一情景开头,切实联系所要学的知识,实例生动有趣,一下抓住学生的心。
3、 让学生分组实验,提高动手能力,观察能力,在探究中学到知识。
4、借助现代媒体的微观动画可生动直观的展开原电池工作原理,有利于学生突破原电池原理这一教学难点。
5、 让每一小组做一牌子,以拍卖形式抢答问题在竞争中体现小组群体智慧。
6、本节课因为要给学生足够的时间和空间,让学生自主探究,又要完成本节课教学任务,所以学生探究试验时间不好控制,时间略显紧张。
第二篇:《原电池原理及其应用》(高二全册)一课的教学设计
《原电池原理及其应用》(高二全册)一课的教学设计
丹凤中学A5-2子课题组 佘建平
一、教学策略
本章教材的前几节介绍的都是有关金属的知识,分别介绍了铁和铜的性质。铁和铜在一些酸的溶液中表现出不同的化学性质,但是如果把它们连接在一起放入酸的溶液中,会发生什么现象呢?本节教材以这个实验为引子,引出原电池这一课题。
本节教材大体上可以分为三部分,第一部分是原电池的组成和化学原理;第二部分是化学电源;第三部分是金属的电化学腐蚀。
1、教材地位:
前面曾介绍过电解法冶炼金属,用电解法冶炼金属,实际上是把电能转化为化学能的过程。而原电池则是把化学能转化为电能的一种装置。利用原电池原理制成多种电池在工农业生产、科学研究以及日常生活方面都在广泛的用途。研究原电池原理另一个重要意义就是从本质上弄清金属腐蚀,特别是电化腐蚀的原因,找到金属防护的方法,体现了学以治用,同时对于培养学生分析问题解决问题的能力有很好的训练作用,所以本节内容既是本章的难点,又是本章的重点。
2、教材特点:
本节教材以实验事实入手来介绍铜一—锌原电池的化学原理,然后简单介绍几种化学电池,再以原电池原理来探讨金属腐蚀的原因,并根据这些原因来寻找金属防护的方法。这样,由实践到理论,再用理论指导实践,符合学生的认识规律。同时通过一系列对照实验,增强说服力,更具直观性,有利于提高课堂效果。
3、教学中应注意:
(1)要充分运用实验手段和现代化教学手段,启发学生通过实验、观察、思考、探索原电池反应的化学原理。
(2)[实验4—14]应边做边讲,由学生观察叙述出铁丝、铜丝分别放入酸中时的现象,以及铁丝和铜丝上端接触到一起放入酸中时的现象,教师归纳,并引导学生利用学过的知识分析问题并对不同的实验现象质疑,引入新课。
(3)[实验4—15]应按教材介绍的步骤逐步进行,在实验过程中,随时提出一些启发性问题,引导学生思考。
A、 把锌片和铜片同时浸入稀硫酸中,让学生观察现象并分析原因。
B. 提出问题:“把上端用导线连接的锌片和铜片同时浸入稀硫酸中,现象将有什么不同?”激发学生联系实验4—14预测现象,然后演示。
C、 在导线中间接入一个电流表,电流表指针偏转,让学生观察现象并分析原因。
D、 把电流表与干电池相连,并与原电池相比较,使学生明确原电池的外电路上的电流是从铜片经外电路流向锌片,即电子由锌片流向铜片。
把实验分成这样几个步骤进行,使学生看到具体的实验现象,并通过观察、分析思考,从宏观现象引导到电子流向的微观分析,由表及里逐步分析推理,有利于探索原电池的化学原理。
(4)实验后,可提出几个思考题,让学生带着 问题阅读教材,在阅读后组织学生进行讨论,共同总结出原电池的形成条件。
A、锌片上的电子为什么会流向铜片?
B、 铜片上为什么有气体产生?产生的是什么气体?
C、 铜片上发生了什么反应?写出铜片上反应的电极反应式。
D、 锌片的质量发生什么变化?
E. 锌片上发生了什么反应?写出锌片上反应的电极反应
式。
F、 从能量转变的观点本分析,原电池是一种什么装置? G、试着小结构成原电池的条件。
(5)化学电源的教学要求比较低,可让学生收集一些废旧电池,观察外表、分析类型、用途等。同时教师介绍一些新型化学电池如:铅蓄电池,Al电池、H2和O2燃料电池,锂电池等等。然后组织学生阅读教材,并完成“研究性学习课题。”
应该注意,废旧电池中含有很多有毒、有害的物质,如汞、镉、铅、镍等重金属和酸、碱等,是一种严重的污染物。应引导学生认识废旧电池的危害,不能随意乱扔废旧电池,也不能混入普通垃圾,应集中交回回收部门,进行统一处理。教师可引导学生在学校或大商场设立废旧电池回收箱,回收后交有关部门统一处理。
(6)关于金属的电化腐蚀的内容,可引导学生通过阅读、认识金属腐蚀的本质,危害和钢铁电化腐蚀的原因,并根据原电池原理,尝试去写钢铁腐蚀的电极反应式,联系日常生活实际,提出金属的防护方法。可提出以下思考题使学生探讨:
A、 金属腐蚀的本质是什么?
B、 什么是化学腐蚀?什么是电化腐蚀?
C、电化腐蚀的本质是什么?
D、 在潮湿的空气里,钢铁表面为什么形无数微小的原电池?
E、 金属腐蚀有哪些危害?
F、 防止金属腐蚀应该从哪些方面入手?在生活中你观察到有哪些金属防护措施?
(7)鼓励学生进行家庭小实验,试求用其它金属、水果、蔬菜、溶液等设计小电池。
二、教学目标分析
1、知识能力目标:
(1)使学生理解原电池原理,能进行简单的电极反应分析。
(2)使学生对日常生活中常见的化学电源和新型化学电池有所了解。
(3)使学生了解金属的电化学腐蚀的原理及防护措施。
2、情感认识目标:
(1)通过实验引导探究实验,激发学生强烈的求知欲和对自然科学知识丰富内涵的浓厚兴趣。
(2)通过教学,引导学生动手设计家庭小实验,从中找到成功的喜悦,进而树立献身科学研究的远大理想和抱负。
3、教学重点:
原电池原理
4、教学难点:
原电池的形成条件及电极反应式
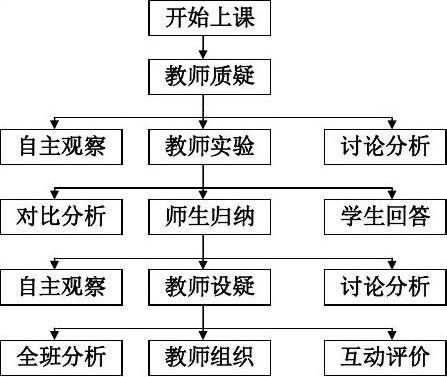
三、学环节设计
化学是一门以实验为主的学科,教师课堂演示实验不仅仅是为了让学生看清楚实验现象,还要教给学生如何根据实验现象去思考分析从而得出结论,进而总结出相关规律。这种能力要求才是化学实验教学真正要达到的目的。
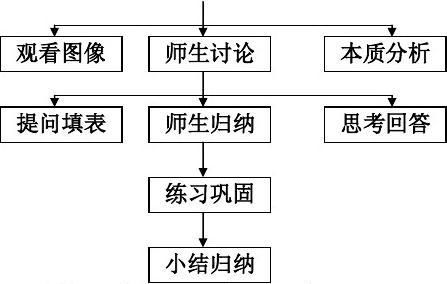
1、设疑讨论 激发兴趣
利用学过的金属的有关性质设疑让学生讨论铜和铁分别浸入稀硫酸中应该看到什么现象,如果用导线把二者连接起来又将看到什么现象,然后做实验验证学生的预测是否正确,再设疑为什么会出现这一现象,引入新课。这样层层深入,既引起了学生的兴趣,又激发学生强烈的求知欲,利于教学的进行。
2、实验引探 讨论分析
教学中要真正还学生的主体地位,必须是在教师引导下的学生自主学习。因此教师在实行新课教学时,要边操作实验边提出一系列的思考题让学生观察现象思考回答。这样引导学生探索学习,有利于学生理解知识的本质。然后教师进行归纳点评,强调
重点。
3、总结归纳 巩固强化
通过对实验结果的分析讨论,师生共同对知识进行归纳得出原电池的电极反应规,外电路电流方向,形成原电池的条件等重点知识框架,然后进行练习巩固,强化掌握。
四、教学过程设计
(引入)前面我们学习了有关金属的知识,了解了铁和铜的性质,铁是比较活泼的金属,能与稀H2SO4反应放出H2,铜是不活泼金属,与稀H2SO4不反应。如果我们把铁和铜连接起来,同时放入H2SO4中,会发生什么现象呢?下面我们来做这个实验。
[演示实验4—14]在烧杯中加入20mol稀H2SO4。将铁丝和铜丝分别浸入其中。观察现象;将铁丝和铜丝连在一起,再浸入稀H2SO4,观察现象。
(提问)有什么现象?
(学生回答)铁丝与稀H2SO4反应放出H2,铜丝不反应,铁丝和铜丝连起来放入稀H2SO4中,铁丝溶解但不放H2,铜丝上面放H2。
(讲述)为什么会这样呢?原来铁丝和铜丝连接插入稀H2SO4构成了一个原电池。下面我们就来研究原电池。
(板书) 第四节 原电池原理及其应用
一、原电池
[演示实验4—15]把一块锌片和一块铜片平行地插入盛有稀H2SO4的烧杯中,观察现象。再用导线把锌片和铜片连接起来观察现象。在导线中间接入电流计,观察指针是否偏转,用干电池对照判断电流方向。
(讲述)认真观察实验现象,回答下列问题:
(投影问题)
1、锌和铜片分别插入稀H2SO4中,有什么现象?
2、锌片和铜片用导线连接后插入稀H2SO4中,铜片上为什么
有气泡产生?
3、锌片的质量有无变化?溶液中(CH)如何变化?
4、写出铜片和锌片上变化的离子方程式。
5、电子流动的方向如何?
(学生讨论)
(教师小结)
铜片、锌片分别插入稀H2SO4中:铜片不反应,锌片直接与稀H2SO4发生置换反应:Zn+2H=Zn+H2↑
铜片、锌片相连插入稀H2SO4中,构成了原电池:
锌片:Zn-2e=Zn(氧化反应)
铜片:2H+2e=H2↑(还原反应)
电子:Zn→Cu
在铜片上,溶液中的H+得到电子被还原成H2,溶液中H+减少,锌片由于反应而不断减少,外电路上有电流产生,锌片相当于负极,铜片相当于正极。
(讲述)我们知道,物质发生反应时,常伴随有化学能与热能,光能的相互转化,例如:镁条在空气中燃烧,伴随有发光、放热现象,就是化学能转化为热能和光能。植物的光合作用就是将光能转化为化学能。那么我们做的实验是化学能转化为什么能呢?
(学生 回答)
(教师小结)
(板书)1、原电池:将化学能转化为电能的装置。
(讲述)早在1799年,意大利物理学家伏打发现了这一规律,发明世界上第一个原电池——伏打电池。
(观看课件)模拟原电池两极的氧化还原反应。
(投影)(学生填写下表)
+2++2++
(思考)原电池的两极材料如何选择呢?
(学生讨论)
(学生阅读)阅读课本,填写下表
(投影)(学生填写)

(投影)下面我们再做几个实验共同探讨一下原电池的组成条件和原理。
(设疑)(教师提出)
1、哪些装置可以形成原电池,哪些不能?
2、指出可形成原电池的正极反应和负极反应。
3、电子的流向如何?
(学生讨论)(回答A、B、C可形成原电池)
(教师小结)
(板书)2、组成原电池的条件:
(1)有两种活性不同的金属(或一种为非金属导体)作电极。
(2)电极材料均插入电解质溶液中。
(3)两极相连形成闭合回路。
3、原电池原理:
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)。 流向较不活泼的金属(正极)正极表面发生还原反应。
(设计实验)有锌片、铜片、橘子、PH试纸、电流计,请同学们分析一下能否组成原电池,并亲手设计一个原电池。
(讲述)在家中我们可以用水、马铃薯等及碱水、盐水做电解质溶液,用两片不同的金属和一些导线就可以构成原电池。大家可以试着去做。
(练习)(投影)
1、X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池负极,则X、Y、Z三种金属的活动性顺序为( )
A、X>Y>Z B、X>Z>Y C、Y>X>Z D、Y>Z>X
2、下列方法可以加快铁与稀H2SO4反应速率的是( )
A、加入少量ZnCl2 B、加入少量CuSO4
C、加热 D、增大压强
3、把两根铁棒用导线连起来,插入稀H2SO4中有何现象?外电路中有无电流?为什么?
(小结)按板书内容,小结重点、难点。
(作业)课本P×××页一、1、3、4 二、2、3 附:探究内容:
调查常用电池的种类,使用范围,性能和价格以及电池中的氧化剂和还原剂。调查废旧电池是如何处理的以及回收废旧电池的意义和价值。
方法:调查走访,查找资料,撰写论文。
五、学法设计
科学有效的学习方法,对于提高学生学习效率起着重要的作用。针对本节教材,教师引导学生采用不同的学习方法。
1、对比分析法:
学生通过对铜和铁分别放入酸中现象不同的对比分析,结合
铜、铁相继放入酸中的现象对比,得出铜锌相连与不相连 时反应规律不同结论。通过对锌、铜原电池实验各种现象的对比分析得出原电池的反应原理及定义。通过钢铁在潮湿空气中易腐蚀与在干燥环境中不易腐蚀的对比分析找出腐蚀原因。进而得出防腐蚀的具体措施,对比分析得出结论,有理有据,直观明了学生对知识易于接受。
2、实验探究法:
本节所有现象,结论都是通过具体实验得出的,所以实验探究法成为中心学法,学生通过现象观察分析,回答老师提出的有关讨论题,一步一步得出规律,知识接受过程自然流畅,理解深刻。
3、自学讨论法:
教材从图片、漫画、资料、家庭小实验、研究性学习课题、阅读资料等多种形式编排,内容丰富,可读性、趣味性强,教师设置了系列阅读提纲(问题)。指导学生阅读,讨论、分析从而得出结论。同时指导学生通过查找资料,阅读相关书籍、杂志、报纸等。拓宽知识视野,形成良好自学习惯和能力。
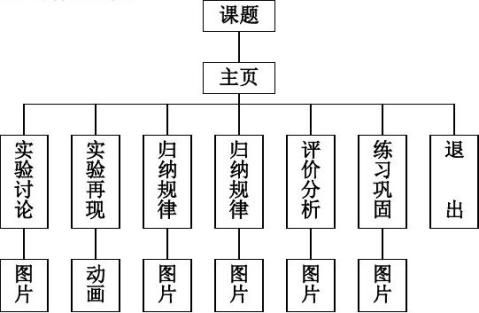
六、教学多媒体设计
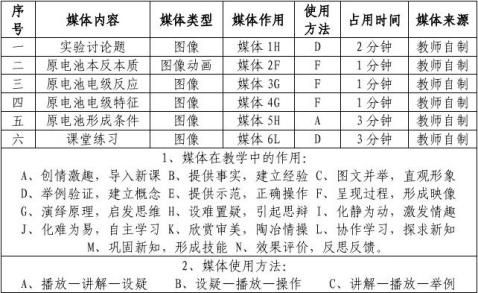

七、教学板书设计
原电池原理及其应用
1、原电池原理:
⑴置换反应:Zn+H=Zn+H2
⑵原电池反应:铜锌原电池
负极: Zn-2e=Zn (氧化反应)
正极: 2H+2e=H2 (还原反应)
电子流向:1、原电池:将化学能转化成电能的装置; 1799年,伏打电池。
2、组成原电池的条件:
⑴有两种活泼性不同的金属(或一种为非金属导体)做电极; ⑵电极材料均插入电解质溶液;
⑶两极相连形成闭和回路;
4、原电池原理:
较活泼金属负极
较不活泼金属还原反应
八、教学流程图
+2++2+
-
原电池教学反思
原电池教学反思海南侨中化学组邓灵玲原电池是把电能转化为化学能的一种装置也是化学与能源相联系的很关键的内容这些知识不但能让学生大开眼…
-
教学反思-原电池
41原电池教学反思旬阳中学张金娟本节课是人们教育出版社普通高中课程标准实验教科书选修4化学反应原理第四章第一节的内容主要研究化学能…
-
《原电池原理》的教学设计及反思
原电池原理的教学设计及反思童恬汕尾市汕尾市城区田家炳中学教学目标一知识与技能1了解原电池的工作原理原电池的构成条件并能设计简单的原…
-
关于“原电池的原理及应用”的教学反思
关于化学能和电能的教学反思原电池原理及其应用在新老教材的教学中教学方法和学习方式都有很大的变化通过多次探索和实践我对于本节内容的教…
-
原电池教学反思
关于原电池的原理及应用教学反思教学过程原述通过铜锌原电池的演示实验及动画演示电子流动情况帮助学生理解原电池的原理我考虑到学生的知识…
-
高中化学原电池教案
高中化学原电池教案化学化工学院09化师0913010055叶嘉欣学科化学课题化学能与电能课型理论课课时一节课45分钟教学目的1了解…
-
高中化学_原电池原理及其应用_教学案例评析
原电池教学设计案例分析及反思化学组许宁一教材分析本节内容是电化学中的重要知识第一课时的主要内容有原电池的概念原理组成原电池的条件原…
-
《原电池原理》的教学设计及反思
原电池原理的教学设计及反思童恬汕尾市汕尾市城区田家炳中学教学目标一知识与技能1了解原电池的工作原理原电池的构成条件并能设计简单的原…
-
选修4 第四章 第一节《原电池》教学反思
选修4第四章第一节原电池教学反思本节课是人们教育出版社普通高中课程标准实验教科书选修4化学反应原理第四章第一节的内容主要研究化学能…
-
《元素的性质与原子结构》教学反思
元素的性质与原子结构教学反思本节课主要由碱金属元素和卤族元素的性质的相似性和递变性的研究进而得出同主族元素性质的相似性和递变性的性…