《质量守恒定律》教学案例与教学反思
《质量守恒定律》教学案例与教学反思
化学组
导学目标:
1、 理解质量守恒定律和守恒的原因;
2、 通过对质量守恒原因的分析,培养学生的研究问题能力和逻辑的推理能力;
3、 培养学生勤于思考、严谨务实、勇于实践、不断创新的科学精神。
导学重难点:
通过实验怎样认识质量守恒定律。
导学设计:
通过两个化学的文字表达式入手,引导学生去分析和讨论反应的前后物质的质量有什么变化,然后用探究活动的步骤一步一步的去证明化学反应的前后物质的质量确实没有发生变化,从而导出质量守恒定律。
教具准备:
12个托盘天平(带砝码)、烧杯12个、小试管12个、药匙3个、瓶硫酸铜溶液、铁钉数颗、氢氧化钠溶液、碳酸钠粉末固体、盐酸。
教学过程:
(复习回顾):
1、写出下列反应的文字表达式:
(1)、红磷在氧气中的燃烧;
(2)、过氧化氢制氧气:
(可以指定一个学生在黑板上板书出来,其他的同学将其完成在草稿纸上。)
引导:这些反应式反映出的反应物在一定的条件下转变为性质不同的新的生成物,可以看出参加反应的是什么物质,生成的是什么物质,表示出在化学反应中质的变化,但是物质的总量有没有变化呢?在化学反应中反应物的质量同生成物的质量之间存在什么关系呢?(发现问题)
学生讨论并回答问题:
(1)、化学反应中反应物的质量等于生成物的质量。
(2)、化学反应中反应物的质量不等于生成物的质量。(做出假设)
好!同学们都有自己的观点,那么到底谁才是胜利者呢?下面我们通过实验来研究这一问题:怎样来设计一个实验证明我们的观点呢?
学生自己设计实验(从课本的90~93页的实验入手,根据所给的实验仪器设计实验,老师也要从旁指导)。
方案一:先在小烧杯中加入5mL氢氧化钠溶液,后在小试管中加入5mL硫酸铜溶液,正放入小烧杯中,将盛有氢氧化钠溶液和小试管的烧杯放在天平上称量,记录所称的质量M1。
将氢氧化钠溶液倾到入硫酸铜溶液中,观察实验现象,待反应一段时间后有沉淀生成时,将盛有混合溶液和小试管再称量一次,记录所称的质量M2,比较反应前后的质量。
方案二:先在小烧杯中加入5mL碳酸钠粉末,后在小试管中加入5mL盐酸,正放入小烧杯中,将盛有碳酸钠粉末和小试管的烧杯放在天平上称量,记录所称的质量M1。
将盐酸倾到入盛有碳酸纳的烧杯中,观察实验现象,待反应一段时间后,将盛有混合溶液和小试管再称量一次,记录所称的质量M2,比较反应前后的质量。
(老师设计)方案三:在小试管中加入5mL硫酸铜溶液,正放入小烧杯中,然后将几颗铁钉用砂纸打磨干净,放如小烧杯中,将盛有铁钉和小试管的烧杯放在天平上称量,记录所称的质量M1。
将铁钉浸到硫酸铜溶液中,观察实验现象,待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和铁钉再称量一次,记录所称的质量M2,比较反应前后的质量。
(设计实验)
好!同学们设计的实验都很好!都能证明我们的猜想吗?下面就请同学们完成自己的实验并记录,看看该实验能不能证明你的猜想。做完之后请每一组选派一个代表来回答你们组所得到的结果。
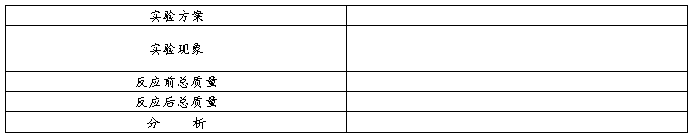
(实施实验并记录)
方案一代表:我们发现两中溶液混合时产生了蓝色的浑浊,并且天平仍然保持平衡,所以我们组证明了化学反应中反应物的质量等于生成物的质量。
方案二代表:我们发现将盐酸倒如烧杯时有许多的气泡生成,同时天平不再保持平衡,且反应物的质量要大于生成物的质量,所以我们组证明化学反应中反应物的质量不等于生成物的质量
方案三代表:我们发现铁钉的表面变成了红色,溶液变成了浅绿色,同时天平仍然保持平衡,所以我们组的证明了化学反应中反应物的质量等于生成物的质量。
(分析)
好!同学们做的都非常的出色,我们在实验中又发现了一个问题,有的实验能证明化学反应中反应物的质量等于生成物的质量,但是有的实验确证明化学反应中反应物的质量不等于生成物的质量,那么同学们对这个问题有什么看法呢?下面请按我们划分的小组进行讨论。
学生试着讨论,总结出化学变化中质量的变化。
老师提示:(请同学们联系我们从微观方面所讲的化学变化的实质,想想化学变化中质量究竟有什么样的关系。)
学生汇报:
学生甲:我们组发现在方案三中有气体生成了,产生的气体逸到空气中去,使的我们无法测量他们的重量。
学生乙:我们通过联系以前的知识,得知,化学反应的实质就是分子破裂,原子重新组合成新的分子的过程,从这里我们得知原子的种类、数量、性质在化学变化中并没有发生变化,既然反应前后原子没有发生变化,反应前后原子的总质量也应该没有发生变化,所以我们确定化学反应中反应物的质量等于生成物的质量
……
好!同学们回答的都很好。那么经过我们的讨论,我们知道了这样一个规律:参加化学反应的各物质的质量总和,等于反应后生成的个物质的质量总和。这个规律也就是质量守恒定律。
(得出结论)
通过对化学反应前后质量是否发生变化的探讨,你有哪些收获?
学生总结:……
总结:通过今天的学习,每个同学都有不同程度的收获,同时也发现了自己的不足,在今后的学习中相信大家回做的更好。
教学反思
《质量守恒定律》是初中化学教学中的一条重要规律。本节的知识将贯穿学生学习化学的始终。因此它的学习与教学显得犹为重要。
新的化学课程倡导从学生和社会发展的需要出发,发挥学科自制的优势,将科学探究作为课程改革的突破口,激发学生的主动性和创新意识,促使学生积极主动地学习,使获得化学知识和技能的过程也成为理解化学、进行科学探究、联系社会生活实际和形成科学价值观的过程。
这节课我的教学目标是“通过实验使学生理解质量守恒定律的含义及原因,能应用它解释一些简单的实验事实。”更重要的是培养学生应用实验的方法来定量研究问题、分析问题的能力。这也是化学教学中要向学生逐步传输的一种重要思想。
本节课的学习我将探究学习的方式引入课堂,让学生在与新知识的学习有关的情境中发现问题、做出假设、制定方案、实施方案并记录、得出结论、交流分享,突出了探究学习的过程体验和探究学习方法的运用;课堂学习中我自己认为教师的角色转换比较到位,教师充当了一名组织、引导者、交流的伙伴,使课堂学习在一种民主、平等的氛围中进行,做到了师生、生生互动,达到了一种师生情感交融、言语共鸣、思维共振的境界。
本节内容是一节承上启下的章节,位置很重要,所以在这一节学习以前,我以前面所学的文字表达式为基础,引导学生进入课堂来。首先我提出问题:“同学们还记得我们是怎么样来表示化学反应的吗?”学生们不约而同的回答到:“文字表达式。”我心理暗喜,一个好的开头,于是继续说到:“那么你们还记得我们所讲过的文字表达式吗?”这次回答没有上次整齐:“记得!”
“好,那么接下来我想请两位同学来听写听写我们的文字表达式,有没有哪一位同学愿意上来写一下啊?”
我问完了之后,学生们好多都立即低下了头,因为他们可能没有记住,但是我没有气馁,给一位有上来一试的学生一个眼神的鼓励,但是因为可能是胆量很小,所以最后她还是没有站起来,最后为了给它一次机会,我点了她起来。最后写的虽然不是很如意,就是有一个反应的生成物的名称写错了。
接下来我继续引导他们,从这个化学反应的文字表达式,我们能从中间获得什么信息呢,学生说出了反应物和生成物以及反应的条件,我及时鼓励:“对!大家说的很对,这个反应式告诉了我们一个化学反应以及反应物、反应条件和生成物。”
“但是大家有没有想过反应物和生成物的质量关系呢?它们之间有什么关系呢?”
这时,学生分成了两面派,有的同学说反应物和生成物的质量应该是相等的,但是其他的同学却说反应物和生成物的质量应该是不相等的。于是我又及时的鼓励他们发挥自己的想象:“你怎样来证明你的实验结果呢?如果老师给你们NaOH溶液和CuSO4溶液或者碳酸钠和盐酸溶液,仪器自选,你能设计一个实验证明我们自己的观点吗?”
“能!”学生回答的很积极。于是我给他们5分钟让他们设计自己的实验。
学生汇报自己的设计,这时我就补充他们做的不足的地方。“下面我们就按照你们自己设计的实验分组做实验,没有设计出来的同学一组,老师给你们准备了一组实验,你们来和老师一起做一下,看老师设计的实验能证明什么观点。做完之后,每一组推选一个人出来汇报自己的实验结果。”
学生动手做实验,老师从旁指导,补充他们做的不好的地方。做完之后,学生自己汇报自己的实验结果。老师再从他们没有想到的地方进行补充。
最后总结:“同学们说的都很好,分析的都很透彻,特别是第二组的同学做的最好,他们分析了天平前后不平衡的原因可能是因为产生了气体的缘故。其实,我们可以从化学反应的微观实质上看,化学反应就是原子的重新再组合,整个过程中原子没有发生变化,所以我们也可以确定化学反应前后,其质量是不变的。当然其它组做的也很好,他们直接证明了化学反应前后,反应物的质量和生成物的质量是相等的。这就是我们今天要学习的重要内容——质量守恒定律。”
板书质量守恒定律的定义。
“通过今天的学习,每个同学都有不同程度的收获,同时也发现了自己的不足,在今后的学习中相信大家会做的更好。”
现在回想起这节课,我觉得自己说的并不多,我把许多时间留给了学生,学生发挥的余地较广,从理解的程度上看学生的学习效果还不错。于是我在思考一个问题:是不是可以把这节课的形式推广应用到其它章节的教学中呢?只有这样才能让学生真正成为学习的主人。在今后的教学中我会去努力尝试的!
第二篇:质量守恒定律教学反思

-
对质量守恒定律的教学反思
对质量守恒定律的教学反思巴彦淖尔市第二中学卢海军这节课我首先提问1从宏观角度看化学变化的特征是什么2从微观角度看化学反应的本质是什…
-
《质量守恒定律》教学反思
质量守恒定律教学反思揭勒英本节课通过展示两个熟悉的化学反应现象的图片归纳出前阶段所学习的是化学反应的质变趁势引入本节课的重点量变通…
-
质量守恒定律的教学反思
质量守恒定律的教学反思质量守恒定律主要内容和目标是引导学生探究质量守恒定律理解质量守恒定律的微观解释以及能运用质量守恒定律进行相关…
-
质量守恒定律教学反思
质量守恒定律教学反思在十一月八号这天师大的老师来到我们实习中学看望我们并且听了我们讲的课王老师听得我的质量守恒定律这节课在课后我的…
- 质量守恒定律教学反思
-
《质量守恒定律》教学反思
质量守恒定律教学反思揭勒英本节课通过展示两个熟悉的化学反应现象的图片归纳出前阶段所学习的是化学反应的质变趁势引入本节课的重点量变通…
-
《质量守恒定律》教学反思
质量守恒定律教学反思双枫中学刘骐玮质量守恒定律是初中化学中的重要定律学习这一定律应注意三点第一点要重视实验从观察白磷燃烧和氢氧化钠…
-
《质量守恒定律》教学反思
质量守恒定律教学反思宁城汐子中学李学林质量守恒定律是初中化学中的重要定律是学习化学计算的基础和核心对质量守恒定律的正确理解和运用是…
-
对质量守恒定律的教学反思
对质量守恒定律的教学反思巴彦淖尔市第二中学卢海军这节课我首先提问1从宏观角度看化学变化的特征是什么2从微观角度看化学反应的本质是什…
-
质量守恒定律的教学反思
质量守恒定律的教学反思质量守恒定律主要内容和目标是引导学生探究质量守恒定律理解质量守恒定律的微观解释以及能运用质量守恒定律进行相关…