人教版化学必修一总结
高一化学模块I主要知识及化学方程式
一、研究物质性质的方法和程序
1.基本方法:观察法、实验法、分类法、比较法
2.基本程序:
第三步:用比较的方法对观察到的现象进行分析、综合、推论,概括出结论。
二、钠及其化合物的性质:
1.钠在空气中缓慢氧化:4Na+O2==2Na2O
2.钠在空气中燃烧:2Na+O2点燃====Na2O2
3.钠与水反应:2Na+2H2O=2NaOH+H2↑
现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
4.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑
5.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2
6.碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑
7.氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O
8.在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO3
三、氯及其化合物的性质
1.氯气与氢氧化钠的反应:Cl2+2NaOH=NaCl+NaClO+H2O
2.铁丝在氯气中燃烧:2Fe+3Cl2点燃===2FeCl3
3.制取漂白粉(氯气能通入石灰浆)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
4.氯气与水的反应:Cl2+H2O=HClO+HCl
5.次氯酸钠在空气中变质:NaClO+CO2+H2O=NaHCO3+HClO
6.次氯酸钙在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
四、以物质的量为中心的物理量关系
1.物质的量n(mol)= N/N(A)
2.物质的量n(mol)= m/M
3.标准状况下气体物质的量n(mol)= V/V(m)
4.溶液中溶质的物质的量n(mol)=cV
五、胶体:
1.定义:分散质粒子直径介于1~100nm之间的分散系。
2.胶体性质:
①丁达尔现象
②聚沉
③电泳
④布朗运动
3.胶体提纯:渗析
六、电解质和非电解质
1.定义:①条件:水溶液或熔融状态;②性质:能否导电;③物质类别:化合物。
2.强电解质:强酸、强碱、大多数盐;弱电解质:弱酸、弱碱、水等。
3.离子方程式的书写:
①写:写出化学方程式
②拆:将易溶、易电离的物质改写成离子形式,其它以化学式形式出现。
下列情况不拆:难溶物质、难电离物质(弱酸、弱碱、水等)、氧化物、HCO3-等。 ③删:将反应前后没有变化的离子符号删去。
④查:检查元素是否守恒、电荷是否守恒。
4.离子反应、离子共存问题:下列离子不能共存在同一溶液中:
①生成难溶物质的离子:如Ba2+与SO42-;Ag+与Cl-等
②生成气体或易挥发物质:如H+与CO32-、HCO3-、SO32-、S2-等;OH-与NH4+等。 ③生成难电离的物质(弱电解质)
④发生氧化还原反应:如:MnO4-与I-;H+、NO3-与Fe2+等
七、氧化还原反应
1.(某元素)降价——得到电子——被还原——作氧化剂——产物为还原产物
2.(某元素)升价——失去电子——被氧化——作还原剂——产物为氧化产物
3.氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
八、铁及其化合物性质
1. Fe2+及Fe3+离子的检验:
① Fe2+的检验:(浅绿色溶液)
a) 加氢氧化钠溶液,产生白色沉淀,继而变灰绿色,最后变红褐色。
b) 加KSCN溶液,不显红色,再滴加氯水,溶液显红色。
② Fe3+的检验:(黄色溶液)
a) 加氢氧化钠溶液,产生红褐色沉淀。
b) 加KSCN溶液,溶液显红色。
2.主要反应的化学方程式:
①铁与盐酸的反应:Fe+2HCl=FeCl2+H2↑
②铁与硫酸铜反应(湿法炼铜):Fe+CuSO4=FeSO4+Cu
③在氯化亚铁溶液中滴加氯水:(除去氯化铁中的氯化亚铁杂质)3FeCl2+Cl2=2FeCl3 ④氢氧化亚铁在空气中变质:4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑤在氯化铁溶液中加入铁粉:2FeCl3+Fe=3FeCl2
⑥铜与氯化铁反应(用氯化铁腐蚀铜电路板):2FeCl3+Cu=2FeCl2+CuCl2
⑦少量锌与氯化铁反应:Zn+2FeCl3=2FeCl2+ZnCl2
⑧足量锌与氯化铁反应:3Zn+2FeCl3=2Fe+3ZnCl2
九、氮及其化合物的性质
1. “雷雨发庄稼”涉及反应原理:
① N2+O2放电===2NO
② 2NO+O2=2NO2
③ 3NO2+H2O=2HNO3+NO
2.氨的工业制法:N2+3H2 2NH3
3.氨的实验室制法:
①原理:2NH4Cl+Ca(OH)2△==2NH3↑+CaCl2+2H2O
②装置:与制O2相同
③收集方法:向下排空气法
④检验方法:
a) 用湿润的红色石蕊试纸试验,会变蓝色。
b) 用沾有浓盐酸的玻璃棒靠近瓶口,有大量白烟产生。NH3+HCl=NH4Cl
⑤干燥方法:可用碱石灰或氧化钙、氢氧化钠,不能用浓硫酸。
4.氨与水的反应:NH3+H2O=NH3?H2O NH3?H2O NH4++OH-
5.氨的催化氧化:4NH3+5O2 4NO+6H2O(制取硝酸的第一步)
6.碳酸氢铵受热分解:NH4HCO3 NH3↑+H2O+CO2↑
7.铜与浓硝酸反应:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
8.铜与稀硝酸反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
9.碳与浓硝酸反应:C+4HNO3=CO2↑+4NO2↑+2H2O
10.氯化铵受热分解:NH4Cl NH3↑+HCl↑
十、硫及其化合物的性质
1.铁与硫蒸气反应:Fe+S△==FeS
2.铜与硫蒸气反应:2Cu+S△==Cu2S
3.硫与浓硫酸反应:S+2H2SO4(浓)△==3SO2↑+2H2O
4.二氧化硫与硫化氢反应:SO2+2H2S=3S↓+2H2O
5.铜与浓硫酸反应:Cu+2H2SO4△==CuSO4+SO2↑+2H2O
6.二氧化硫的催化氧化:2SO2+O2 2SO3
7.二氧化硫与氯水的反应:SO2+Cl2+2H2O=H2SO4+2HCl
8.二氧化硫与氢氧化钠反应:SO2+2NaOH=Na2SO3+H2O
9.硫化氢在充足的氧气中燃烧:2H2S+3O2点燃===2SO2+2H2O
10.硫化氢在不充足的氧气中燃烧:2H2S+O2点燃===2S+2H2O
十一、镁及其化合物的性质
1.在空气中点燃镁条:2Mg+O2点燃===2MgO
2.在氮气中点燃镁条:3Mg+N2点燃===Mg3N2
3.在二氧化碳中点燃镁条:2Mg+CO2点燃===2MgO+C
4.在氯气中点燃镁条:Mg+Cl2点燃===MgCl2
5.海水中提取镁涉及反应:
①贝壳煅烧制取熟石灰:CaCO3高温===CaO+CO2↑ CaO+H2O=Ca(OH)2 ②产生氢氧化镁沉淀:Mg2++2OH-=Mg(OH)2↓
③氢氧化镁转化为氯化镁:Mg(OH)2+2HCl=MgCl2+2H2O
④电解熔融氯化镁:MgCl2通电===Mg+Cl2↑
十二、Cl-、Br-、I-离子鉴别:
1.分别滴加AgNO3和稀硝酸,产生白色沉淀的为Cl-;产生浅黄色沉淀的为Br-;产生黄色沉淀的为I-
2.分别滴加氯水,再加入少量四氯化碳,振荡,下层溶液为无色的是Cl-;下层溶液为橙红色的为Br-;下层溶液为紫红色的为I-。
十三、常见物质俗名
①苏打、纯碱:Na2CO3;②小苏打:NaHCO3;③熟石灰:Ca(OH)2;④生石灰:CaO;⑤绿矾:FeSO4?7H2O;⑥硫磺:S;⑦大理石、石灰石主要成分:CaCO3;⑧胆矾:CuSO4?5H2O;⑨石膏:CaSO4?2H2O;⑩明矾:KAl(SO4)2?12H2O
十四、铝及其化合物的性质
1.铝与盐酸的反应:2Al+6HCl=2AlCl3+3H2↑
2.铝与强碱的反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
3.铝在空气中氧化:4Al+3O2==2Al2O3
4.氧化铝与酸反应:Al2O3+6HCl=2AlCl3+3H2O
5.氧化铝与强碱反应:Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
6.氢氧化铝与强酸反应:Al(OH)3+3HCl=AlCl3+3H2O
7.氢氧化铝与强碱反应:Al(OH)3+NaOH=Na[Al(OH)4]
8.实验室制取氢氧化铝沉淀:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
十五、硅及及其化合物性质
1.硅与氢氧化钠反应:Si+2NaOH+H2O=Na2SiO3+2H2↑
2.硅与氢氟酸反应:Si+4HF=SiF4+H2↑
3.二氧化硅与氢氧化钠反应:SiO2+2NaOH=Na2SiO3+H2O
4.二氧化硅与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O
5.制造玻璃主要反应:SiO2+CaCO3高温===CaSiO3+CO2↑ SiO2+Na2CO3高温===Na2SiO3+CO2↑
第二篇:人教版数学必修五知识点总结
第一章解三角形
1、内角和定理:(1)三角形三角和为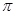 ,任意两角和与第三个角总互补,任意两半角和与第三个角的半角总互余.(2)锐角三角形
,任意两角和与第三个角总互补,任意两半角和与第三个角的半角总互余.(2)锐角三角形 三内角都是锐角
三内角都是锐角 三内角的余弦值为正值
三内角的余弦值为正值 任两角和都是钝角
任两角和都是钝角 任意两边的平方和大于第三边的平方.
任意两边的平方和大于第三边的平方.
2、正弦定理: (R为三角形外接圆的半径).
(R为三角形外接圆的半径).

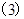 解三角形:已知三角形的几个元素求另外几个元素的过程。
解三角形:已知三角形的几个元素求另外几个元素的过程。

注意:已知两边一对角,求解三角形,若用正弦定理,则务必注意可能有两解.
3、余弦定理: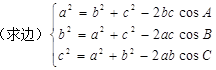 或 (求角)
或 (求角)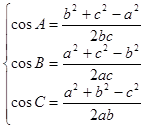
 (注:常用余弦定理鉴定三角形的类型).
(注:常用余弦定理鉴定三角形的类型).
4、三角形面积公式: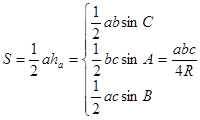 .
.
5、解三角形应用
(1)在视线和水平线所成的角中,视线在水平线上方的角叫仰角;视线在水平线下方的角叫俯角。
(2)从正北方向顺时针转到目标方向的水平角叫方位角。
(3)坡面与水平面所成的二面角度数的正切值叫做坡度。
(4)解斜三角形应用题的一般步骤:
分析→建模→求解→检验
第二章数 列
1.数列的通项、数列的项数,递推公式与递推数列,数列的通项与数列的前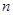 项和公式的关系:
项和公式的关系: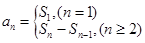 (必要时请分类讨论).
(必要时请分类讨论).
注意: ;
;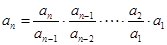 .
.
2.等差数列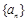 中:
中:
(1)等差数列公差的取值与等差数列的单调性.

(2)
 ;
;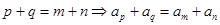 .
.
(3)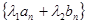 、
、 也成等差数列.
也成等差数列.
(4)在等差数列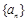 中,若
中,若
(5) 仍成等差数列.
仍成等差数列.
(6)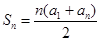 ,
, ,
,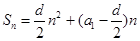 ,
,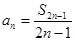 ,。
,。 
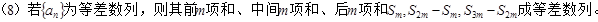
(9)“首正”的递减等差数列中,前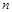 项和的最大值是所有非负项之和;
项和的最大值是所有非负项之和;
“首负”的递增等差数列中,前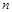 项和的最小值是所有非正项之和;
项和的最小值是所有非正项之和;
(10)两数的等差中项惟一存在.在遇到三数或四数成等差数列时,常考虑选用“中项关系”转化求解.
(11)判定数列是否是等差数列的主要方法有:定义法、中项法、通项法、和式法、图像法(也就是说数列是等差数列的充要条件主要有这五种形式).
3.等比数列 中:
中:
(1)等比数列的符号特征(全正或全负或一正一负),等比数列的首项、公比与等比数列的单调性.
(2)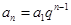
 ;
; 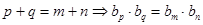 .
.
(3) 成等比数列
成等比数列 、
、 、
、
 ,
, 成等比数列.
成等比数列.
(4) 成等比数列.
成等比数列.
(5) .
.
特别: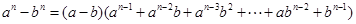 .
.

(7)“首大于1”的正值递减等比数列中,前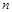 项积的最大值是所有大于或等于1的项的积;“首小于1”的正值递增等比数列中,前
项积的最大值是所有大于或等于1的项的积;“首小于1”的正值递增等比数列中,前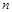 项积的最小值是所有小于或等于1的项的积;
项积的最小值是所有小于或等于1的项的积;
(8)有限等比数列中,若总项数为偶数,则“偶数项和”=“奇数项和”与“公比”的积;若总项数为奇数,则“奇数项和”=“首项”加上“公比”与“偶数项和”积的和.
(9)等比中项要么不存在,要么仅当实数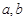 同号时存在,且必有一对
同号时存在,且必有一对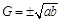 .
.
(10)判定是否是等比数列的方法:定义法、中项法、通项法、和式法。
4.等差数列与等比数列的联系
(1)如果数列 成等差数列,那么数列
成等差数列,那么数列 (
( 总有意义)必成等比数列.
总有意义)必成等比数列.
(2)如果数列 成等比数列,那么数列
成等比数列,那么数列 必成等差数列.
必成等差数列.
(3)如果数列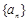 既成等差又成等比,那么数列
既成等差又成等比,那么数列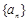 是非零常数数列;但反之不成立。
是非零常数数列;但反之不成立。
(4)如果两等差数列有公共项,那么由他们的公共项顺次组成的新数列也是等差数列,
5.数列求和的常用方法:
(1)公式法:①等差数列求和公式(三种形式),
②等比数列求和公式(三种形式),
③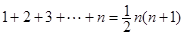 ,
,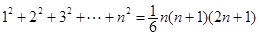 ,
, ,
,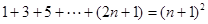 .
.
(2)分组求和法:常将“和式”中“同类项”先合并在一起,再运用公式法求和.
(3)倒序相加法;(4)错位相减法;
(5)裂项相消法: ① , ②
, ②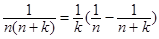 ,
,
特别声明:L运用等比数列求和公式,务必检查公比与1的关系,必要时分类讨论.
三、不等式
1.(1)求不等式的解集,务必用集合的形式表示;不等式解集的端点值往往是不等式对应方程的根或不等式有意义范围的端点值.
(2)解分式不等式 (移项通分,等价为分子分母相乘大于或小于0);
(移项通分,等价为分子分母相乘大于或小于0);
(3)含有两个绝对值的不等式(一般是根据定义分类讨论、平方转化或换元转化);
(4)解含参不等式常分类等价转化,必要时需分类讨论.注意:按参数讨论,最后按参数取值分别说明其解集,但若按未知数讨论,最后应求并集.
2.利用重要不等式 以及变式
以及变式 等求函数的最值时,务必注意a,b
等求函数的最值时,务必注意a,b ,且“等号成立”时的条件是积ab或和a+b其中之一应是定值(一正二定三相等).
,且“等号成立”时的条件是积ab或和a+b其中之一应是定值(一正二定三相等).
3.常用不等式: (根据目标不等式左右的运算结构选用)
(根据目标不等式左右的运算结构选用)
a、b、c R,
R, (当且仅当
(当且仅当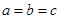 时,取等号)
时,取等号)
4.比较大小的方法和证明不等式的方法主要有:差比较法、商比较法、函数性质法、综合法、分析法
5.含绝对值不等式的性质:
 同号或有
同号或有

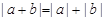
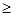
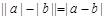 ;
;
 异号或有
异号或有

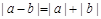
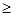
 .
.
6.不等式的恒成立问题
若不等式 在区间
在区间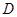 上恒成立,则等价于在区间
上恒成立,则等价于在区间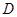 上
上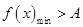
若不等式 在区间
在区间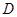 上恒成立,则等价于在区间
上恒成立,则等价于在区间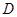 上
上
-
人教版高一化学必修一知识点总结
第一章从实验学化学一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简…
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
- 人教版高一化学必修一知识点总结
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
高一化学必修一第三章化学方程式总结
高一化学必修1化学方程式归纳小结一、钠及其化合物1.钠与氧气:常温:4Na+O2=2Na2O点燃:2Na+O22.钠与水反应:2N…
-
高一化学必修一总结(1)
一、物质的分类把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。被分散的物质称作分散质(可以是气体、液体、固…
-
化学必修一总结
化学必修一总结一、离子检验:1、氯离子:加硝酸银(AgNO3)有白色沉淀,加硝酸沉淀不溶解,则有氯离子。2、硫酸根:加可溶性钡盐(…
-
化学必修一总结
化学必修一第一章知识点总结一、化学实验安全1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)…
-
高一化学必修一知识点总结 2
一、物质的分类把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。被分散的物质称作分散质(可以是气体、液体、固…