篇一 :初中化学第一二单元知识点总结
第一单元 走进化学世界
基础知识回顾:
1.化学是研究物质的 以及其 的科学。学习化学的一个重要途径是 , 是科学探究的重要手段。
2.原子论和分子学说。 和 等科学家研究得出了一个重要结论:物质是由 和 构成的;分子的 和 的重新组合是化学变化的基础,即在化学变化中 会破裂,而 不会破裂,但可重新组合成新分子,即原子是参加化学变化的最小粒子。
…… …… 余下全文
篇二 :九年级化学四川第一二单元知识总结(精选版)
第一、二单元 知识总结
1.物理变化:没有生成其它物质的变化(物质的状态、形状可能发生变化,也可能有发光、发热等现象出现)如:木材做成桌椅、水变成冰、汽油挥发、夜晚的霓虹灯等
2.化学变化:生成了其他物质的变化(变化过程中常伴随有发光、发热、变色、放出气体、产生沉淀等现象发生)如:木炭燃烧、铁生锈、饭菜变馊、澄清石灰水通入二氧化碳后变浑浊等
3.区别:在变化中是否有新物质生成
4.联系:化学变化中一定同时发生物理变化,物理变化中一定不发生化学变化。
5.物理性质:物质不需要经过化学变化就可以表现出来的性质。
内容:颜色、状态、气味、熔点、沸点、硬度、溶解性、挥发性、导电导热性等
7.化学性质:物质在化学变化中表现出来的性质
内容:可燃性、还原性、氧化性、稳定性、毒性、灭火性等
8.常用的计量仪器-----托盘天平、量筒、胶头滴管
(1)托盘天平。称量时:左物右码;加砝码顺序:由大到小;精确度:0.1g
如果药品与砝码放反,则物体的实际质量=砝码的质量—游码的示数
(2)量筒。用于量取一定体积的液体药品 。使用方法:规格适当,平放,视线与凹液面最低处保持水平;若仰视则读数比实验值小,若俯视则读数比实际值大。
…… …… 余下全文
篇三 :初三化学第一、二单元知识小结
初三化学第一、二单元知识小结
第一单元 步入化学殿堂
【知识点一】天然材料与人造材料
天然材料主要指木材、石材、泥土、天然丝、麻、棉等自然界中本来就有的物质材料;人造材料是指人们利用科学手段生产出自然界原来并不存在的物质,,如塑料、玻璃、陶瓷、水泥、铝合金、人造纤维、
【知识点二】物质的变化和性质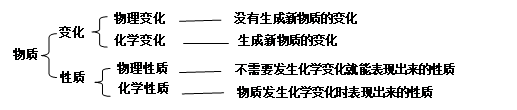

2、物理性质与化学性质
性质与变化的关系:性质决定变化。变化体现性质。一些物理性质如物质的颜色、形状、状态、密度、气味、味道等不需要发生任何变化就能表现出来。(描述性质的语句中常有“能、能够、可、可以、难、易、会”等关键词存在,表示物质具有某种能力。)
物理性质:色、态、味,易升华、挥发、熔点、沸点、硬度、导电性、导热性、延展性、溶解性、密度等。
化学性质:可燃性、助燃性、有毒性、腐蚀性、稳定性、酸性、碱性、氧化性、还原性等
【知识点三】课本中四个实验现象的观察、记录
(1) 镁带在空气中燃烧
实验现象:剧烈燃烧、发出耀眼的白光、放出热量、同时生成白色固体。
…… …… 余下全文
篇四 :化学必修2第一二章知识点总结
化学必修2第一二章知识点总结
★第一章
§第一节
1.元素周期表按照相对原子质量由大到小依次排列
2.化学性质相似的元素放在一个纵行
3.按照原子周期表中的顺序给元素编号,得到原子序数
5.原子序数=核电荷数=质子数=核外电子数2
6.元素周期表7个横行叫周期,每周期电子层数相同,左→右原子序数依次递增。周期序数=电子层数
7.第一(2)、二(8)、三(8)周期为短周期,其他周期为长周期
8.周期表有18个纵行.8、9、10叫第Ⅷ族,第ⅠA族(除H):碱金属元素,第ⅦA族:卤族元素,0族:稀有气体元素
9.碱金属元素与氧气、水的反应
4Li+O2=加热2Li2O
2Na+O2=加热Na2O2
2Na+2H2O=2NaOH+H2↑
2K+2H2O=2KOH+H2↑
10.碱金属元素除铯外,成银白色,比较柔软,有延展性,密度小(上→下↗),熔点低(上→下↘),导热、电性好
11.卤族元素由F2→I2颜色越来越深,密度逐渐增大,熔、沸点逐渐增高
12.卤族元素与氢气的反应
H2+F2=2HF
H2+Cl2=光照或点燃2HCl
H2+Br2=加热2HBr
H2+I2≈加热2HI
…… …… 余下全文
篇五 :人教版 初中化学一二单元知识点总结
第一章 开启化学之门
⑴物理变化:
同一种物质的三态变化(如:水结成冰);挥发(如:浓盐酸、浓氨水的挥发);蒸馏(如:分离液态空气制氧气、炼制石油);灯泡发光;活性炭、木炭的吸附作用;导电、导热;(蒸发或冷却)结晶等
⑵化学变化:
一切燃烧;光合作用、动植物的呼吸作用;金属生锈(氧化);炼钢、炼铁、煤的干馏;酸碱指示剂变色(如:紫色石蕊试液变红色);食物腐败、酒醋的酿造、农家肥的腐熟;生米煮成熟饭、衣服穿久了褪色,变质、腐蚀、中毒等
⑶不能确定是化学变化还是物理变化的:
爆炸(火药爆炸是化学变化,轮胎、蒸汽锅炉爆炸是物理变化),
石灰水变浑浊(通CO2变浑是化学变化,加热析出Ca(OH)2是物理变化)
⑷两种变化的关系:
①宏观区别:是否生成了新物质(或原物质是否改变了)
②微观区别:是否产生了新分子(或原分子是否改变了)
③联系:物质在发生化学变化时,一定同时有物理变化发生。
⑸碳酸氢铵(化学式NH4HCO3)受热易分解,要密封保存在阴凉处;
CO2和SO2都能使澄清的石灰水变浑浊,但SO2能使KMnO4溶液褪色而CO2不能。 绿色粉末碱式碳酸铜(俗称铜绿)加热后,①绿色粉末变成黑色,②管口出现小水滴,③石灰水变浑浊。
…… …… 余下全文
篇六 :化学选修4第一二章知识点总结
第一章 化学反应与能量
一、焓变(ΔH):反应热
1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量
2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应
(1).符号: △H(2).单位:kJ/mol
3.产生原因:化学键断裂——吸热 化学键形成——放热
放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0
吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0
☆ 常见的放热反应: ① 所有的燃烧反应 ② 酸碱中和反应
③ 大多数的化合反应 ④ 金属与酸的反应
⑤ 生石灰和水反应 ⑥ 浓硫酸稀释、氢氧化钠固体溶解等
…… …… 余下全文
篇七 :20xx九年级上化学第一二章总结复习文字表达式化学式
化学物质与化学式
? 铜绿、孔雀石主要成分:碱式碳酸铜(Cu2(OH)2CO3) ? 硫酸铜晶体(俗称胆矾或蓝矾):CuSO4 ? 氢氧化钠:NaOH 盐酸主要成分:HCl ? 氢氧化铜:Cu(OH)2 二氧化碳:CO2 ? 大理石(石灰石)主要成分:碳酸钙(CaCO3) ? 澄清石灰水只要成分:Ca(OH)2 氯化钙:CaCl2 ? 水:H2O 氧气:O2 氢气:H2 ? 氮气:N2 乙醇(俗称酒精):C2H5OH ? 汞(俗称水银)Hg 红磷:P ? 五氧化二磷:P2O5 二氧化硫:SO2
? 硫:S 木炭只要成分:C 四氧化三铁:Fe3O4 ? 铁:Fe 高锰酸钾:KMnO4 锰酸钾:K2MnO4 ? 二氧化锰:MnO2 氯酸钾:KClO3 氯化钾:KCl ? 过氧化氢溶液(俗称双氧水)主要成分:H2O2
文字表达式
? 石灰石与(稀)盐酸:
石灰石 + 盐酸 氯化钙 + 二氧化碳 + 水 注:读作石灰石与盐酸反应生成氯化钙、二氧化碳和水 ? 硫酸铜与氢氧化钠:
…… …… 余下全文
篇八 :高中化学必修一第一、二章知识点总结
必修一第一、二章总结
第一章
第一节主要知识点
1.化学危险品标志 (参考书P4图)
2.几种物质分离提纯方法
①过滤——“一贴,二低,三靠”,即滤纸紧贴漏斗内壁;滤纸边缘低于漏斗边缘,液面低于滤纸边缘;烧杯紧靠玻璃棒,玻璃棒紧靠三层滤纸处,漏斗下端紧靠烧杯内壁。
②蒸发——蒸发过程中需用玻璃棒不断搅拌,以防止局部过热使液体飞溅。当蒸发皿中产生大量固体时,停止加热,用余热蒸干剩余液体。
③蒸馏——利用两种液体沸点不同达到分离的目的。重要仪器:蒸馏烧瓶,冷凝管。冷凝管中的冷凝水应从下口进上口出。
④萃取——利用一种溶质在两种互不相溶的溶剂中的溶解度不同而分离。仪器:分液漏斗
萃取剂的选择:与原溶剂互不相溶,溶质在它里面的溶解度要大于在原溶液中的溶解度,与被萃取的物质不反应。
⑤分液——两种液体互不相溶,通过静置,分层使其分开。仪器,分液漏斗
3.除杂原则:不增,不减,容易分离,即不引入新的杂质离子,不消除应该保留的离子,加入的除杂剂与被除去的离子可以形成沉淀或气体等容易除去的物质。
…… …… 余下全文