篇一 :临床评价报告
医用骨科牵引床 临床评价报告
目 录
1、产品简介
2、预期用途
3、产品分类
4、临床资料评估
5、临床对比分析
6、临床资料评估结论
7、风险分析
8、相关文件
9、附件
一次性使用内窥镜手术冲吸导管临床评价报告
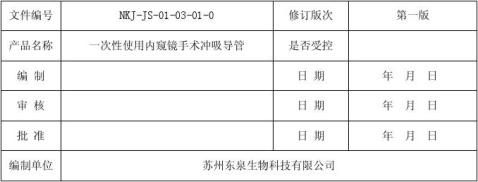
1、 产品简介
1.1本公司生产的一次性使用内窥镜手术冲吸导管是依据国食药监械【2009】835号《医疗器械生产质量管理规范无菌医疗器械实施细则》及YY 0489-2004 《 一次性使用无菌引流导管及辅助器械》,并结合国内外产品的优点而开发的产品。目前该产品已通过江苏省医疗器械检验所检测。
1.2一次性使用内窥镜手术冲吸导管主要用于主要用于内窥镜手术。
1.3一次性使用内窥镜手术冲吸导管由穿刺头、接头、截流夹、导管、阀体、阀门和不锈钢接管组成
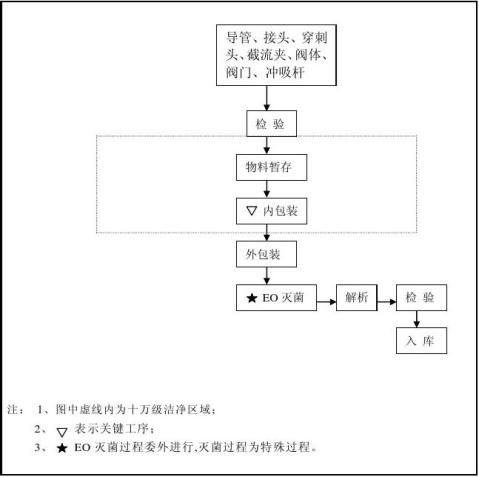
对以上关键过程和特殊过程,公司设置了质量控制点,做好各工序的检验记录进行控制。
1.5 产品在使用前已经灭菌,灭菌有效期为两年。
2、 预期用途
供临床冲洗引流用。
3、 产品分类
根据国家食品药品监督管理局《医疗器械分类管理目录》规定,一次性使用内窥镜手术冲吸导管属Ⅱ类医疗器械。
…… …… 余下全文
篇二 :临床评估报告模板
临床评估报告
(模板适用于设备)
文件编号:xxxxxxxx

编制:xxx
审核:xxx (需要有临床背景)
XXXXXXXXX有限公司
临床评价对象:(设备名称)
1. 临床使用情况的概述:
1.1 预期用途
1.2 基本结构
1.3 与其相配套的设施(如果有,包括连接接口的描述):
1.4 临床原理
3. 临床评价途径
EN ISO14155:2011Clinical investigation of medical devices for human subjects —
…… …… 余下全文
篇三 :MEDDEV 2.7.1 ver.3 临床评价报告样本(中文)
临床评价报告
数字X射线摄影系统: Xxxx 系列
编制:
批准:
1. 器械概述
产品名称:
产品型号:
制造商:
2. 器械及预期用途描述
2.1 预期用途: 数字X射线摄影系统,用于生成人体解剖组织的放射线图像。设计本系统的目的是在所有一般用途的诊断程序中替代放射线胶片/ 屏幕系统。本设备不用于乳腺X 射线成像应用。
2.2 器械描述: 按医用电气设备的安全分类属于Ⅰ类B型间歇加载连续运行固定式设备,诊断患者时人体与摄影床和探测器部分接触。
本X射线摄影系统功能组成有以下几部分构成。
3. 预期诊断适应症
本设备需要在隔离室内对需要诊断人体解剖组织的放射线图像的患者进行拍摄。不适用于乳腺X 射线成像应用。孕妇及儿童应遵守医师的诊断并了解放射拍片的危害。
…… …… 余下全文
篇四 :如何编写临床评估报告
如何编写临床评估报告
看到有些朋友对如何编写《临床评估报告》有些无所适从,写个清单,供朋友们参考吧,希望有所帮助。
临床评估报告
产品名称:XXXXX
1、介绍
(1)产品工作原理、适应症
(2)产品描述(若有多规格、型号产品)
(3)产品设计特点(若有)
2、咨询(若适用)
包括临床治疗或诊断前咨询、评估等。
3、禁忌症
4、临床经验
(1)产品适应症
逐个列出适应症,并进行详细描述(例如:工作原理、典型性参数、临床效果、统计结果等),可在描述中同时引用文献。
(2)并发症(若适用)
逐个列出并发症,并进行详细描述(例如:发生率、原因分析、处理方法及结果描述、统计结果等),可同时引用文献。
5、特别注意事项
临床时的特别注意事项,例如术前准备、术后护理、医生治疗时特别需要注意的部分等。
6、临床总结
如何基于上述信息,得出该产品是具有临床价值的(从安全性和有效性分析)。
7、临床文献
列出参考文献清单
…… …… 余下全文
篇五 :资料-7--临床评价报告模板
医疗器械临床评价报告
(资料-7)
XXXXXXXXXXX
临床评价报告
一、 概述
我公司(XXXXXXXX)研制开发的XXXXXXXXXXX供临床XXXXXXX用。
根据《医疗器械分类目录》的规定,XXXXXXXXXXX为 第二类注射穿刺器械,类别代号为:6815。目前国内已有多个同类产品注册上市,广泛应用多年,其临床上的安全性、有效性早已得到确认。
二、 产品设计
本产品XXXXXXXX。
三、 工作原理
XXXXXXXXXXX的工作原理是按无菌操作要求,撕开注射器单包装,去掉注射器保护套,抽取、溶解或配制药液用。
四、 市场概况
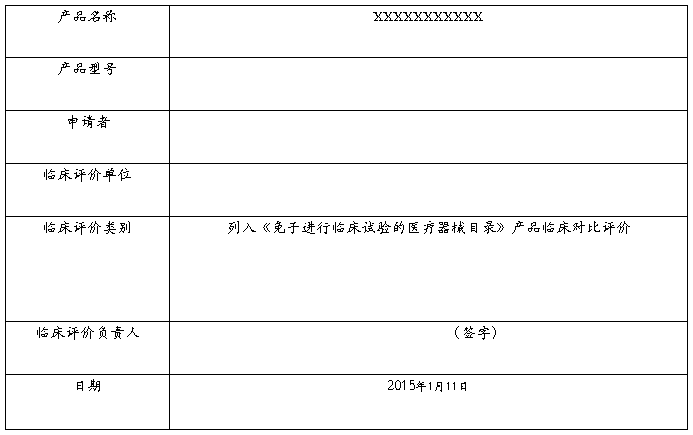
现在市场销售的同类产品主要有XXXXXXXXXXX等。这些产品在使用过程未发生过任何意外事故的报道;其中本公司的XXXXXXXXXXX产品与国内厂家工作原理基本相同。XXXXXXXXXXX为列入《免于进行临床试验的医疗器械目录》产品,现将申报产品与《目录》所述内容进行对比以判定申报产品是否为列入《目录》产品。
申报产品与《目录》产品的对比表
…… …… 余下全文
篇六 :Clinic Evaluation Report Template 临床评估报告模板
CLINICAL EVALUATION REPORT
临床评估报告
For Product: XXXX
产品:XXXX
Document No. XXXXXXXX
文件编号
Version: 1.0
版本:
Date: 20##-12-18
日期:
Author:
作者:
Reviewed by:
审阅:
Approved by:
批准:
<Company>
<公司>
Table of Content
目录
Page页码
1. General details总述... 3
2. Description of the device and its intended application器械描述和预期用途... 3
3. Intended therapeutic and/or diagnostic indications and claims 预期治疗和/或诊断说明和要求... 3
…… …… 余下全文
篇七 :新药临床试用评价报告
新药临床试用评价报告
根据临床科室提报新药需求,按我院药事管理规定,经药事管理委员会审批通过,于20xx年5月引进新药18种,并按规定对新引进品种进行3个月的临床试用观察。经过6至8月的临床试用,对本次引进新药情况分析如下:
本次引进的18个新药,均为湖北省统一招标目录中药品,我院医管科制定的采购价格及执行价格符合湖北省医疗机构网上药品集中采购平台相关规定。5月25日接到价格文件后药剂科发布新药试用信息, 6月1日临床科室试用,截止8月31日,采购及使用量见下表:
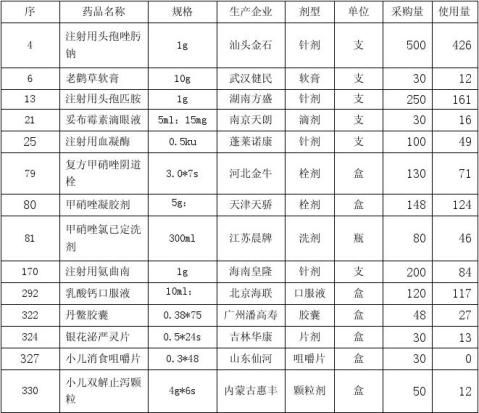
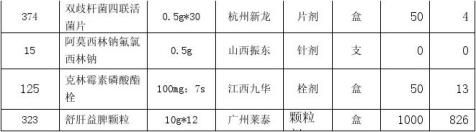
依据上列数据,注射用阿莫西林钠氟氯西林钠因在试用期未供货,请予淘汰。小儿消食咀嚼片3个月零销售,建议淘汰。双歧杆菌四联活菌片销售4盒,比较同类品种口服酪酸梭菌活菌散剂25盒、妈咪爱50盒,销售数量太小,考虑其有效期为18个月,建议少量采购,继续试用观察。
一、因本次引进品种较多,为便于分析,分3类讨论,首先是针剂,其中注射用阿莫西林钠氟氯西林钠未予配送,不予分析,其它品种具体情况如下:
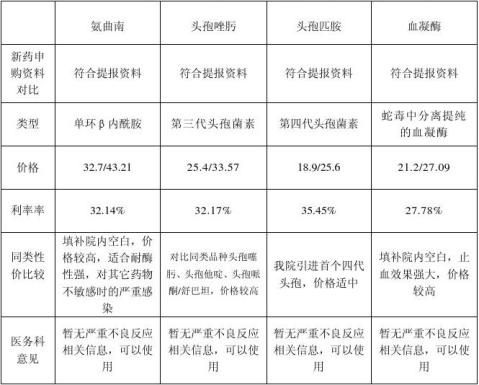
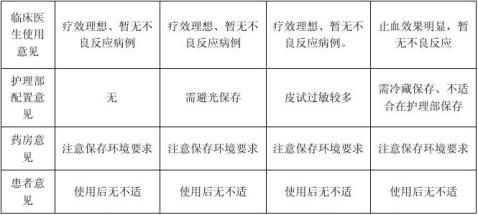
鉴于儿科护理部反映注射用头孢匹胺皮试阳性病例较多,查询相关文献资料,头孢类药物的安全性经历了长期临床检验,头孢类药物可以引起过敏反应,也有引起过敏性休克甚至死亡的报道,但一直公认是安全的药物。药典中明确规定了使用青霉素类药物之前要进行皮试,过敏者禁用;而并无头孢类药物进行皮试的规定。头孢类药物皮试阳性比率与头孢类药物不良反应比率无直接关联,但可以经济快速筛查出潜在过敏人群,有助于临床安全用药。统计儿科护理部6至8月皮试记录,并抽样临床使用量前2位头孢类药物参考对比,整理统计如下:(头孢类药物暂无皮试阳性比例数据,附头孢类药物不良反应比率仅供参考)
…… …… 余下全文
篇八 :临床总结报告
SFDA临床试验批准号:2009L00235
儿肤康软膏
治疗小儿湿疮(亚急性湿疹)风热证(Ⅱ期)临床试验总结报告
试验负责单位(盖章):
试验负责单位地址:
试验负责:
试验设计:
试验日期:
试验参加单位:
原始资料保存地点:
联系人姓名:
联系人电话:
申报机构名称(盖章):
药品名称: 资料项目编号:30
临床研究计划与研究方案
试验负责单位(盖章):
试验负责单位地址:
试验负责单位地址:
试验参加单位:
原始资料保存地点:
联系人姓名:
联系人电话:
申报机构名称(盖章):
XX治疗XX病(XX证)临床研究计划
计划做哪几期临床试验
每期的样本量、试验方法
试验单位
试验进度安排
XX治疗XX病(XX证)II(或III)期临床试验方案
…… …… 余下全文