篇一 :混合碱的分析实验报告
实验 《混合碱的分析》实验报告
姓 名: 班 级: 柜 号: 日期:
一、实验目的:
二、原理:
三、实验步骤流程图:
四、实验结果与讨论:
1. mol·L-1HCl溶液浓度的标定
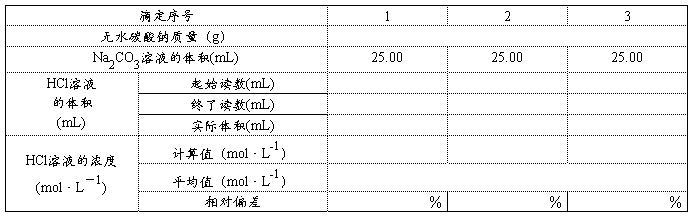
HCl溶液的浓度是 mol·L-1
…… …… 余下全文
篇三 :实验十一 混合碱的分析(双指示剂法)
实验十一 混合碱的分析(双指示剂法)
一、实验目的
⒈ 进一步熟练滴定操作和滴定终点的判断;
⒉ 掌握混合碱分析的测定原理、方法和计算。
二、实验原理
混合碱是NaOH 与Na2CO3,或Na2CO3 与 NaHCO3的混合物,采用双指示剂法,可以测定各组分的含量。
首先,在碱液中加入酚酞指示剂,用HCl标准溶液滴定至溶液略带粉红色,即为第一化学计量点,反应如下:
NaOH + HCl = NaCl+ H2O
Na2CO3+ HCl = NaHCO3 +H2O
此时反应产物为NaHCO3和NaCl,溶液pH为8.3,设所消耗HCl溶液的体积为V1(ml)。
然后,继续加入甲基橙指示剂,用HCl标准溶液滴定至溶液由黄色转变为橙色,即为第二化学计量点,反应如下:
NaHCO3 + HCl = NaCl + H2O + CO2↑
此时溶液pH为3.7。设所消耗HCl溶液的体积为V2(ml)。
根据V1、V2可计算烧碱中NaOH和Na2CO3的含量。
三、实验试剂
混合碱试样;甲基橙指示剂(1g/L水溶液);酚酞指示剂(2g/L乙醇溶液);HCl标准溶液
…… …… 余下全文
篇四 :实验题目:混合碱分析
化学与制药工程学院
工业分析专业实验
实验题目: 混合碱分析
班 级: 应化0704 学 号: 07220410
姓 名: 实验日期:
实验题目:混合碱分析
一、摘要
本实验采用双指示剂法,通过配制一定浓度的HCl,对混合碱进行了定性和定量的分析。用分析纯无水Na2CO3来标定HCl浓度,并用其来滴定配好的混合碱溶液,根据前后两次消耗HCl的体积判断样品中的成分为Na2CO3与NaHCO3 的混合物,并计算各组分的百分含量。
…… …… 余下全文
篇五 :实验九 混合碱中各组分含量的测定
实验九 混合碱中各组分含量的测定(微型滴定法) 一、 实验目的
1. 了解利用双指示剂法测定Na2CO3和NaHCO3混合物的原理和方法。 2. 学习用参比溶液确定终点的方法。 3. 进一步掌握微量滴定操作技术。 二、 实验原理
混合碱是NaCO3与NaOH或NaHCO3与Na2CO3的混合物。欲测定同一份试样中各组分的含量,可用HCl标准溶液滴定,根据滴定过程中pH值变化的情况,选用酚酞和甲基橙为指示剂,常称之为“双指示剂法”。
若混合碱是由Na2CO3和NaOH组成,第一等当点时,反应如下:
HCl+NaOH?NaCl+H2O
HCl+Na2CO3?NaHCO3+H2O
以酚酞为指示剂(变色pH范围为8.0~10.0),用HCl标准溶液滴定至
溶液由红色恰好变为无色。设此时所消耗的盐酸标准溶液的体积为V1(mL)。
第二等当点的反应为: HCl+NaHCO3?NaCl+CO2↑+H2O 以甲基橙为指示剂(变色pH范围为3.1~4.4),用HCl标准溶液滴至溶液由黄色变为橙色。消耗的盐酸标准溶液为V2(mL)。
当V1>V2时,试样为Na2CO3与NaOH的混合物,中和Na2CO3所消耗的HCl标准溶液为2V1(mL),中和NaOH时所消耗的HCl量应为(V1-V2)mL。据此,可求得混合碱中Na2CO3和NaOH的含量。
…… …… 余下全文
篇六 :混合碱的分析
混合碱的分析
一、实验目的:1、学会用双指示剂法测混合碱各组分的组成和含量。
2、掌握酸碱分步滴定的原理。
3、学会计算各组分的含量。
二、实验原理:在混合碱的试液中先加入酚酞指示剂,用HCl标准溶液滴定至 微红色。此时试液中所含NaOH完全被中和,Na2CO3也被滴定 NaHCO3,反应如下:
NaOH+HCl=NaCl+H2O
Na2CO3+HCl=NaCl+NaHCO3
设滴定体积为V1(mL)。再加入甲基橙指示剂,继续用HCl标准 溶液滴定至溶液由黄色变为橙色即为终点。此时NaHCO3被中和 H2CO3的反应式为:
NaHCO3+HCl=NaCl+H2O+CO2↑
设此时消耗HCl标准溶液的体积为V2(mL)。根据V1和V2可以判 混合碱的组成。
三、实验仪器:移液管、酸式滴定管、锥形瓶、洗耳球。
试剂:0.1mol·LHCl标准溶液;甲基橙1g·L水溶液;酚酞2g·L 乙醇溶液。
四、实验步骤和现象:1、用移液管移取25.00mL混合碱于250mL锥形瓶中,加 入2~3滴酚酞,以0.1 mol·LHCl标准溶液滴定至溶液由红
…… …… 余下全文
篇七 :混合碱的分析
混合碱的分析(双指示剂法)
设计人:王韦涛
1 实验目的
(1) 了解酸碱滴定法的应用。
(2) 掌握双指示剂法测定混合碱的原理和组成成份的判别及计算方法。
2 实验原理
混合碱是Na2CO3与 NaOH 或Na2CO3与NaHCO3的混合物。欲测定同一份试样中各组份的含量,可用HCl标准溶液滴定,选用两种不同指示剂分别指示第一、第二化学计量点的到达。根据到达两个化学计量点时消耗的HCl标准溶液的体积,便可判别试样的组成及计算各组份含量。
在混合碱试样中加入酚酞指示剂,此时溶液呈红色,用HCl标准溶液滴定到溶液由红色恰好变为无色时,则试液中所含NaOH完全被中和,Na2CO3则被中和到NaHCO3,若溶液中含 NaHCO3,则未被滴定,反应如下:
NaOH + HCl = NaCl + H2O
Na2CO3 + HCl = NaCl + NaHCO3
…… …… 余下全文
篇八 :分析实验实验报告思考题答案
实验一、NaOH和HCl标准溶液的配制及比较滴定
1.HCl和NaOH标准溶液能否用直接配制法配制?为什么?
答:由于NaOH固体易吸收空气中的CO2和水分,浓HCl的浓度不确定,固配制HCl和NaOH标准溶液时不能用直接法。
2.配制酸碱标准溶液时,为什么用量筒量取HCl,用台秤称取NaOH(S)、而不用吸量管和分析天平?
答:因吸量管用于标准量取需不同体积的量器,分析天平是用于准确称取一定量的精密衡量仪器。而HCl的浓度不定, NaOH易吸收CO2和水分,所以只需要用量筒量取 ,用台秤称取NaOH即可。
3.标准溶液装入滴定管之前,为什么要用该溶液润洗滴定管2~3次?而锥形瓶是否也需用该溶液润洗或烘干,为什么?
答:为了避免装入后的标准溶液被稀释,所以应用该标准溶液润洗滴管2~3次。而锥形瓶中有水也不会影响被测物质量的变化,所以锥形瓶不需先用标准溶液润洗或烘干。
4.滴定至临近终点时加入半滴的操作是怎样进行的?
答:加入半滴的操作是:将酸式滴定管的旋塞稍稍转动或碱式滴定管的乳胶管稍微松动,使半滴溶液悬于管口,将锥形瓶内壁与管口接触,使液滴流出,并用洗瓶以纯水冲下。
…… …… 余下全文